左归降糖解郁方通过调控SIRT1/TORC1通路增加糖尿病并发抑郁症大鼠海马神经元树突棘密度*
2021-04-06王宇红罗薇絮赵洪庆
杨 蕙, 王宇红, 杜 青, 柳 卓, 罗薇絮, 赵洪庆
(1湖南中医药大学第一附属医院,湖南长沙410007;2湖南中医药大学科技创新中心,湖南长沙410206;3湖南省中医药研究院,湖南长沙410006)
临床研究和meta 分析认为,糖尿病和抑郁症互为患病率增加的独立风险因素,可双向诱发疾病发生或加重[1]。由于世界范围内糖尿病患者数量逐年递增,故并发抑郁症的概率也在逐渐升高,尤其是在中等发达及欠发达国家[2]。但是,有关该疾病的发病机制及药物干预研究却较少。左归降糖解郁方是在经典名方左归丸的基础上加减而成,前期研究发现其具有较好的降糖调脂、改善动物抑郁样行为的作用[3],且对外周和中枢胰岛素抵抗均具有较好的调节作用[4]。
沉默信息调节因子1(silent information regulator 1,SIRT1)可作用于多种底物蛋白而参与调控细胞凋亡、自噬、氧化应激、炎症等病理生理过程[5-6]。近年来研究发现,其可通过保护胰岛β 细胞、改善胰岛素抵抗、调节脂质代谢等参与调控葡萄糖稳态,进而抑制糖尿病及糖尿病引起的器官功能损伤,并被视为糖尿病及其并发症治疗新靶点[7-9]。在脑内,SIRT1作为胰岛素信号的重要下游,可被胰岛素信号激活,并通过雷帕霉素靶蛋白复合物(target of rapamycin complex 1,TORC1)增强环磷腺苷反应元件结合蛋白(cAMP-response element binding protein,CREB)的转录功能,增加脑源性神经营养因子(brain-derived neuotrophic factor,BDNF)的表达,参与神经生长并调节神经行为。我们的前期研究已经明确,左归降糖解郁方可通过增加海马BDNF 的表达而缓解糖尿病并发抑郁症大鼠的抑郁样行为[10]。但其是否通过调控SIRT1/TORC1 信号而上调BDNF 表达,尚未可知。故本文拟运用SIRT1 的激动剂和抑制剂,探究SIRT1/TORC1 信号通路与左归降糖解郁方调控糖尿病并发抑郁症大鼠海马BDNF表达的相关性。
材料和方法
1 实验动物、试剂和仪器
SPF 级健康雄性SD 大鼠(190~210 g)购于湖南斯莱克景达实验动物有限公司,许可证号为SCXK(湘)2019-0004。实验中,动物均饲养于湖南中医药大学第一附属医院医学创新实验中心SPF 级动物房中,实验前适应性饲养5 d,动物自由摄食及饮水。
左归降糖解郁方组成为:黄芪18 g,贯叶连翘3 g,姜黄9 g,熟地黄15 g,山茱萸12 g,枸杞12 g,菟丝子9 g,杜仲9 g,丹参12 g,丹皮6 g,牛膝9 g。方中各药均购自于湖南中医药大学第一附属医院,并于医学创新实验中心制备为水煎液,生药浓度为1.14 kg/L。SRT2104和sirtinol购自MedChemExpress;链脲佐菌素(streptozotocin,STZ)购自Solarbio;抗SIRT1 单克隆抗体购自Affinity Biosciences;抗TORC1、p-CREB、CREB 和BDNF 多克隆抗体购自Proteintech;抗GAPDH 多克隆抗体购自Cell Signaling Technology;增强型BCA 蛋白定量试剂盒购自Absin;超敏ECL 化学发光试剂盒购自新赛美生物科技有限公司;高尔基染液套装购自Servicebio。Western blot 系统购自Bio-Rad;正置光学显微镜购自日本尼康。
2 方法
2.1 动物模型的制备及分组 动物给予2 周高脂(high-fat diet,HFD)灌胃后进行一次性STZ 尾静脉注射(38 mg/kg),随后再施加4 周慢性不可预知性温和应激(chronic unpredictable mild stress,CUMS)形成糖尿病并发抑郁症动物模型[11]。首先,将模型动物分为4 组,并设立健康对照:糖尿病并发抑郁症模型(model-1)组、高剂量(20.52 g/kg)左归降糖解郁方(ZJJ-H)组、中剂量(10.26 g/kg)左归降糖解郁方(ZJJ-M)组、低剂量(5.13 g/kg)左归降糖解郁方(ZJJL)组和对照(control)组。其次,给予糖尿病并发抑郁症大鼠海马脑区注射SIRT1 激动剂和抑制剂干预[12],并设立假手术对照和健康对照:SIRT1 激动剂(SRT2104)组、SIRT1抑制剂(sirtinol)组、疾病模型假手术(model-2)组和对照(control)组。最后,给予糖尿病并发抑郁症大鼠高剂量左归降糖解郁方灌胃的同时注射SIRT1 抑制剂:疾病模型假手术(model-2)组、高剂量左归降糖解郁方(ZJJ)组和高剂量左归降糖解郁方灌胃联合SIRT1 抑制剂干预(ZJJ-sirtinol)组。其中,左归降糖解郁方从CUMS 造模开始时给药直到实验结束,共给药28 d;SIRT1 的激动剂(SRT2104)和抑制剂(sirtinol)均从CUMS 造模的第3周开始直到实验结束,共给药14 d,给药浓度均为10 μmol/L[13]。
2.2 动物行为学检测 本文采用悬尾实验和强迫游泳实验对动物的抑郁样行为进行评价。悬尾实验是将动物尾部悬挂于金属挂钩上使动物在整个实验过程中保持倒挂。实验一共持续3.5 min,前30 s 为适应时间,后3 min 为实验时间。实验过程中统计动物的不动时间,并进行统计。强迫游泳实验是将动物置于一个高为40 cm,直径为20 cm 的圆柱形玻璃缸内,水位以动物伸展全身后尾部不碰触缸底为准。实验共持续4 min,前1 min 为适应时间,后3 min 为实验时间。实验以动物不动时间进行统计。上述两个实验中均保证同期实验动物之间不可见,以减少动作干扰。
2.3 血糖检测及胰岛素抵抗评价 各组大鼠在行为学检测结束后禁食12 h,麻醉取腹主动脉血。按照1 200 r/min 离心10 min 后取上层血浆,并按照ELISA 试剂盒说明书检测动物空腹血糖及胰岛素含量。外周胰岛素抵抗指数=空腹血糖含量(mmol/L)×胰岛素含量(mU/L)/22.5。
2.4 高尔基染色 冰上取大鼠脑组织置于固定液中固定72 h,随后切成厚度为3 mm 的组织块。用生理盐水将脑组织轻轻漂洗,置于EP 管中,加入高尔基染液将脑组织完全浸没,放置阴凉通风处避光14 d(浸泡48 h 后,换1 次新染液,之后每隔3 d 换1 次新染液,共计14 d)。将样本取出,置于15%的蔗糖溶液中低温避光脱水1 d,取出组织块;再置于30%的蔗糖溶液中低温避光脱水2 d。随后,蒸馏水洗1 min,浓氨水(浸没组织)处理45 min,蒸馏水洗1 min,酸性坚膜定影液(浸没组织)处理45 min,蒸馏水洗1 min。最后,将样本置于30%的蔗糖溶液中低温避光脱水3 d,采用OCT 包埋,并切为100 μm 的脑切片,常温避光保存过夜后,浸入纯水20 s,用滤纸擦干组织周边多余的水分后,甘油明胶封片。摄片后采用ImageJ分析树突棘数量。
2.5 Western blot检测 将脑海马样本转移至-80℃冰箱保存。检测时,将样本置于蛋白裂解液中,并加入磷酸化酶抑制剂和蛋白酶抑制剂。冰上研磨均匀后静置2 h离心取上清,并用BCA蛋白浓度试剂盒进行蛋白定量。制备凝胶,样本蛋白变性后上样进行SDS-PAGE。随后,在湿式转膜装置中进行转膜。转膜结束后,封闭2 h,并分别加入抗SIRT1、TORC1、p-CREB、CREB 和BDNF 抗体稀释液(1∶1 000),4℃过夜后洗膜并加入Ⅱ抗(1∶3 000),室温孵育1 h。洗膜后用ECL 进行显色。采用ImageJ 软件对所有蛋白条带进行分析。
3 统计学处理
数据分析采用统计软件SPSS 16.0。所有指标均以均数±标准误(mean±SEM)表示。组间均数比较采用单因素方差分析。以P<0.05 为差异有统计学意义。
结果
1 左归降糖解郁方降低模型大鼠血糖并改善外周胰岛素抵抗
与对照组比较,模型组大鼠的血糖和外周胰岛素抵抗指数均显著升高(P<0.01);与模型组大鼠相比,高剂量和中剂量左归降糖解郁方组大鼠血糖和外周胰岛素抵抗指数均显著降低(P<0.05 或P<0.01),而低剂量组与模型组相比差异无统计学显著性(P>0.05);高剂量左归降糖解郁方对模型大鼠血糖和胰岛素抵抗的改善作用要显著优于低剂量(P<0.01),而中剂量对大鼠胰岛素抵抗的作用优于低剂量(P<0.05),见表1。
2 左归降糖解郁方减少模型大鼠的抑郁样行为
与对照组比较,模型组大鼠在强迫游泳实验和悬尾实验中的不动时间均明显延长(P<0.01);与模型组比较,高剂量左归降糖解郁方可显著减少大鼠在强迫游泳实验和悬尾实验中的不动时间(P<0.01);而中剂量组大鼠在悬尾实验中的不动实验明显缩短(P<0.05),但在强迫游泳实验中差异无统计学显著性(P>0.05);与对照组比较,低剂量组大鼠在行为学实验中的差异未见统计学显著性(P>0.05);高剂量左归降糖解郁方对大鼠悬尾实验和强迫游泳实验不动时间的改善作用明显优于低剂量(P<0.05或P<0.01),见表1。
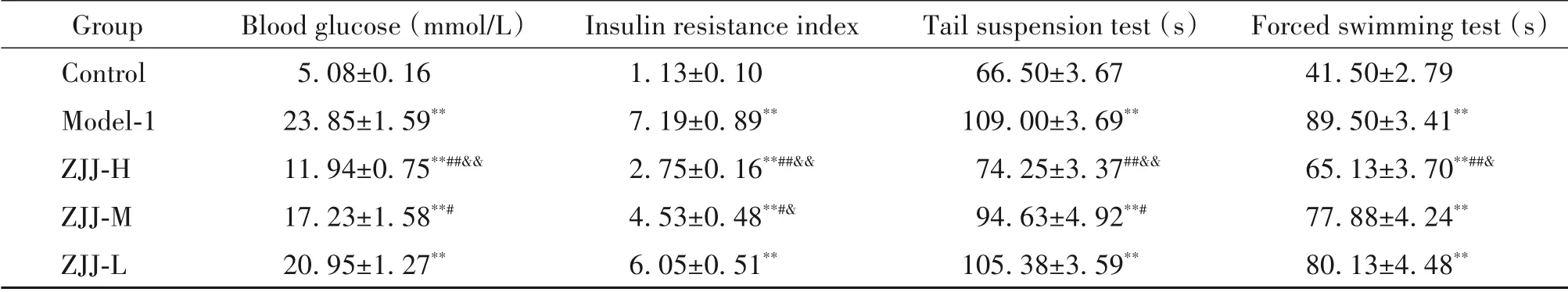
表1 左归降糖解郁方对糖尿病并发抑郁症模型大鼠血糖、胰岛素抵抗指数和抑郁样行为的影响Table 1. Effect of Zuogui-Jiangtang-Jieyu decoction(ZJJ)on blood glucose,insulin resistance and depression-like behaviors of the diabetic rats with depression(Mean±SEM. n=8)
3 左归降糖解郁方增加模型大鼠海马的树突棘密度
与对照组比较,模型组大鼠海马树突棘密度显著减少(P<0.01);与模型组比较,高剂量和中剂量左归降糖解郁方组大鼠的树突棘密度显著增加(P<0.01),而低剂量左归降糖解郁方则对模型大鼠海马树突棘密度没有显著性影响(P>0.05);与低剂量左归降糖解郁方组比较,高剂量组和中剂量组海马树突棘密度的增加更为显著(P<0.05 或P<0.01),见图1。
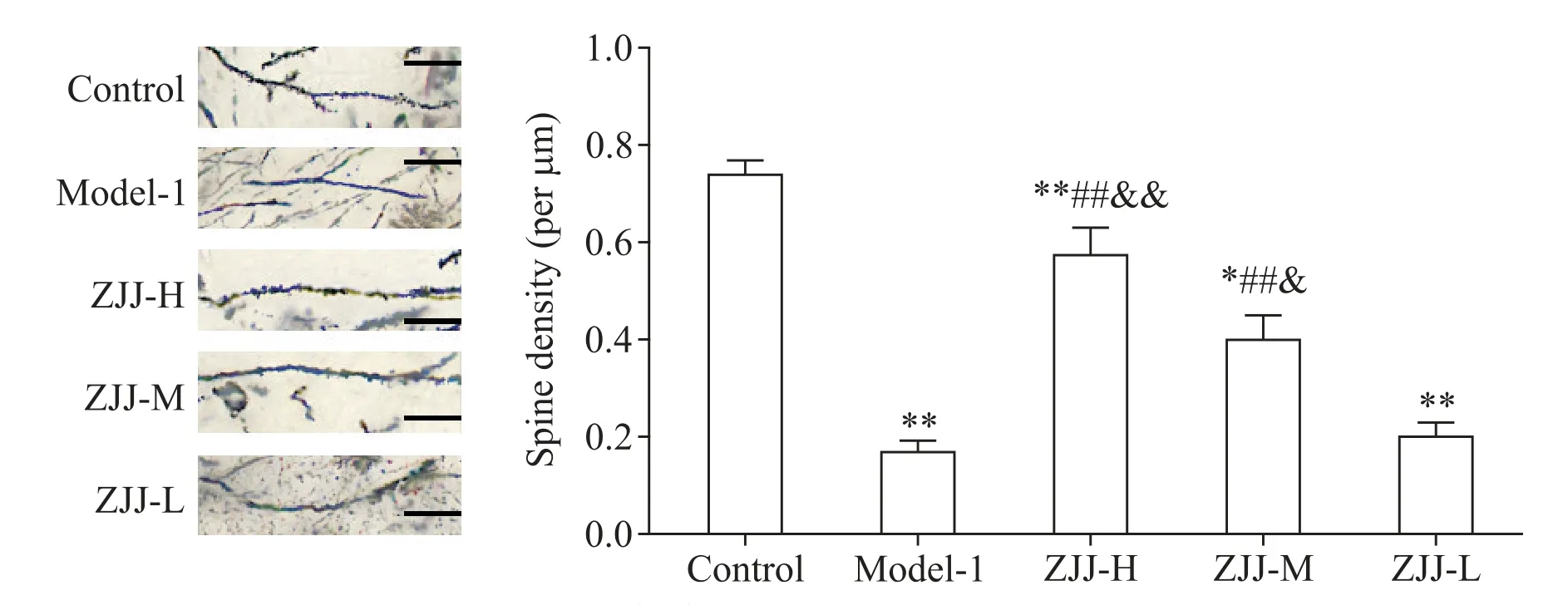
Figure 1. Effect of Zuogui-Jiangtang-Jieyu decoction(ZJJ)on spine density of hippocampal neurons in diabetic rats with depression(scale bar=50 μm). Mean±SEM. n=4. *P<0.05,**P<0.01 vs control group;##P<0.01 vs model-1 group;&P<0.05,&&P<0.01 vs ZJJ-L group.图1 左归降糖解郁方对糖尿病并发抑郁症模型大鼠海马树突棘密度的影响
4 左归降糖解郁方对SIRT1/TORC1 信号的调节作用
与对照组比较,模型组大鼠海马SIRT1 和TORC1 的表达均显著降低(P<0.01);与模型组比较,高剂量左归降糖解郁方可显著升高模型大鼠海马SIRT1 和TORC1 的表达(P<0.01),中剂量仅显著上调海马SIRT1 的表达(P<0.05),而低剂量对上述蛋白则无显著的调节作用(P>0.05);高剂量左归降糖解郁方对SIRT1/TORC1信号的调节作用优于低剂量(P<0.05或P<0.01),见图2。
5 激活SIRT1/TORC1 信号增强神经营养因子表达及树突棘密度
与模型组比较,SIRT1 激动剂可显著提高海马TORC1、p-CREB 和BDNF 蛋白水平(P<0.05 或P<0.01);SIRT1 抑制剂可显著降低海马BDNF 的表达(P<0.01),但对TORC1 和p-CREB 蛋白水平无显著影响(P>0.05);与SIRT1 抑制剂比较,SIRT1 激动剂可显著提高TORC1、p-CREB 和BDNF 蛋白水平(P<0.01);与模型组比较,SIRT1 激动剂可显著增加模型大鼠海马树突棘密度(P<0.01),而其抑制剂对树突棘密度未见显著影响(P>0.01);与SIRT1 抑制剂比较,其激动剂可显著增加海马树突棘的密度(P<0.05),见图3。
6 左归降糖解郁方调控SIRT1/TORC1 信号增强神经营养作用及树突棘密度
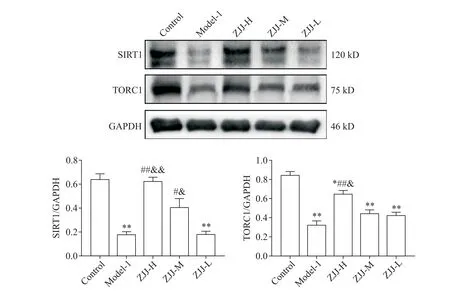
Figure 2. Effect of Zuogui-Jiangtang-Jieyu decoction(ZJJ)on SIRT1/TORC1 signaling pathway in hippocampus of diabetic rats with depression. Mean±SEM. n=4. *P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs model-1 group;&P<0.05,&&P<0.01 vs ZJJ-L group.图2 左归降糖解郁方对糖尿病并发抑郁症模型大鼠海马SIRT1/TORC1信号的影响
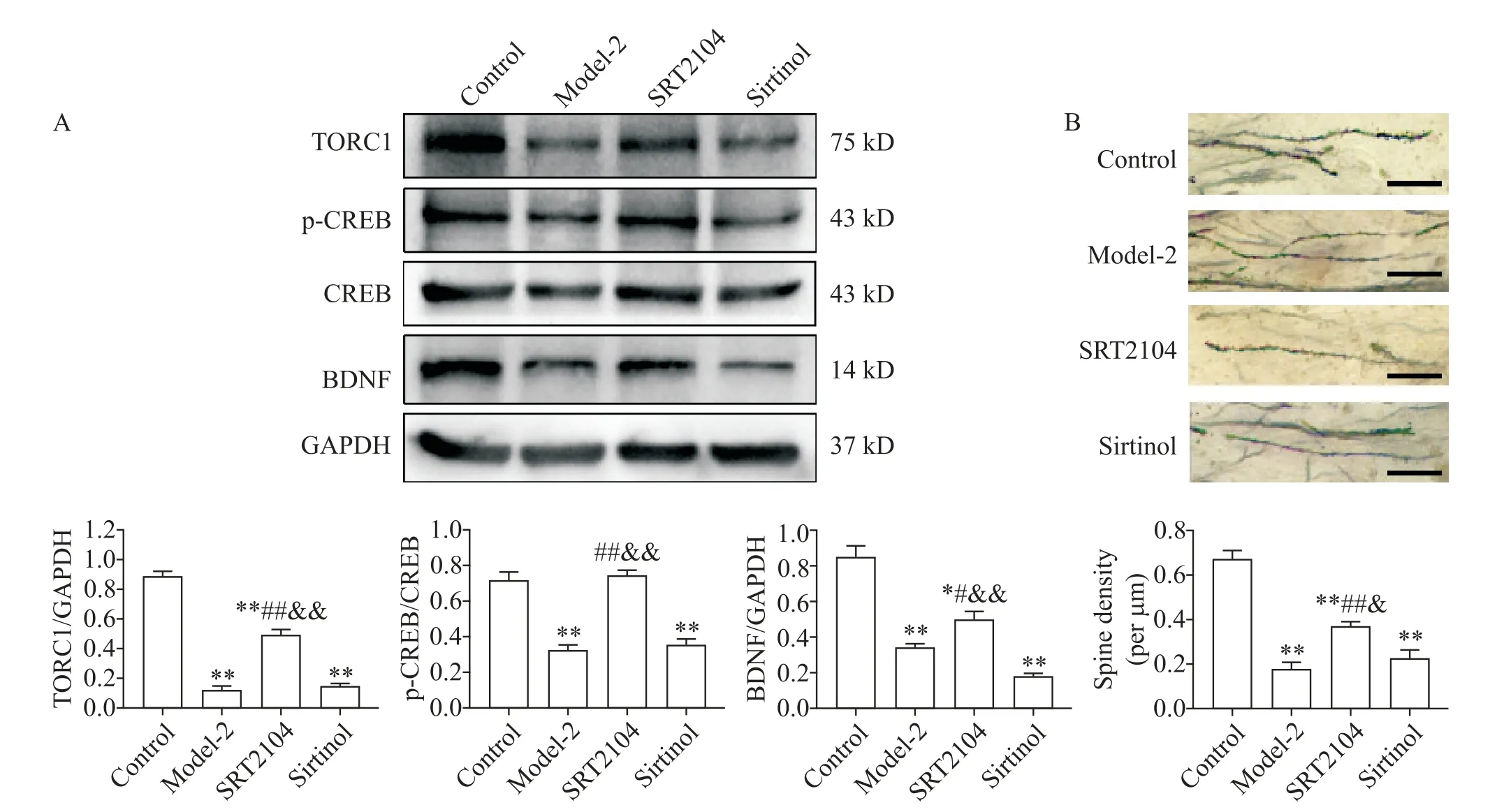
Figure 3. Effects of the SIRT1 activator and inhibitor on neurotrophy and spine density of hippocampal neurons in diabetic rats with depression. A:the protein levels of TORC1,p-CREB and BDNF in the hippocampus;B:the spine density of hippocampal neurons(scale bar=50 μm). Mean±SEM. n=4. **P<0.01 vs control group;#P<0.05,##P<0.01 vs model-2 group;&P<0.05,&&P<0.01 vs sirtinol group.图3 SIRT1激动剂和抑制剂对糖尿病并发抑郁症大鼠海马神经营养和树突棘的作用
与模型组比较,高剂量左归降糖解郁方可显著提高模型大鼠海马TORC1、p-CREB 和BDNF 蛋白水平及树突棘密度(P<0.05或P<0.01);与高剂量左归降糖解郁方组比较,SIRT1 抑制剂可显著减弱左归降糖解郁方对模型大鼠海马TORC1、p-CREB 和BDNF 蛋白水平及树突棘密度的提高作用(P<0.05),见图4。
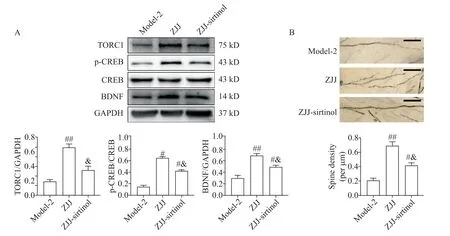
Figure 4. Effects of the Zuogui-Jiangtang-Jieyu decoction(ZJJ)on neurotrophy and spine density of hippocampal neurons via SIRT1/TORC1 signaling pathway. A:the protein levels of TORC1,p-CREB and BDNFin the hippocampus;B:the spine density of hippocampal neurons(scale bar=50 μm). Mean±SEM. n=4. #P<0.05,##P<0.01 vs model-2 group;&P<0.05 vs ZJJ group.图4 左归降糖解郁方调控SIRT1/TORC1信号改善神经营养和海马树突棘密度
讨论
本实验所用复方左归降糖解郁方是依据糖尿病并发抑郁症的“虚、淤、郁”中医病机[14],以疏肝解郁、活血化瘀为治法,在经典名方左归丸的基础上加减而得。方中熟地为君,滋养肾阴;山茱萸和枸杞为臣,合君药以加强滋补肾阴作用;佐以菟丝子、牛膝和杜仲补肝肾,黄芪健脾益气,丹参和丹皮活血散瘀,姜黄和贯叶连翘化瘀行气、疏肝解郁。全方共奏疏肝解郁、活血化瘀之功效。实验可见,左归降糖解郁方可有效降低糖尿病并发抑郁症大鼠外周血糖并减轻胰岛素抵抗,同时在经典的动物抑郁行为评价实验——悬尾实验和强迫游泳实验中均可见左归降糖解郁方的抗抑郁作用。上述结果与之前的研究保持一致[15]。
前期研究发现,左归降糖解郁方可有效改善糖尿病并发抑郁症大鼠海马神经元的胰岛素信号,从而改善细胞供能[4]。事实上,胰岛素信号在脑内不仅调节神经元的能量代谢,还可通过影响神经元树突的形成和生长,参与调节动物的神经行为。我们通过Golgi-Cox 染色研究发现,糖尿病并发抑郁症大鼠海马树突棘密度显著降低,高剂量和中剂量左归降糖解郁方均明显减轻海马的上述损伤。由于树突棘密度改变可直接影响突触的传递功能,而海马中树突棘密度降低所导致的突触可塑性下降又与抑郁症的发生密切相关[16-17]。因此推测,左归降糖解郁方减少糖尿病并发抑郁症大鼠的抑郁样行为可能与其调控树突棘密度相关。
近年来,脑胰岛素抵抗被认为是糖尿病和抑郁症之间的重要联系,且以胰岛素信号异常为主要表现形式[18]。已有较多研究表明,脑胰岛素信号异常可导致海马树突棘密度降低、数量减少等形态损伤,并引发抑郁样行为和学习记忆减退等表现[19],但其分子机制尚未完全清楚。SIRT1 是胰岛素信号的重要下游分子,同时也是最新发现的抑郁症靶标[20]。当脑内发生胰岛素抵抗时,胰岛素受体底物1(insulin receptor substrate-1,IRS-1)酪氨酸位点磷酸化水平降低,可通过下调AMPK活性导致SIRT1的脱乙酰能力被抑制,从而使SIRT1 介导TORC1 固定位点的赖氨酸残基脱乙酰化失败,SIRT1/TORC1 信号通路被抑制[21]。本研究中,左归降糖解郁方可显著升高糖尿病并发抑郁症大鼠海马中下调的SIRT1 和TORC1 蛋白水平,提示了其对SIRT1/TORC1 信号通路的调节作用。此外,由于SIRT1基因敲除小鼠海马可见突触可塑性降低及树突分支减少,并被认为与SIRT1 蛋白的催化活性缺失有关[22],故进一步推测,左归降糖解郁方对糖尿病并发抑郁症大鼠海马树突棘的改善作用可能与其调节SIRT1/TORC1信号通路有关。事实上,也有研究发现SIRT1 可通过调节细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)表达影响慢性应激大鼠的抑郁样行为[13],或是通过干预过氧化物酶增殖体激活受体γ 辅激活因子1α(peroxisome proliferator-activated receptor γ coactivator 1α,PGC-1α)的脱乙酰化影响神经元的谷氨酸毒性,进而导致抑郁样行为的发生[23]。故左归降糖解郁方调节SIRT1 蛋白、减少糖尿病并发抑郁症大鼠抑郁样行为的下游分子机制值得进一步研究。
神经营养对于树突棘的生长非常重要,研究发现BDNF 可促进树突棘的增加。而TORC1 作为一种转录辅激活因子,可通过增强CREB 的转录功能,增加神经营养因子BDNF 的表达[24]。在本研究中,我们对糖尿病并发抑郁症大鼠分别注射了SIRT1 的激动剂和抑制剂。结果显示,SIRT1 激动剂可显著提高疾病模型大鼠海马中TORC1、p-CREB 和BDNF 蛋白水平,且显著增加海马树突棘密度,即激活糖尿病并发抑郁症大鼠海马SIRT1/TORC1信号可通过增强神经营养而提高树突棘的密度;而SIRT1 抑制剂对模型大鼠海马树突棘密度及TORC1 和p-CREB 蛋白水平无显著影响。推测造成上述结果的原因可能是糖尿病并发抑郁症大鼠本身就存在海马TORC1、p-CREB 和BDNF 蛋白的显著下调和树突棘密度的降低,导致抑制剂的作用在疾病背景下不能表现出来。而该推测可进一步通过研究SIRT1 抑制剂对正常大鼠的影响进行验证。
为进一步研究左归降糖解郁方调控SIRT1/TORC1信号通路影响海马树突棘的分子机制。本实验选择了对糖尿病并发抑郁症大鼠海马SIRT1/TORC1信号通路作用最显著的高剂量左归降糖解郁方进行研究。与高剂量左归降糖解郁方干预的单一措施相比,SIRT1 抑制剂可显著减弱高剂量左归降糖解郁方对大鼠海马TORC1、p-CREB 和BDNF 蛋白水平及树突棘密度的提高作用。该结果进一步明确了左归降糖解郁方对糖尿病并发抑郁症大鼠海马SIRT1/TORC1 信号的作用,同时提示其可能通过调控SIRT1/TORC1 信号通路而增强海马BDNF 的表达。
综上所述,本研究认为左归降糖解郁方可干预糖尿病并发抑郁症大鼠海马SIRT1/TORC1 信号通路,并可能通过增强海马神经营养而提高神经元的树突棘密度,从而发挥抗抑郁的作用。
