青藤碱调控CUMS抑郁大鼠突触可塑性及其对Notch和mTOR信号通路的影响*
2021-04-06王志坚王晓敏刘胜兵郭燕君潘巍巍沈忠飞
王志坚, 王晓敏, 刘胜兵, 郭燕君, 潘巍巍, 沈忠飞
(嘉兴学院医学院,浙江嘉兴314000)
抑郁症是一种多因素导致的复杂的精神疾病,主要表现为思维认知障碍、情绪低迷和自杀倾向等,全球约11%的人患有抑郁症,给患者、家人和社会造成了巨大的精神和经济负担,严重阻碍了社会的发展。大量研究表明,抑郁症是一种炎症性疾病[1],炎症因子在抑郁症的发病进程中起到重要作用,已成为抑郁症的重要治疗靶点和研究热点。近年来,国家大力支持中医药发展,尤其是在此次新冠肺炎疫情的预防和治疗中,中医药表现出良好的效果,开发新的中医药抗抑郁药物是一项响应国家号召的紧迫任务。
青藤碱(sinomenine,Sin),是一种来源于中草药防己科植物青藤的生物碱,临床上广泛用于系膜增生性肾炎和类风湿性关节炎治疗[2],另外Sin 还有抗肿瘤、细胞保护、免疫抑制和抗炎作用[3]。近年来研究表明,Sin 对神经疾病具有一定的作用,可通过提高脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)的表达缓解抑郁症状[4],亦能通过抑制神经炎症减轻大鼠脑缺血再灌注损伤[5],但其对抑郁症炎症反应影响的研究比较少。
本实验室前期研究显示,30、50 和100 mg·kg-1·d-1的Sin 均能够缓解慢性不可预见性温和应激(chronic unpredictable mild stress,CUMS)抑郁大鼠的抑郁症状,减轻炎症反应,且在30 mg·kg-1·d-1的低剂量灌胃处理就有着较好的效果,但对突触可塑性、细胞凋亡、Notch 信号通路、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路等的影响尚不明确。本研究旨在探讨Sin 对CUMS抑郁大鼠突触可塑性的影响及可能的分子机制。
材料和方法
1 材料
1.1 动物 健康雄性清洁级7 周龄SD 大鼠120 只,体重180~210 g,从浙江大学实验动物中心购买,许可证号为SYXK(浙)2018-0016。
1.2 试剂和主要仪器 兔抗Bcl-2、cleaved caspase-3(C-C3)、β-actin、BDNF、Notch1、Hes1、Jagged1、mTOR、磷 酸 化mTOR(phosphorylated mTOR,pmTOR)、真核细胞翻译起始因子4E 结合蛋白1(eukaryotic translation initiation factor 4E-binding protein 1,4EBP1)和磷酸化4EBP1(phosphorylated 4EBP1,p-4EBP1)抗体及山羊抗兔Ⅱ抗(Cell Signaling Technology);氟西汀(fluoxetine,Fluo;礼来制药有限公司);Sin(Sigma);高尔基染色试剂盒(FD Neuro Technologies)。荧光定量PCR 仪(AFD4800);凝胶电泳仪(Bio-Rad);动物行为自动跟踪系统EthoVision 3.0(Noldus);其他试剂来自碧云天生物技术有限公司。
2 方法
2.1 分组和建模 大鼠适应性饲养1 周后,随机分为对照(control,Ctrl)组、CUMS 组、Fluo 组和Sin 组(n=30),均单笼饲养。饲养环境:12 h 光照/12 h 黑暗(光照时间:早7 点到晚7 点),湿度(55±5)%,温度(22±2)℃,自由进食进水。对照组正常饲养,其余3组采用孤养法并结合CUMS 建立CUMS 抑郁模型[6],按表1,每天给予一种刺激,其中连续2 天的刺激不相同,合计刺激28 d。
2.2 给药 连续刺激2 周后,将Fluo 和Sin 溶于生理盐水中,开始对Fluo 组和Sin 组大鼠分别给予Fluo(20 mg·kg-1·d-1)[6]和Sin(30 mg·kg-1·d-1)[5]灌胃治疗,Ctrl 组和CUMS 组均灌胃相同体积的生理盐水。连续灌胃2周时间。
2.3 行为学测试 (1)体重:建模结束后分别称量各组大鼠体重,记录并制作柱状图。(2)糖水测试:建模结束后,事先给与各组大鼠2 瓶1%糖水,进行适应训练;禁水12 h 后,准备2 瓶水,重量相同,分别编号A 和B,A 为1%糖水,B 为平时喝的水,1 h 后称量记录A 和B 重量。糖水偏好(%)=A 减少克数/(A+B减少克数)×100%。(3)旷场实验:建模后,根据旷场实验步骤[7],记录分析各组大鼠在格子里面的移动总距离和中央活动时间,每只大鼠测试前均应清理干净旷场区域,以免产生干扰。(4)强迫游泳:参照文献进行[5],记录大鼠游泳6 min 中后4 min 的不动时间,即头部不能进入水中,直立姿势漂浮的时间。

表1 温和刺激名称及刺激时间Table 1. The name of each mild stimulus and stimulating time
2.4 RNA 提取及qPCR 大鼠麻醉后迅速断头取脑,冰上拨出海马组织,液氮中研磨并加入Trizol 试剂,按照说明书步骤提取组织中的总RNA。计算RNA 浓度并用Fermentas 试剂盒反转录成cDNA,再进行qPCR[7],并根据2-ΔΔCt计算出各目的基因的相对表达量。引物序列见表2。

表2 引物序列Table 2. Sequences of the primers
2.5 蛋白质提取及Western blot 参照文献[6],大鼠麻醉后断头取脑,迅速分离海马组织后放-80℃冰箱备用。冰箱取出后加入液氮和裂解液,于研钵中研磨裂解,经4℃离心,取上清液测定蛋白浓度(BCA 试剂盒),定量后煮沸变性,配胶上样(30 μg总蛋白)进行SDS-PAGE,转膜至PVDF 膜上,用5%的脱脂奶粉封闭1 h 后,4℃冰箱过夜孵育Ⅰ抗(BDNF、Notch1、Hes1、Jagged1、Bcl-2、C-C3、p-mTOR、mTOR、p-4EBP1、4EBP1 和β-actin),用PBST 缓冲液洗涤各条带(每次5 min,共3 次),室温孵育Ⅱ抗2 h,用PBST缓冲液洗涤各条带(每次5 min/次,共3 次),加入发光剂显影定影,条带扫描后用ImageJ 测算目的蛋白的灰度值[8]。
2.7 高尔基染色 10%水合氯醛(3 mL/kg)麻醉大鼠后,迅速处死取脑,经PBS 缓冲液洗涤后放入等体积的A 液和B 液混合液中,6 h 后更换一次新鲜的A液B 液混合液,连续浸泡14 d 后,取出脑组织放入C液(避光),24 h 后更换新鲜C 液并在4℃冰箱避光保存3 d。冰箱取出脑组织沉入甘油(15%)和蔗糖(20%)混合液中24 h,用冰冻切片机进行常规切片(100 μm),贴在载玻片上,经过不同梯度(50%、75%、95%和100%)的乙醇脱水和二甲苯透明后,用中性树胶封片,显微镜下观察,选择典型CA1区神经元并拍照,用ImageJ 软件分析由胞体发出的树突上第一个树突分支,即二级树突上(长度30~60 μm)的树突棘数量,计算10 μm 的平均树突棘数量,即得到树突棘密度[8]。
2.8 苏木精-伊红(hematoxylin-eosin,HE)染色 将大鼠麻醉处死,取出脑组织进行固定透明并石蜡包埋,在石蜡切片机上切片后经过二甲苯和不同浓度的乙醇进行脱蜡,进行常规HE 染色,然后再经过不同浓度的乙醇脱水和二甲苯透明后,用中性树胶封片,于显微镜下观察[8]。
2.9 ELISA 实验 取各组大鼠海马部称重匀浆离心取上清液,按照ELISA 试剂盒(碧云天)步骤检测海马中白细胞介素1β(interleukin-1β,IL-1β)、IL-6和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)的含量[5],单位为μg/(g tissue)。
3 统计学处理
应用GraghPad Prism 8 和SPSS 17 统计学软件分析数据。数据以均数±标准差(mean±SD)表示。多组之间采用单因素方差分析,用SNK-q检验进行两两比较。以P<0.05为差异有统计学意义。
结果
1 Sin作用后体重、糖水偏好和行为学指标的变化
如图1 所示,与Ctrl 组相比,CUMS 组大鼠体重和旷场实验中央不动时间显著减少,糖水偏好和旷场实验总距离显著下降,强迫游泳不动时间显著增加;而Sin作用后,体重、移动总距离和中间停留时间均显著增加,强迫游泳中的不动时间显著降低,糖水偏好显著增加(P<0.05)。
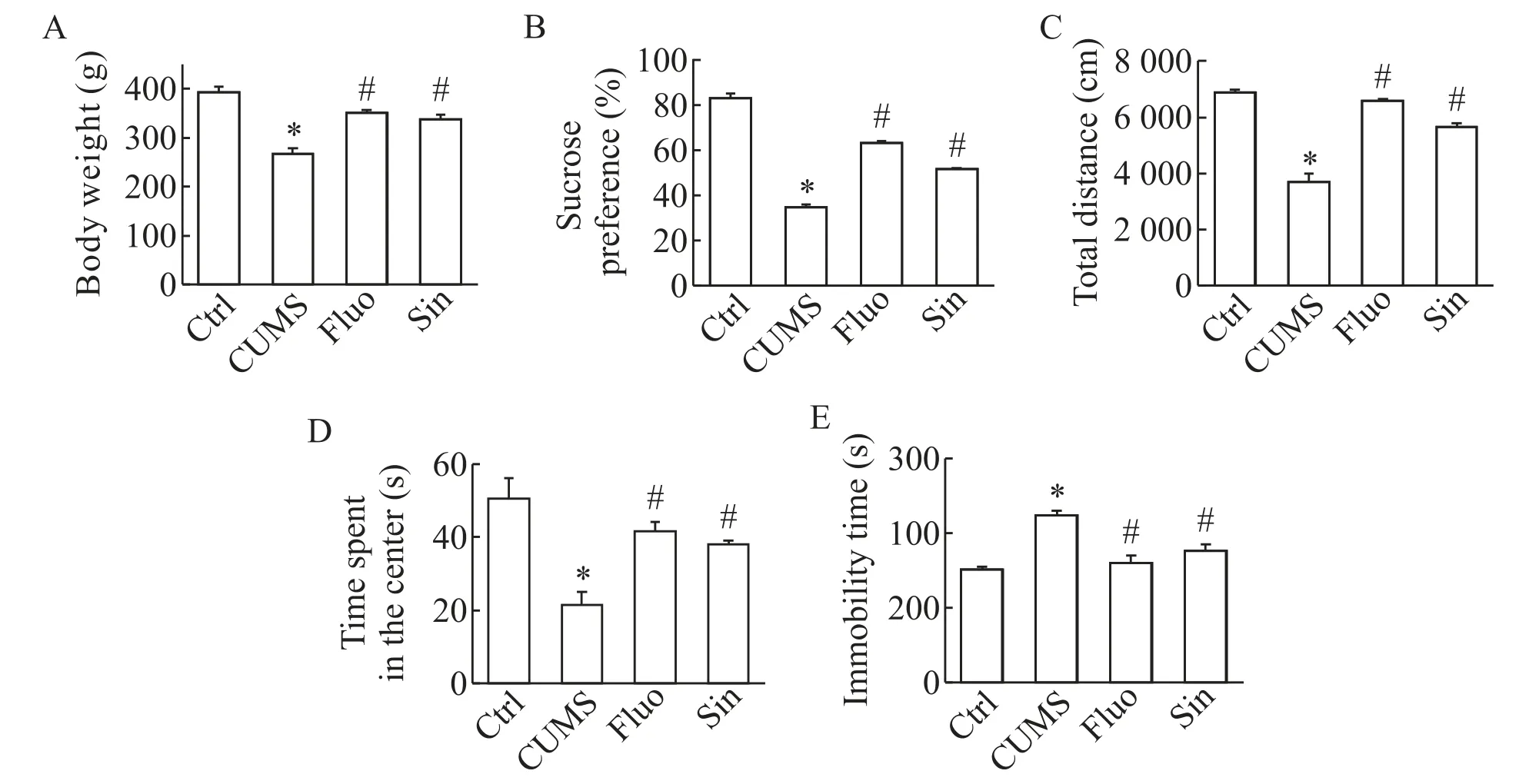
Figure 1. The changes of body weight,sucrose preference and behavioral indicators in the 4 groups. A:body weight;B:sucrose preference;C:total distance;D:open-field test;E:forced swimming. Mean±SD. n=30. *P<0.05 vs control group;#P<0.05 vs CUMS group.图1 4组大鼠之间体重、糖水摄取及行为学指标的变化
2 Sin 作用后海马结构完整,树突棘密度升高,突触相关蛋白表达上调
与Ctrl 组相比,CUMS 组海马区细胞排列紊乱,细胞间隙增大,多数细胞变性萎缩(图2A);树突棘密度下降(P<0.05),见图2B;突触重塑相关蛋白BDNF 在蛋白和mRNA 水平均显著下调(P<0.05),见图2C、D。Sin 作用后,海马区细胞形态为圆形较规则,细胞核清晰(图2A);树突棘密度显著升高(P<0.05),见图2B;BDNF 表达在蛋白和mRNA 水平均显著上调(P<0.05),见图2C、D。
3 Sin 作用后海马Notch 信号通路相关蛋白表达上调
Western blot 结果显示,与Ctrl 组相比,CUMS 组Notch1、Hes1和Jagged1表达显著下调(P<0.05);Sin作用后,Notch1、Hes1 和Jagged1 表达显著上调(P<0.05),见图3A。qPCR 结果与Western 结果一致,见图3B。
4 Sin作用后海马Bcl-2表达上调,C-C3表达下调
如图4 所示,与Ctrl 组相比,CUMS 组抗凋亡蛋白Bcl-2表达显著下调(P<0.05),凋亡蛋白caspase-3活化形式C-C3 表达显著上调(P<0.05);Sin 作用后,Bcl-2表达显著上调(P<0.05),C-C3表达显著下调(P<0.05)。我们同时用qPCR 检测Bcl-2 和caspase-3 的mRNA 水 平,结 果 与Western blot 结 果一致。
5 Sin 作用后海马mTOR 信号通路相关蛋白表达上调
如图5 所示,与Ctrl 组相比,CUMS 组mTOR 和下游靶基因4EBP1磷酸化水平显著降低;Sin处理后p-mTOR和p-4EBP1均显著上调(P<0.05)。
6 Sin作用后海马炎症反应降低
ELISA 结果显示,与Ctrl 组相比,CUMS 组大鼠海 马 组 织中IL-1β、IL-6 和TNF-α 显 著 上 调(P<0.05);Sin 处理后,IL-1β 和TNF-α 显著下调(P<0.05),而IL-6无显著变化(P>0.05),见图6。
讨论
抑郁症严重影响患者的健康和生活质量,成为一个不可忽视的社会问题。CUMS法建立抑郁模型,能够有效模拟抑郁症状且症状稳定,被广泛用于抑郁症治疗相关研究。根据文献建立CUMS 模型[6,9],建模28 d 后,CUMS 组体重、糖水偏好、旷场实验总距离和中间停留时间均显著降低,强迫游泳不动时间明显增加,这与文献结果一致,说明抑郁模型建立是成功的。Sin 灌胃处理后,上述抑郁症状均明显减轻,说明Sin 具有一定的抗抑郁作用,可能是潜在的治疗抑郁症的药物。
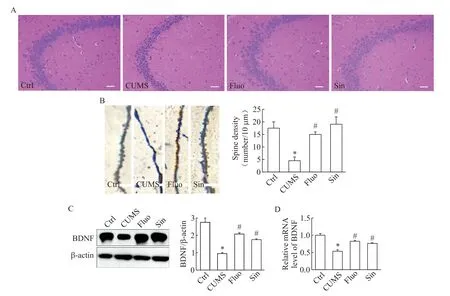
Figure 2. The changes of hippocampal structure,dendritic spine density and BDNF expression in Sin-treated CUMS rats. A:HE staining of hippocampal structure(scale bar=100 μm);B:Golgi staining of secondary dendrites and dendritic spines(scale bar=20 μm);C,D:the expression of BDNF at protein and mRNA levels. Mean±SD,n=3. *P<0.05 vs control group;#P<0.05 vs CUMS group.图2 Sin作用后大鼠海马结构、树突棘密度和突触重塑相关蛋白BDNF的变化
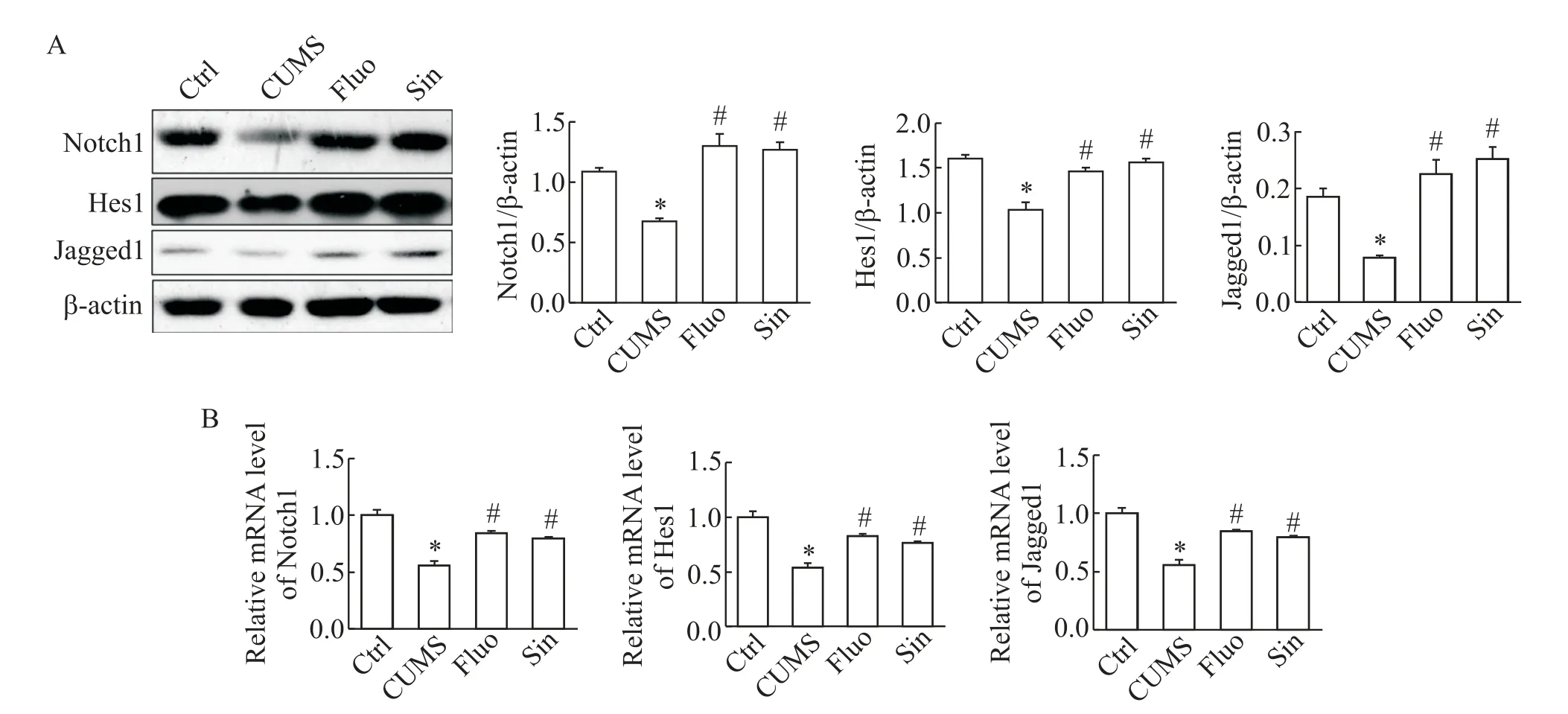
Figure 3. The changes of Notch signaling proteins Notch1,Hes1 and Jagged1 in Sin-treated CUMS rats. A:Western blot results;B:qPCR results. Mean±SD. n=3. *P<0.05 vs control group;#P<0.05 vs CUMS group.图3 Sin作用后Notch信号通路蛋白Notch1、Hes1和Jagged1表达的变化
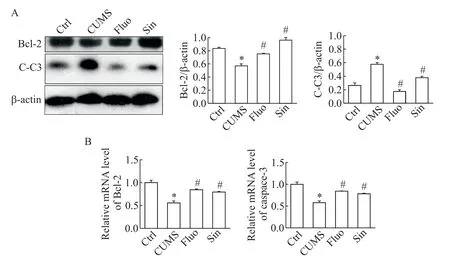
Figure 4. The changes of apoptosis-related proteins Bcl-2 and cleaved caspase-3(C-C3)in Sin-treated CUMS rats. A:Western blot results;B:qPCR results. Mean±SD. n=3. *P<0.05 vs control group;#P<0.05 vs CUMS group.图4 Sin作用后细胞凋亡相关蛋白Bcl-2和C-C3的变化
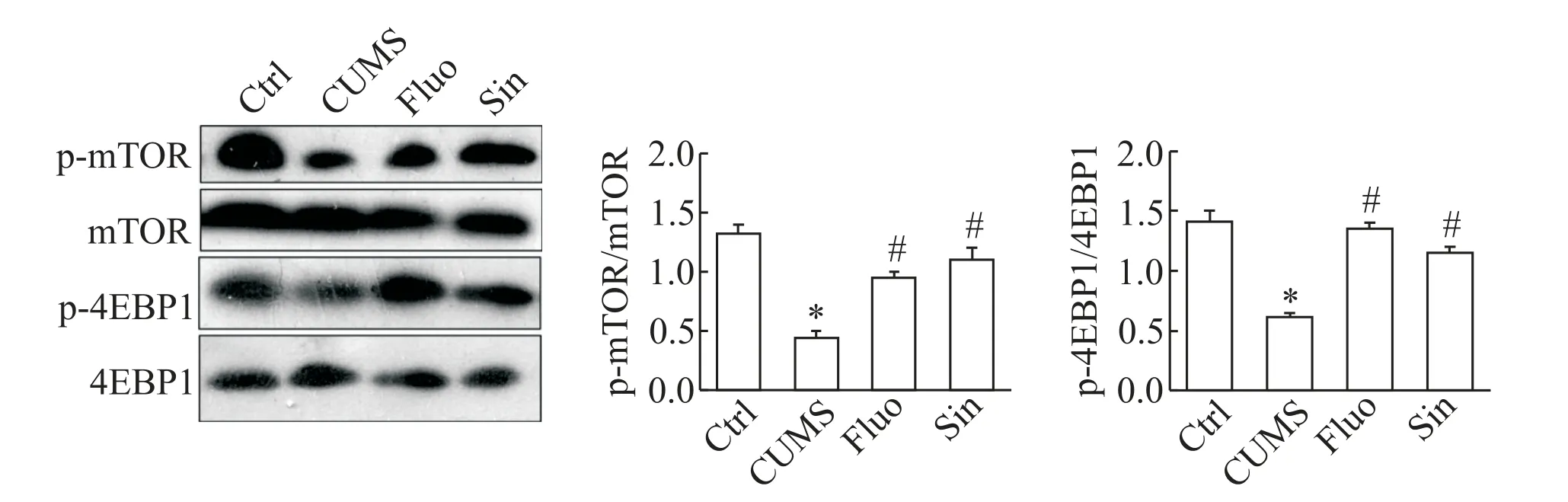
Figure 5. The phosphorylation levels of mTOR and 4EBP1 in Sin-treated CUMS rats. Mean±SD. n=3. *P<0.05 vs control group;#P<0.05 vs CUMS group.图5 Sin作用后mTOR和4EBP1磷酸化水平的变化

Figure 6. The changes of IL-1β,IL-6 and TNF-α in Sin-treated CUMS rats. Mean±SD. n=6. *P<0.05 vs control group;#P<0.05 vs CUMS group.图6 Sin作用后炎性因子IL-1β、IL-6和TNF-α的变化
近年研究表明,抑郁症发病与海马突触重塑性的改变紧密关联。抑郁发生后,海马突触重塑相关基因表达下调,伴随神经元的萎缩以及突触结构和功能的改变,而氟西汀等抗抑药物治疗后海马突触可塑性得到明显改善[10]。重度抑郁患者海马区椎体细胞体积变小,并伴随突触蛋白表达下调。突触重塑包括结构和功能重塑,海马神经元结构完整性、树突棘密度的改变直接影响着树突的功能[11]。此外,神经营养因子维持神经元生存、生长和微环境,并参与大脑学习和记忆[12],对突触重塑起着重要的调节作用,其中最重要的营养因子是BDNF,在海马和大脑皮层等丰富表达[13],抑郁发生时,BDNF表达减少,甚至发生基因缺陷,无法正常表达。长时程增强(long-term potentiation,LTP)是重要的功能突触可塑性,必须依赖BDNF 才能实现,因此BDNF 是重要的突触可塑性相关蛋白[20]。本实验中Sin处理后,抑郁大鼠海马区细胞形态为圆形较规则,细胞核清晰,树突棘密度显著升高,BDNF 表达在蛋白和mRNA 水平均显著上调,说明Sin 作用后海马突触可塑性明显上调。
Notch 信号通路进化上十分保守,主要由受体、配体和下游靶分子等组成,Notch1、Jagged1 和Hes1分别是重要的受体、配体和下游靶分子,在脑内尤其海马组织中高表达。有研究表明,糖氧剥夺和脑缺血后,大鼠体内Notch 信号通路被激活,体内阻断Notch 通路,脑部多巴胺神经元减少,多巴胺分泌骤减直接引起一系列精神病症状,与脑缺血损伤、阿尔兹海默症和抑郁等多种神经疾病发生有关[14]。Notch 信号通路在突触重塑、学习、记忆的调控中具有非常重要的作用[15]。本研究中,Sin 处理后,抑郁大鼠海马组织Notch1、Jagged1 和Hes1 表达均上调,Notch信号通路被激活,Sin可能通过激活Notch信号通路蛋白的表达改善海马突触可塑性。
抑郁发生时伴随着较高的凋亡水平,5-HT 再摄取抑制剂氟西汀,通过上调突触体多唾液酸神经细胞粘附分子的表达调节突触可塑性,且凋亡水平显著下调[16];柴胡皂苷也通过降低海马细胞凋亡水平缓解大鼠抑郁症状[17]。这说明细胞凋亡是重要的致病因素和治疗靶点。本实验中Sin作用后,抑郁大鼠抗凋亡蛋白Bcl-2 表达上调,C-C3 表达下调,说明凋亡水平显著降低,Sin可能通过抑制细胞凋亡缓解大鼠抑郁症状。
研究表明,mTOR 通过磷化下游靶分子4EBP1调控海马部突触重塑相关蛋白的表达,与突触可塑性的调节密切相关,如内稳态突触可塑性的调控依赖mTOR 信号通路[18],在大鼠内嗅-海马通路中调节疼痛相关突触可塑性[19]。抗抑郁药物如氟西汀等通过上调p-mTOR 和p-4EBP1 调控CUMS 突触重塑相关蛋白的表达[6]。本实验中Sin 处理后,抑郁大鼠pmTOR 和p-4EBP1 均上调,mTOR 信号通路被激活,Sin 可能通过激活mTOR 信号通路调控海马突触重塑。
研究表明,炎症因子如IL-6、IL-1β 和TNF-α 参与抑郁的病理发生过程[20],抗抑郁药作用后,抑郁症患者血清中炎症因子恢复正常水平。炎症因子通过激活相关信号通路,维持正常的突触可塑性以及神经代谢,最终影响情绪调节[21]。本实验中Sin 处理后,抑郁大鼠炎性因子IL-6、IL-1β 和TNF-α 水平显著下调,炎症反应明显降低,Sin 可能通过降低炎性反应缓解抑郁症状,改善突触可塑性。
综上所述,Sin 作用后,抑郁大鼠海马区炎症反应降低,细胞凋亡信号通路被抑制,海马结构破坏较小,与突触重塑相关的Notch 和mTOR 通路被激活,突触重塑相关蛋白BDNF 表达上调,突触结构和突触可塑性明显改善,抑郁症状缓解。因此,Sin 调控CUMS 大鼠海马神经突触可塑性,可能与Notch 和mTOR通路的激活有关。
