Ⅲ型磷脂酰肌醇3-磷酸5-激酶在小鼠血管平滑肌细胞增殖和迁移中的作用机制研究*
2021-04-06冯菲菲甘雪晴孙雄山杨大春
谷 敏, 冯菲菲, 甘雪晴, 李 霜, 孙雄山△, 杨大春,△
(1西南交通大学医学院,四川成都610031;2西部战区总医院心内科,四川成都610083)
心血管疾病(cardiovascular disease,CVD)是全球范围内第一位致死、致残原因[1]。冠状动脉、颈动脉和其他外周动脉粥样硬化作为常见的血管疾病,经皮介入治疗是重要的干预手段。血管再狭窄是血管介入治疗的主要并发症,会导致严重心血管不良事件,同时也限制了支架的效用[2]。在血管再狭窄的发生发展过程中,首先是血管内皮受到机械性损伤,随后活化的血小板和炎症细胞聚集在受损区域并分泌多种细胞因子,如血小板源性生长因子(platelet-derived growth factor,PDGF)和白细胞介素6等,这些生长因子和炎症介质会促进血管平滑肌细胞(vascular smooth muscle cells,VSMC)增殖和迁移,从而导致新生内膜增生和再狭窄[3]。目前,血管再狭窄的分子调控机制主要包括磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋 白 激 酶B(protein kinase B,PKB/AKT)等[4],但针对这些机制的防治措施仍不能完全遏制再狭窄的发生。因此,揭示再狭窄的潜在机制和寻找新的治疗靶点是亟待解决的问题。
Ⅲ型磷脂酰肌醇3-磷酸5-激酶(phosphatidylinositol 3-phosphate 5-kinase type III,PIKfyve)是一种进化上相对保守的脂质激酶,可以催化其相应的底物合成磷脂酰肌醇5-磷酸(phosphatidylinositol 5-phosphate,PtdIns5P)和磷脂酰肌醇3,5-二磷酸(phosphatidylinositol 3,5-bisphosphate,PtdIns3,5P2)[5]。PIKfyve在哺乳动物心脏、血管、脑、骨骼肌和脂肪等组织表达丰富,最近多项研究显示PIKfyve 在血管钙化和心肌肥厚等心血管疾病中也发挥重要作用[6-7]。VSMC作为血管壁的主要构分,其在病理刺激下过度增殖和迁移在血管内膜增生和再狭窄中发挥重要作用[8]。有研究表明,抑制PIKfyve可以降低肝癌细胞、淋巴瘤细胞、成纤维细胞等的增殖和迁移[9-11],但是PIKfyve 在VSMC 增殖、迁移及血管内膜增生中的作用目前并不清楚。本实验使用PDGF-BB 干预VSMC诱导体外增殖和迁移,并且构建小鼠颈动脉内皮损伤模型[12],探讨PIKfyve 对VSMC 增殖和迁移及血管内膜增生的影响,以期为血管再狭窄的治疗提供参考资料。
材料和方法
1 材料
1.1 动物和细胞 8~10 周龄SPF 级C57BL/6J 雄性野生型小鼠50只,体重25 g左右,购自成都达硕生物有限公司,许可证号:SCXK(川)2020-030。日夜规律光照各12 h,自由摄入水和食物,饲养室内保持恒温22~25℃。使用酶消化分离法从8~10 周小鼠胸主动脉中分离出VSMC。
1.2 主要试剂 DMEM 高糖培养液及0.25%胰蛋白酶(HyClone);胎牛血清(Gibco);HE 染色试剂盒(Solarbio);RNA 提取试剂盒和反转录试剂盒及SYBR(TaKaRa);qPCR 引物由成都擎科伟业生物技术有限公司合成;PIKfyve 抑制剂YM201636(MCE);PIKfyve 抗体(Santa Cruz);PIKfyvesiRNA 由广州锐博生物公司合成;GAPDH、核糖体蛋白S6(ribosomal protein S6,S6)、磷酸化(phospho,p)-S6Ser235/236、4E 结 合 蛋 白1(4E-binding protein 1,4EBP1)和p-4EBP1Thr37/46抗体(Cell Signaling Technology);Ki-67抗体(Bioss);山羊抗兔Ⅱ抗和山羊抗鼠Ⅱ抗(Solarbio);PDGF-BB(PeproTech);ECL 发光液(Millipore);重组人胰岛素(Solarbio)。
2 实验方法
2.1 小鼠VSMC 的培养及分组 用酶消化分离法从8~10 周小鼠胸主动脉中分离出VSMC,用含10%胎牛血清及1%双抗的DMEM 高糖培养液培养,置于5% CO2、37℃培养箱中孵育。随后每2 d 更换培养液,待细胞生长融合至约90%时,用0.25%胰酶消化后按照1∶2 或1∶3 传代培养。选择处于对数生长期的细胞进行实验。用PDGF-BB 干预VSMC 诱导体外的增殖和迁移,用PIKfyve特异性siRNA 敲减PIKfyve的表达,用PIKfyve 抑制剂YM201636 抑制PIKfyve 活性,用胰岛素激活哺乳动物雷帕霉素靶蛋白复合物1(mammalian target of rapamycin complex 1,mTORC1)的活性。为观察敲减PIKfyve表达对VSMC 增殖和迁移的影响,将VSMC 分为DMSO+siCon 组、PDGF-BB+siCon 组、DMSO+siPIKfyve 组和PDGF-BB+siPIKfyve组,各组在成功转染对照siRNA 载体或者PIKfyvesiRNA 后加入PDGF-BB(30 μg/L)或者DMSO 干预24 h。为观察抑制PIKfyve 活性对VSMC 增殖和迁移的 影 响,将VSMC 分 为DMSO 组、PDGF-BB 组、YM201636 组和PDGF-BB+YM201636 组,按 分组加入YM201636(1 μmol/L)或DMSO 预孵育12 h,再加入PDGF-BB 或DMSO 共孵育24 h。为进一步研究PIKfyve 通过影响mTORC1 活性调控VSMC 增殖和迁移,在敲减PIKfyve表达或抑制其活性的基础上,加入胰岛素(5 mg/L)孵育24 h。
2.2 细胞PIKfyvesiRNA 转染 将细胞悬液铺于孔板中,细胞生长至大约40%时候按照试剂使用说明用Lipofectamine 2000 作为转染试剂以50 nmol/L 浓度进行PIKfyvesiRNA 或对照载体转染,每组设3 个复孔。PIKfyvesiRNA序列:5"-GUUGUCAAUGGCUUUGUUU-3"和5"-AAACAAAGCCAUUGACAAC-3"[6]。
2.3 Ki-67免疫荧光染色检测细胞增殖 在24孔板中放入爬片,加入细胞悬液,按前述分组干预完成后倒掉培养液,用PBS浸洗爬片3次,4%多聚甲醛固定30 min 以上,PBS 洗3 次,0.3%~0.5%的TritonX-100室温通透15 min,PBS 洗3 次,吸水纸吸干,山羊血清室温封闭30 min,吸水纸吸掉封闭液,每张玻片滴加足量的Ⅰ抗并放入湿盒中4℃过夜。之后PBS洗涤3次,滴加稀释好的荧光Ⅱ抗(此后在暗室操作),湿盒37℃孵育1 h,滴加DAPI复染核5 min,PBS洗掉多余的DAPI,吸水纸吸干液体后用含抗荧光淬灭剂的封片液封片,在荧光显微镜下采集图像。
2.4 划痕实验检测细胞迁移 用记号笔在6 孔板背后均匀地划横线,大约每隔0.5~1 cm一道,每孔有5 条横线穿过。于6 孔板中铺细胞,待细胞铺满后用无菌10 μL 吸头垂直于横线划一条痕。用PBS 洗细胞3 次,洗去多余悬浮细胞,拍摄0 h 照片。加入无血清培养液,按实验要求进行干预,放入孵育箱中培养,24 h后在光学显微镜下拍照。
2.5 qPCR 检测PIKfyve mRNA 表达水平 用RNA提取试剂盒,并根据说明书提取VSMC 的总RNA。标准化各组RNA 浓度,反转录为cDNA 后进行扩增,以GAPDH 为内参照,用2-ΔΔCt法计算PIKfyv 的相对表达量。PIKfyv 的上游引物序列为5"-ATGGCCACAGATGACAAGAGTTCC-3",下游引物序列为5"-CAGACTGTGTTCTTGAAGGG-3"[6];GAPDH 的 上 游引物序列为5"-AATGGATTTGGACGCATTGGT-3",下游引物序列为5"-TTTGCACTGGTACGTGTTGAT-3"。
2.6 Western blot 检测细胞PIKfyve 表达和反映mTORC1 活性的靶分子S6(Ser235/236)和4EBP1(Thr37/46)的磷酸化水平 提取血管或VSMC 蛋白,按照蛋白提取试剂盒说明书进行。测定蛋白浓度,取蛋白样品行SDS-PAGE 分离,然后转至PVDF 膜上,5%脱脂奶粉或胎牛血清中室温封闭1 h。加入相 应 的Ⅰ抗(PIKfyve、S6、p-S6Ser235/236、4EBP1、p-4EBP1Thr37/46和GAPDH 抗体,均按1∶1 000 稀释),于4℃过夜孵育。次日TBST洗膜后再用Ⅱ抗(1∶10 000)常温孵育1 h。再次TBST 洗膜后使用ECL 发光液显色,用ImageJ软件分析结果。
2.7 动物分组及小鼠颈动脉内皮损伤模型的建立 为观察PIKfyve 在血管内皮损伤后内膜增生中的作用,将20 只野生型小鼠随机分为假手术组、颈动脉内皮损伤组、YM201636(PIKfyve 活性抑制剂)组和颈动脉内皮损伤+YM201636 组,每组5 只。小鼠颈动脉内皮损伤模型的建立:按照参考文献[12],小鼠称重后用0.3%的戊巴比妥钠(30 mg/kg)腹腔注射以麻醉小鼠,固定在手术台上;颈部皮肤脱毛并用碘伏消毒,在颈部正中切开1 cm左右小口,分离小鼠左侧颈总动脉、颈内动脉和颈外动脉,用血管夹暂时夹闭颈总动脉近心端和颈内动脉,结扎颈外动脉远心端,用0.38 mm 粗糙导丝从颈外动脉近心端插入颈总动脉,来回旋转通过3 次以损伤血管内皮,迅速取出导丝,结扎颈外动脉穿刺段,松开血管夹恢复血流,缝合小鼠颈部切口。假手术组小鼠与模型组小鼠操作相同但不用导丝损伤颈动脉内皮。术后按分组腹腔注射生理盐水或YM201636(2 mg·kg-1·d-1),持续15 d。28 d 后,处死小鼠,取出颈总动脉,用4%多聚甲醛固定,以备后续使用。
2.8 HE 染色 取材,固定,石蜡包埋,切片。用二甲苯脱蜡,经各级乙醇及水洗,苏木素染色5 min,自来水冲洗。盐酸乙醇分化2~10 s,自来水冲洗2 min,伊红染色30 s~2 min,自来水冲掉多余染液,约10 s,晾干,中性树胶封片、镜检、采图。
3 统计学处理
采用SPSS 20.0 统计软件进行统计分析。计量资料以均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析;两组之间的比较采用独立样本t检验。以P<0.05为差异具有统计学意义。
结果
1 PDGF-BB 增加小鼠VSMC 中PIKfyve 的表达水平
qPCR 和Western blot 结 果 显 示,与DMSO 组 相比,PDGF-BB 组VSMC 中PIKfyve 的mRNA 表达增加(P<0.01),蛋白水平亦显著升高(P<0.01),见图1。
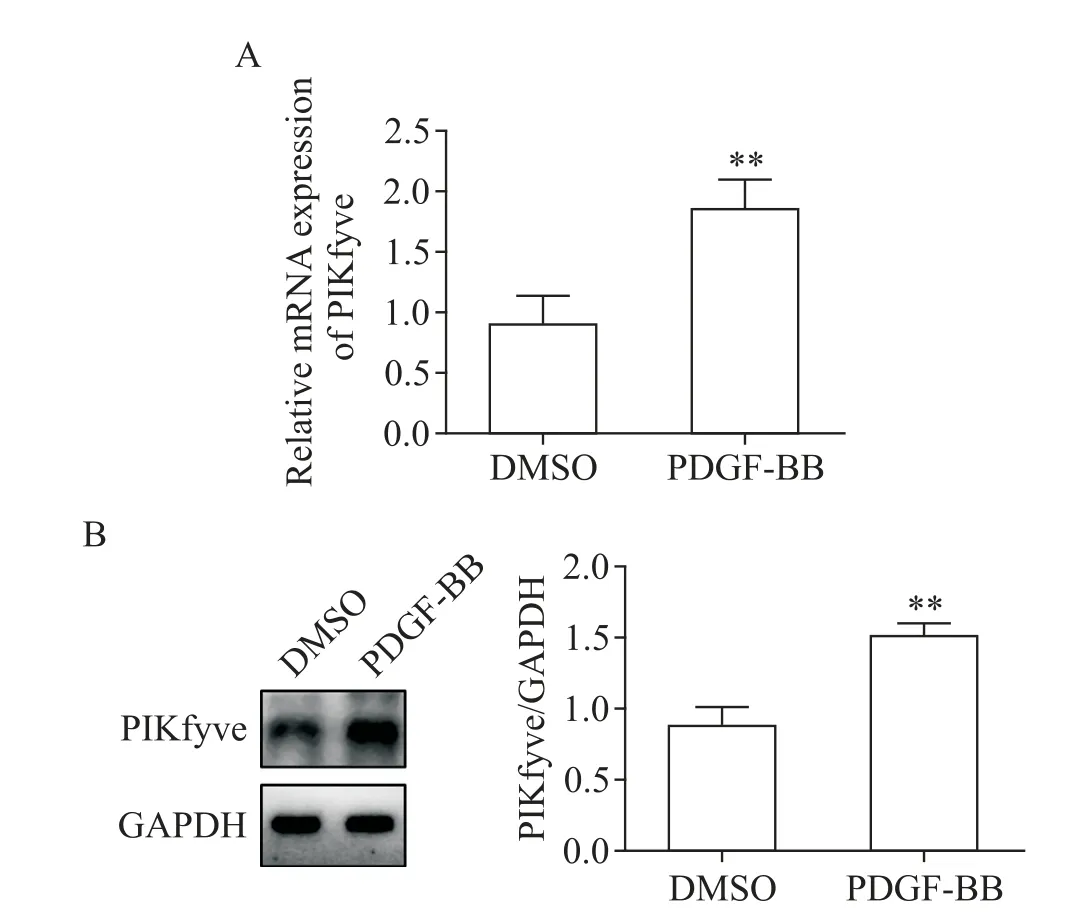
Figure 1. The mRNA and protein levels of PIKfyve were increased in mouse VSMC treated by PDGF-BB. A:the mRNA expression of PIKfyve was detected by qPCR;B:the protein expression of PIKfyve was determined by Western blot. Mean±SD. n=3. **P<0.01 vs DMSO group.图1 PDGF-BB 增加 了小 鼠VSMC 中PIKfyve 的mRNA 和蛋白表达水平
2 敲减PIKfyve 抑制PDGF-BB 诱导的小鼠VSMC的增殖和迁移
Ki-67 免疫荧光染色结果显示,PDGF-BB 处理后VSMC中Ki-67阳性细胞率增加(P<0.01);与DMSO+siCon 组相比,无论是否经过PDGF-BB 处理,敲减PIKfyve表达均显著降低Ki-67 阳性细胞率(P<0.01);在敲减PIKfyve的前提下,DMSO 和PDGF-BB处理VSMC 的Ki-67 阳性细胞率无显著差异,见图2A。划痕实验结果显示,与DMSO+siCon 组相比,PDGF-BB 使VSMC 划痕愈合速度增快(P<0.01),敲减PIKfyve使划痕愈合速度减慢(P<0.01);与PDGFBB+siCon 组相比,PDGF-BB+siPIKfyve 组划痕愈合速度也显著减慢(P<0.01);在敲减PIKfyve 的前提下,DMSO 和PDGF-BB 处理VSMC 的划痕愈合速度无显著差异,见图2B。
3 PIKfyve 失活抑制PDGF-BB 诱导的小鼠VSMC增殖和迁移
Ki-67 免疫荧光染色结果显示,与DMSO 组相比,PDGF-BB 增 加Ki-67 阳 性 细 胞率(P<0.01),YM201636 组Ki-67 阳性细胞率显著降低(P<0.01);与PDGF-BB 组相比,PDGF-BB+YM201636 组的Ki-67 阳性细胞率也显著降低(P<0.01);YM201636 组与PDGF-BB+YM201636 组的Ki-67 阳性细胞率无显著差异,见图3A。划痕实验结果显示,与DMSO 组相比,PDGF-BB 组划痕愈合速度增快(P<0.01),YM201636 组 划 痕 愈 合 速 度 减 慢(P<0.01);与PDGF-BB 组相比,PDGF-BB+YM201636 组划痕愈合速度也显著减慢(P<0.01);YM201636 组和PDGFBB+YM201636 组划痕愈合速度无显著差异,见图3B。
4 敲减PIKfyve 的表达通过降低mTORC1 活性抑制小鼠VSMC增殖和迁移
S6(Ser235/236)和4EBP1(Thr37/46)的磷酸化是反映mTORC1 活性的下游靶分子。与DMSO+si-Con 组相比,PDGF-BB 处理使VSMC 的p-S6Ser235/236和p-4EBP1Thr37/46蛋白水平显著增加(P<0.05),而敲减PIKfyve使p-S6Ser235/236和p-4EBP1Thr37/46蛋白水平显著降低(P<0.05);与DMSO+siPIKfyve 组相比,在敲减PIKfyve的基础上再进行PDGF-BB 干预,也不能增加p-S6Ser235/236和p-4EBP1Thr37/46蛋 白 水 平,见 图4。与PDGF-BB+siPIKfyve 组相比,胰岛素的加入增加了p-S6Ser235/236和p-4EBP1Thr37/46蛋白水平,表明胰岛素恢复了mTORC1 活性,见图5A;而在利用胰岛素恢复mTORC1 活 性 后,敲 减PIKfyve对PDGF-BB 处 理 后Ki-67 阳性细胞率上升和划痕愈合速率增快的抑制作用消失,见图5B、C。
5 PIKfyve 失活通过降低mTORC1 活性抑制小鼠VSMC增殖和迁移
Western blot 结果显示,与DMSO 组相比,PDGF-BB 组VSMC 的p-S6Ser235/236和p-4EBP1Thr37/46蛋白水平增加(P<0.05),YM201636 组p-S6Ser235/236和p-4EBP1Thr37/46蛋白水平降低(P<0.05);与PDGF-BB 组相 比,PDGF-BB+YM201636 组 p-S6Ser235/236和 p-4EBP1Thr37/46蛋 白 水 平 也 显 著 降 低(P<0.01);YM201636 组与PDGF-BB+YM201636 组无显著差异,见图6A。而在利用胰岛素恢复mTORC1 活性后,PIKfyve 失活对PDGF-BB 处理后Ki-67 阳性细胞率上升和划痕愈合速率增快的抑制作用消失,见图6B、C。
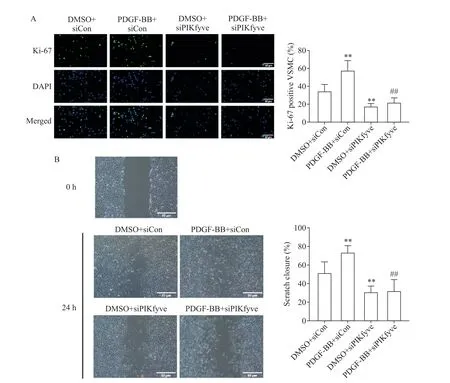
Figure 2. PIKfyve knockdown suppressed PDGF-BB-induced proliferation and migration of mouse VSMC. A:the proliferation of the cells was detected by Ki-67 staining;B:the migration of the cells was detected by scratch test. Scale bar=50 μm. Mean±SD. n=5. **P<0.01 vs DMSO+siCon group;##P<0.01 vs PDGF-BB+siCon group.图2 敲减PIKfyve表达抑制PDGF-BB诱导的小鼠VSMC增殖和迁移
6 抑制PIKfyve 活性能减轻小鼠血管内皮损伤后内膜增生
Western blot 检测小鼠颈动脉PIKfyve 表达水平,与假手术组相比,颈动脉内皮损伤组PIKfyve 的表达显著增加(P<0.01),见图7A。HE 染色结果显示,与假手术组相比,颈动脉内皮损伤组内膜增生明显,内膜/中膜面积比值增高(P<0.01);与假手术组相比,假手术+YM201636 组管腔狭窄程度和内膜/中膜面积比值无显著差异;与颈动脉内皮损伤组相比,颈动脉内皮损伤+YM201636 组颈动脉管腔狭窄程度减轻,内膜/中膜面积比值显著降低(P<0.01),见图7B。
讨论
血管经皮介入治疗是一种广泛应用于动脉粥样硬化相关疾病如冠心病的治疗策略,然而,血管再狭窄已成为限制其临床疗效的严重并发症。血管再狭窄的起始步骤是支架等机械性损伤血管内皮[8],随后,活化的血小板和炎症细胞聚集在受损区域并分泌多种细胞因子,如PDGF、白细胞介素6、白细胞介素1β 等[13]。这些生长因子和炎症介质会促进VSMC从收缩型转变为增殖型,其特征是增殖、迁移增加,从而导致新生内膜增生和再狭窄[3,14]。VSMC 的增殖和迁移是防治血管再狭窄的一个关键环节。本研究使用PDGF-BB 模拟小鼠血管受损后释放的PDGF的作用,以诱导体外的增殖和迁移,探讨PIKfyve 对VSMC增殖和迁移的作用及其机制。
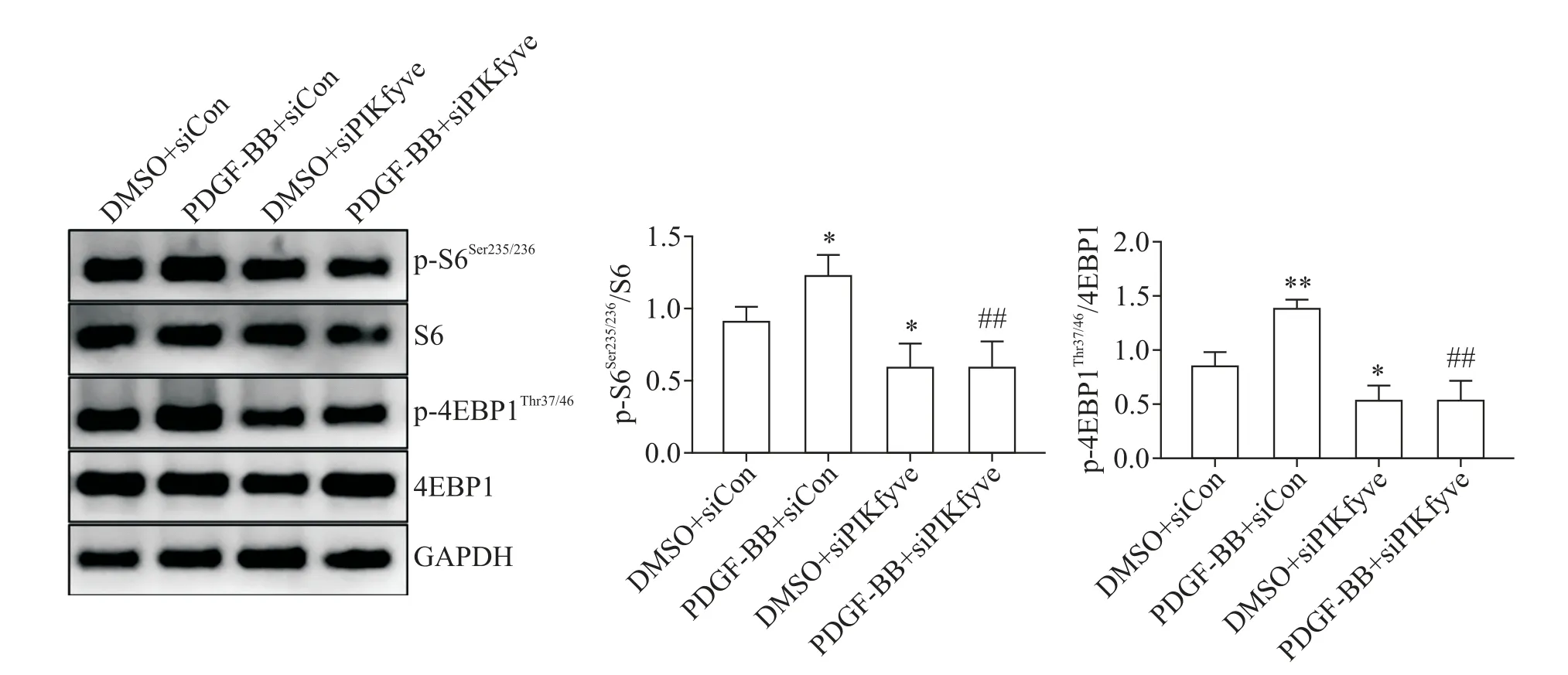
Figure 4. PIKfyve knockdown reduced the activity of mTORC1 in mouse VSMC. The protein levels of p-S6,S6,p-4EBP1 and 4EBP1 were determined by Western blot. Mean±SD. n=3. *P<0.05,**P<0.01 vs DMSO+siCon group;##P<0.01 vs PDGF-BB+si-Con group.图4 敲减PIKfyve表达降低了小鼠VSMC中mTORC1活性
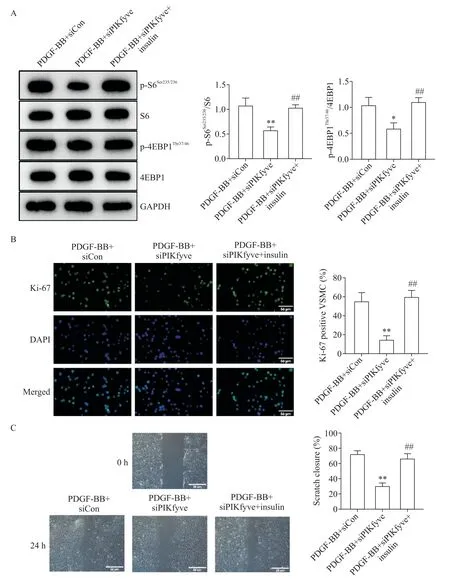
Figure 5. Activation of mTORC1 by insulin reversed the inhibitory effect of PIKfyve knockdown on proliferation and migration of mouse VSMC exposed to PDGF-BB. A:insulin restored the activity of mTORC1(n=3);B:activation of mTORC1 by insulin reversed the inhibitory effect of PIKfyve knockdown on proliferation of VSMC(n=5);C:insulin reversed the inhibitory effect of PIKfyve knockdown on migration of VSMC(n=5). Scale bar=50 μm. Mean±SD. *P<0.05,**P<0.01 vs PDGFBB+siCon group;##P<0.01 vs PDGF-BB+siPIKfyve group.图5 胰岛素激活mTORC1逆转了敲减PIKfyve对PDGF-BB诱导的小鼠VSMC增殖和迁移的抑制作用
PIKfyve 是一种相对保守的脂质激酶,其主要生理功能为糖代谢调控、抑制肥胖、内体运输和调节自噬等[15-17]。既往研究显示PIKfyve 在心脏、脂肪、血管和骨骼肌等组织中丰富表达[17]。Tronchere 等[6]的研究结果表明,PIKfyve 的抑制通过sirtuin-3 依赖性途径减轻心肌细胞线粒体活性氧产生并减少细胞凋亡,在高脂致肥胖小鼠模型中,PIKfyve 的抑制减轻心肌肥大并改善心脏功能。Cao 等[7]使用萤光素酶实验鉴定PIKfyve为微小RNA(microRNA,miR)-32-5p的靶基因,并认为PIKfyve 通过抑制BV2细胞中肿瘤坏死因子α 的产生进而减轻血管的钙化。上述研究表明PIKfyve 在心脏和血管中发挥重要作用,但PIKfyve 在机械性损伤后血管内膜增生中的作用及机制尚未明确。研究表明,抑制PIKfyve 可以降低多种细胞如肝癌细胞、淋巴瘤细胞、成纤维细胞等的增殖和迁移[9-11],但其在VSMC 增殖和迁移中是否发挥调控作用并不清楚。本研究显示PIKfyve 在PDGFBB 处理后的VSMC 中表达增加,而降低PIKfyve 活性或敲减PIKfyve表达,均可以抑制PDGF-BB 诱导的VSMC 增殖和迁移。这说明PIKfyve 表达上调可以促进VSMC 的增殖和迁移过程,但是其调控VSMC 增殖和迁移的机制目前暂不清楚。
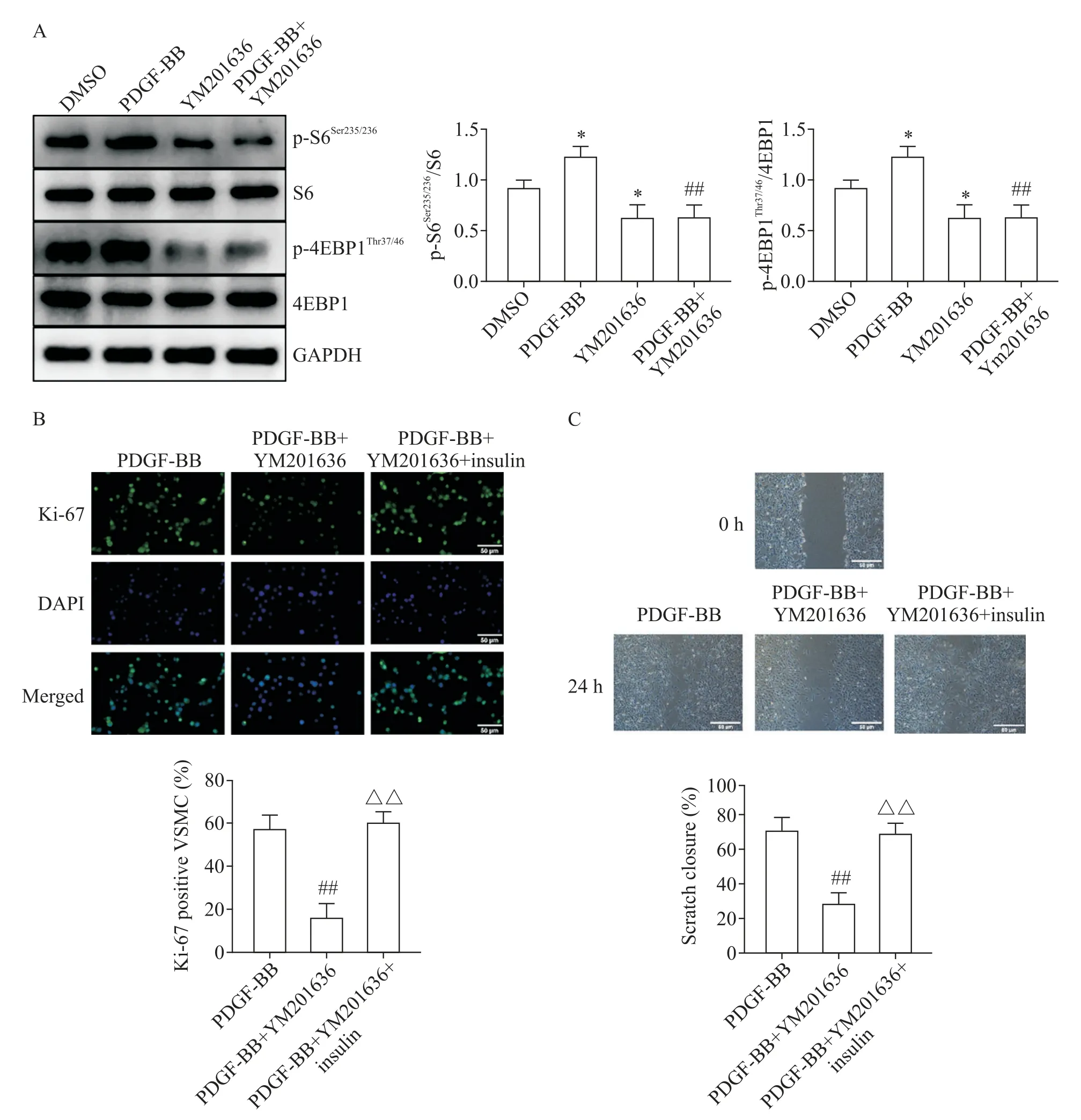
Figure 6. PIKfyve inactivation inhibited the proliferation and migration of mouse VSMC via reducing mTORC1 activity. A:PIKfyve inactivation reduced the activity of mTORC1 in VSMC(n=3);B:activation of mTORC1 by insulin reversed the effect of PIKfyve inactivation on proliferation of VSMC(n=5);C:insulin reversed the effect of PIKfyve inactivation on migration of VSMC(n=5). Scale bar=50 μm. Mean±SD. *P<0.05 vs DMSO group;##P<0.01 vs PDGF-BB group;△△P<0.01 vs PDGFBB+YM201636 group.图6 PIKfyve失活通过降低mTORC1活性抑制小鼠VSMC增殖和迁移
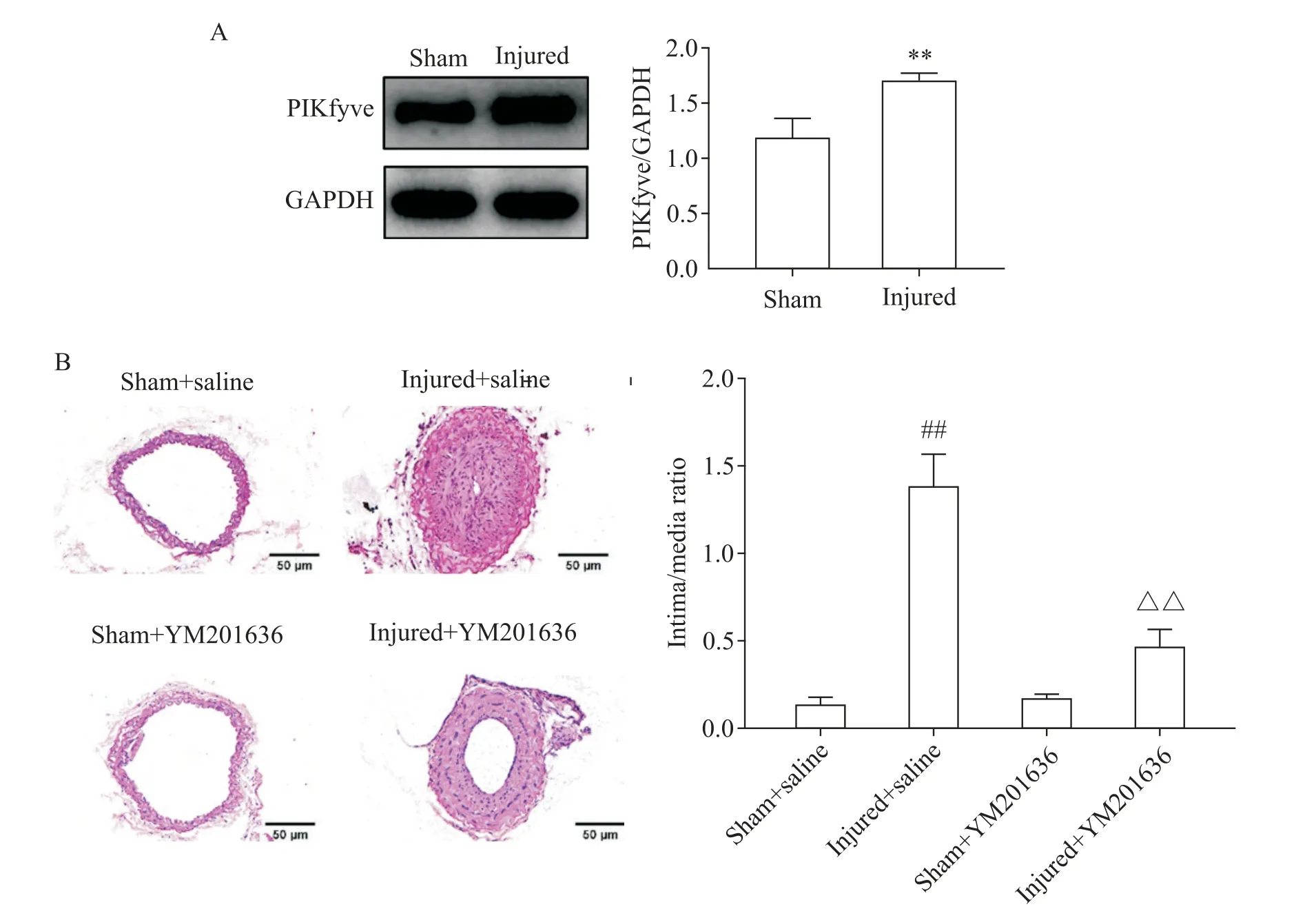
Figure 7. Inhibition of PIKfyve activity decreased neointimal hyperplasia after mouse vascular endothelial injury. A:the protein expression of PIKfyve was determined by Western blot(n=3);B:the vascular intima/media ratio was measured by HE staining(n=5). Scale bar=50 μm. Mean±SD. **P<0.01 vs sham group;##P<0.01 vs sham+saline group;△△P<0.01 vs injured+saline group.图7 抑制PIKfyve活性能减轻小鼠血管内皮损伤后内膜增生
mTORC1 是一种蛋白激酶复合物,在控制细胞生长、增殖、迁移、新陈代谢等生物学过程中发挥关键作用[18]。结节性硬化复合物(tuberous sclerosis complex,TSC)1/2 异二聚体是mTORC1 上游的关键负性调控因子,它作为GTP 酶的激活蛋白,可使下游的脑Ras 同源蛋白(Ras homolog enriched in brain,Rheb)处于与GTP 解离的失活状态,从而抑制mTORC1[19]。Sun等[12]的研究表明,PDGF-BB促进了mTORC1 的活化,利用VSMC 特异性的TSC1基因敲除激活mTORC1 后,促进了VSMC 异常增殖、迁移及血管内皮机械性损伤后的内膜增生。但PIKfyve 是否通过影响mTORC1参与VSMC增殖、迁移调控并不清楚。因此,我们进一步在VSMC 中研究了PIKfyve对mTORC1 活性的影响。S6(Ser235/236)和4EBP1(Thr37/46)的磷酸化是反映mTORC1 活性的两个下游核心指标[18]。我们的体外实验表明,敲减PIKfyve表达或者抑制PIKfyve 活性均能降低S6 和4EBP1 的磷酸化水平。既往研究也支持PIKfyve 正向调控mTORC1 活性,在3T3-L1 脂肪细胞中,敲减PIKfyve表达降低了p-S6 和p-4EBP1 水平[20]。既往研究表明,胰岛素通过PI3K/Akt 通路激活mTORC1 的活性[19]。在本研究中胰岛素的干预逆转了敲减PIKfyve表达后降低的S6 和4EBP1 的磷酸化水平,表明胰岛素激活了mTORC1 活性,而利用胰岛素恢复mTORC1 活性后,敲减PIKfyve表达或者抑制PIKfyve活性对VSMC 增殖和迁移的抑制作用消失。据此推论,PIKfyve 可能通过诱导mTORC1 活化来促进VSMC的增殖和迁移。
为了进一步研究PIKfyve 在血管内膜增生中发挥的作用,本研究采用机械性损伤血管内皮法构建了小鼠颈总动脉内皮损伤模型。结果显示,PIKfyve在颈总动脉内皮损伤后表达增加,提示PIKfyve 可能在内膜增生中发挥促进作用。PIKfyve 活性抑制剂的使用可以减轻血管损伤后的内膜增生和管腔狭窄程度,说明PIKfyve 诱导小鼠血管损伤后内膜增生。但是PIKfyve 在血管再狭窄中的作用机制仍有较多未知。本项工作主要集中于体外实验研究,在体内的机制研究仍需进一步探讨。
综上所述,PIKfyve 可通过诱导mTORC1 活化来促进小鼠VSMC 的增殖和迁移,表明抑制PIKfyve 表达或活性可能是防治血管再狭窄的新靶点。本研究为血管再狭窄的防治提供了参考资料。
