大鼠肾间质纤维化早期的差异蛋白质筛选与annexin A5表达的动态分析*
2021-04-06李肖肖陆大祥王华东戚仁斌张珂珂王达安
李肖肖, 陆大祥, 王华东, 戚仁斌, 张珂珂, 王达安△
(1暨南大学基础医学院病理生理学系,国家中医药管理局病理生理重点实验室,广东广州510632;2佛山市第二人民医院护理部,广东佛山528200)
肾间质纤维化(renal interstitial fibrosis,RIF)是多种慢性肾脏疾病(chronic kidney disease,CKD)发展到终末期肾病(end-stage renal disease,ESRD)的共同病理基础,有效干预RIF 的发生发展是控制CKD 进展、延缓肾功能衰竭发生的关键[1]。疾病蛋白质组学(disease proteomics)通过全面、系统地观察疾病状态下蛋白质组(proteome)的变化规律来阐明疾病发生机制,并发现疾病标志物和干预新靶点。本研究采用双向凝胶电泳(two-dimensional gel electrophoresis,2-DE)和质谱(mass spectrometry,MS)技术,分析大鼠单侧输尿管梗阻(unilateral ureteral obstruction,UUO)所致RIF 模型的蛋白质组表达模式的变化情况,以期发掘出有助于探讨RIF 发病规律的有价值信息。
材料和方法
1 材料与仪器
甘氨酸、十二烷基硫酸钠、丙烯酰胺、N,N,N",N"-四甲基乙二胺、碘乙酰胺、Bradford 法和BCA 法蛋白质定量测定试剂盒及15~150 kD Protein Ladder(Bio-Rad);二硫苏糖醇和过硫酸铵(Amresco);IPG非线性(pH 4~7,24 cm)干胶条(GE);考马斯亮蓝R350(上海生物工程股份有限公司);ECL 发光液(Millipore);β-tubulin 单抗和膜联蛋白A5(annexin A5)单抗(Abcom);HRP 标记的抗兔和抗鼠IgG 抗体(上海碧云天生物科技公司)。
5427 R 高速低温离心机(Eppendorf);MBX51 倒置荧光显微镜(Olympus);RM2235 切片机(Leica);JB-L7 组织包埋机(武汉俊杰电子有限公司);KZ-Ⅱ电动组织匀浆器(武汉塞维尔科技有限公司);手术器械(上海医疗器械有限公司);Ettan IP Gphor 3 等电聚焦系统、SE 600 垂直电泳系统和ImageJ 2-DE 分析软件(GE Healthcare);GS800凝胶扫描仪(Bio-Rad);4800串联飞行时间质谱仪(Applied Biosystems)。
2 方法
2.1 UUO大鼠RIF模型构建及肾脏组织病理分析
2.1.1 实验动物与分组 雄性Wistar大鼠48只,体质量180~220 g,购于北京华阜康实验动物有限公司[许可证号为SCXK(鲁)2014-00070],饲养于暨南大学动物实验管理中心SPF 动物饲养房:室温(23±2)℃,相对湿度40%~70%,标准颗粒饲料喂养,自由进食饮水。48 只大鼠随机分为3 组:正常对照组(control 组)6 只、假手术组(sham 组)6 只和UUO 模型组(UUO组)36只。
2.1.2 UUO大鼠模型制备与肾脏组织标本取材[2]UUO 组大鼠以2%戊巴比妥钠(20 mg/kg 体重)腹腔注射麻醉后,仰卧固定于手术台上,手术区用脱毛膏脱毛,75%乙醇消毒皮肤,腹腔中线中下段作一长2~3 cm 的纵向皮肤切口,并逐层分离腹壁,轻轻分离右侧输尿管,用3 号手术丝线于输尿管上下段两处各作1 道结扎,逐层缝合腹壁切口,无菌敷料包裹伤口,待动物清醒后放回饲养笼。control 组不作任何手术处理;sham 组开腹后仅进行右侧输尿管钝性分离,不予结扎,其他步骤同UUO 组。所有大鼠术后均肌肉注射兽用头孢曲松Ⅲ(0.1 mg/kg),每12 h 注射1 次,连续使用3 d,以预防术后感染。UUO 大鼠在术后第3 天、第7 天、第11 天、第14 天、第21 天和第28天分别随机选取6只,处死后取右肾上极组织,浸泡在4%多聚甲醛中固定,作HE 染色及Masson 染色进行病理组织学分析;取右肾下极组织,在适量RIPA 裂解液中匀浆,12 000 r/min 离心20 min,取上清液,采用BCA 法进行蛋白定量,加入5×蛋白上样缓冲液混匀,煮沸10 min,离心5 s后-20℃保存,以备Western blot 分析。control 组和sham 组分别于饲养或手术后第28天按相同方法取肾脏标本。
2.1.3 肾脏组织切片制备及观察 肾组织标本经4%多聚甲醛固定过夜,梯度乙醇脱水、二甲苯透明处理后行石蜡包埋,制成4 μm 切片,分别进行HE 染色和Masson 染色。HE 染色:苏木素水溶液染色5 min,自来水冲洗1 min,1%盐酸乙醇分化2 s,自来水冲洗1 min,伊红水溶液染色5 min,自来水冲洗1 min,用浓度由低到高的乙醇脱水处理,二甲苯处理使组织透明,中性树胶封片;置于倒置显微镜下观察、采集图像。Masson 染色:苏木素染色5 min,丽春红酸性染液染色10 min,苯胺蓝染液染色6 min;中性树胶封片;置于倒置显微镜下观察、采集图像。
2.2 差异蛋白质组学分析方法
2.2.1 实验标本采集、蛋白质提取和定量 按2.1.1方法制备UUO模型,共3只大鼠,术后7 d处死动物取双肾组织标本,以左侧健肾(non-obstructive kidney)与右侧梗阻肾(obstructed kidney)作对照行2-DE 分析。肾脏组织加入适量全细胞裂解液,用匀浆器匀浆,冰浴超声裂解,4℃、14 000×g离心40 min,取上清;采用Bradford法进行蛋白质定量,-80℃低温保存。
2.2.2 2-DE分析方法 一向等点聚焦电泳:干胶条水化:将样品溶液加入水化盘,然后放入干胶条浸泡12 h;胶条上槽:等电聚焦盘内加6 mL 覆盖油,将泡好的胶条放入盘内;上样:上样成分包括样品蛋白、1%二硫苏糖醇、1% IPG Buffer、溴酚蓝,总体积460 μL,蛋白上样量为1 200 μg;依次等电聚焦:500 V×1 h、1 000 V×1 h、10 000 V×3 h、10 000 V×4 h,总电压约60 kV。二向SDS-PAGE:按说明书安装制胶架和电泳槽,按12.5%SDS-PAGE 凝胶配方进行配胶,加入过硫酸铵、N,N,N",N"-四甲基乙二胺和正丁醇,灌胶,凝固过夜。胶条平衡:平衡管先后加入含二硫苏糖醇平衡液及含碘乙酰胺平衡液,各平衡15 min。取出平衡后胶条,放入灌制好凝胶的玻璃板内,紧贴胶面,加上槽液到上下槽液面相平,以2 W/gel×1 h、17 W/gel×4.5 h 电泳(溴酚蓝跑到底)。考马斯亮蓝染色:取出电泳后凝胶,放入250 mL 固定液中固定10 min,然后将凝胶放入盛有考马斯亮蓝的染色盘中,摇床上室温染色3 h。上述实验重复3 次。凝胶图像的扫描和分析:用凝胶扫描仪对染色后的凝胶进行扫描,获得凝胶电泳图像,通过ImageJ 2-DE 软件进行蛋白质差异表达分析,选取在不同样本中表达差异均超过1.5倍的蛋白点作为差异表达蛋白质。
2.2.3 差异蛋白质的MS 鉴定 选取19 个差异倍数显著、斑点清晰的差异蛋白质点,切胶后使用胰蛋白酶进行胶内酶解,酶解产物采用基质辅助激光解吸附电离-飞行时间质谱法(matrix-assisted laser desorption/ionization time-of-flight mass spectrometry,MALDI-TOF-MS)进行分析。MS 获得的肽质量指纹谱通过Mascot 软件在NCBI 蛋白质数据库中进行检索,选择种属为大鼠。
2.3 Western blot 分析 取2.1.2 方法制备的蛋白质提取液进行SDS-PAGE:5%浓缩胶电泳60 V×25 min,12%分离胶电泳120 V×1 h,至溴酚蓝到达胶的底端附近终止。电泳后凝胶以350 mA×1 h 转至PVDF 膜;PVDF 膜用5%牛血清白蛋白封闭,于常温下摇床振荡孵育2 h,TBST 洗膜3 次,每次5 min;加入抗annexin A5 抗体(1∶500)或内参照β-tubulin 抗体(1∶1 000)常温下摇床振荡孵育2 h,TBST 洗膜3次,每次5 min;加入HRP标记的II抗(1∶5 000),常温振荡孵育1 h,TBST 洗膜3 次,每次5 min;加入配制好的ECL 化学发光液,放入暗匣中曝光,再进行显影、定影;利用ImageJ 软件对显影蛋白条带进行灰度分析。
3 统计学处理
数据以均数±标准差(mean±SD)表示。采用SPSS 22.0 进行统计分析。多组间比较采用单因素方差分析(one-way ANOVA),两两比较采用Bonferroni法。以P<0.05为差异有统计学意义。
结果
1 各组大鼠肾组织切片HE染色观察结果
光镜下观察可见,与control 组相比,sham 组肾组织无明显变化,肾小球形态正常、无萎缩,肾小管排列整齐、无扩张,肾小管上皮细胞形态规整,肾间质未见炎症细胞浸润和纤维增生;在各UUO 组梗阻侧肾脏可见不同程度的组织病变,其中,术后第3 天仅出现肾小管扩张,肾小球无明显改变,无明显间质增生;术后第7 天除肾小管扩张外,肾间质有少量炎症细胞浸润及极轻微增生,未见明显肾小球变化;术后第11 天肾小管进一步扩张,间质炎症细胞浸润加重,肾间质出现轻度增生,肾小球结构尚完整;术后第14、21 和28 天,肾小球逐渐变形、萎缩,肾小管上皮细胞萎缩或消失,术后第14天RIF明显,术后第21和28天出现广泛大面积的RIF,见图1。
2 各组大鼠肾组织切片Masson染色观察结果
光镜下观察可见,与control 组相比,sham 组肾组织无明显变化,肾小管排列整齐、无扩张,肾小管上皮细胞形态规整,肾间质未见增生、无明显蓝染,肾小球形态正常;在各UUO组梗阻侧肾脏所见与HE染色结果一致,逐渐出现肾小管扩张,肾小管上皮细胞萎缩,肾小球变形、萎缩,肾间质炎症细胞浸润、纤维组织增生,代表肾间质纤维增生的蓝染逐渐加重;其中,术后第3 天肾间质无明显蓝染,术后第7 天出现轻微肾间质蓝染,表明肾间质有少量胶原纤维沉积,术后第11 天肾间质增生蓝染进一步加重,术后第14 天开始肾间质增生蓝染明显,术后第21 和28天出现大面积肾间质增生蓝染,表明肾间质胶原纤维广泛沉积,见图2。
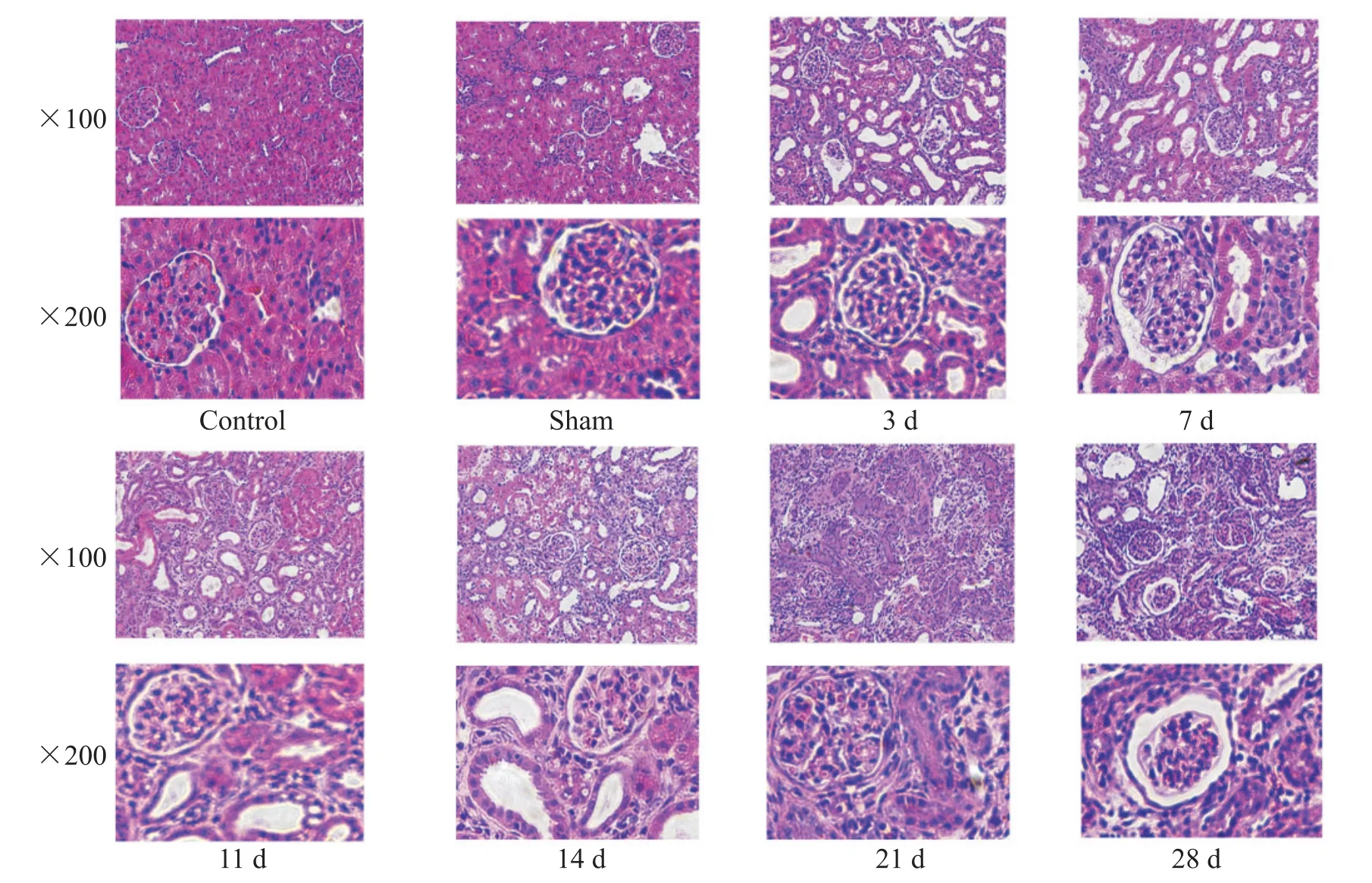
Figure 1. Pathological sections of kidney tissue with HE staining in different groups.图1 各组大鼠肾脏组织切片HE染色光镜下观察结果
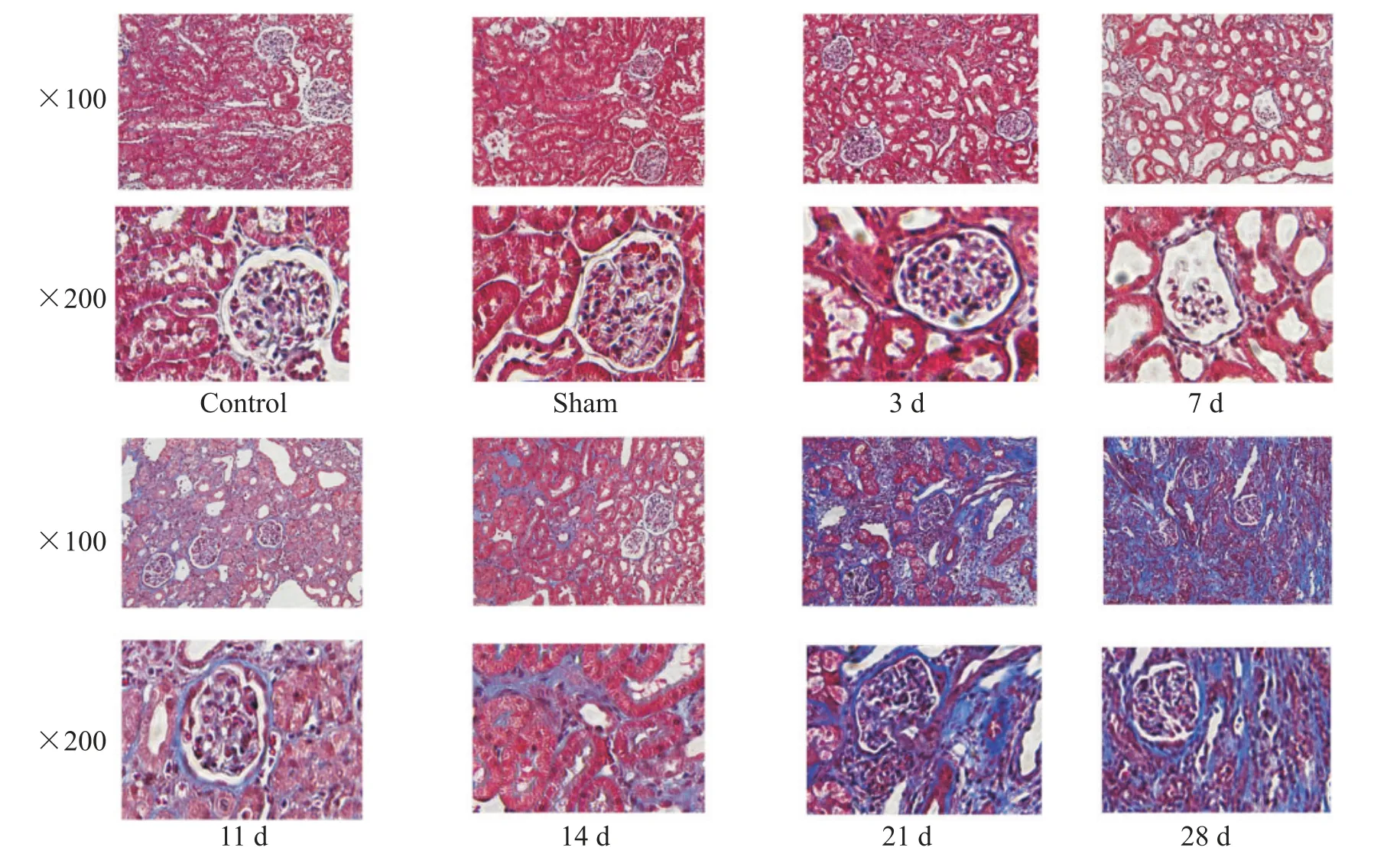
Figure 2. Pathological sections of kidney tissue with Masson staining in different groups.图2 各组大鼠肾脏组织切片Masson染色光镜下观察结果
3 UUO大鼠RIF早期的2-DE分析结果
将UUO 造模后第7 天的健侧肾(non-obstructive kidney)与梗阻肾(obstructed kidney)的组织蛋白质提取液行2-DE 及考马斯亮蓝染色(图3),经ImageJ 2-DE 图像分析软件分析,共获得重复出现、表达量差异≥±1.5 倍的差异蛋白质点166 个。其中,与健侧肾相比,梗阻肾出现上调蛋白质81 个,下调蛋白质85个。图4 为从2-DE 图像上选取的用于MS 鉴定的19个差异蛋白质点的截图(每组截图的左侧为健侧肾,右侧为梗阻肾)。
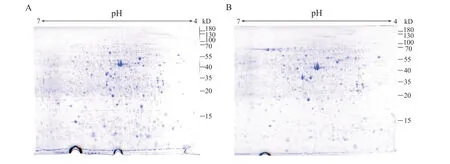
Figure 3. The two-dimensional gel electrophoresis profiles of the proteins from non-obstructive kidney(A)and obstructed kidney(B)tissues in UUO rats.图3 UUO大鼠健侧肾与梗阻肾组织蛋白质的双向凝胶电泳结果
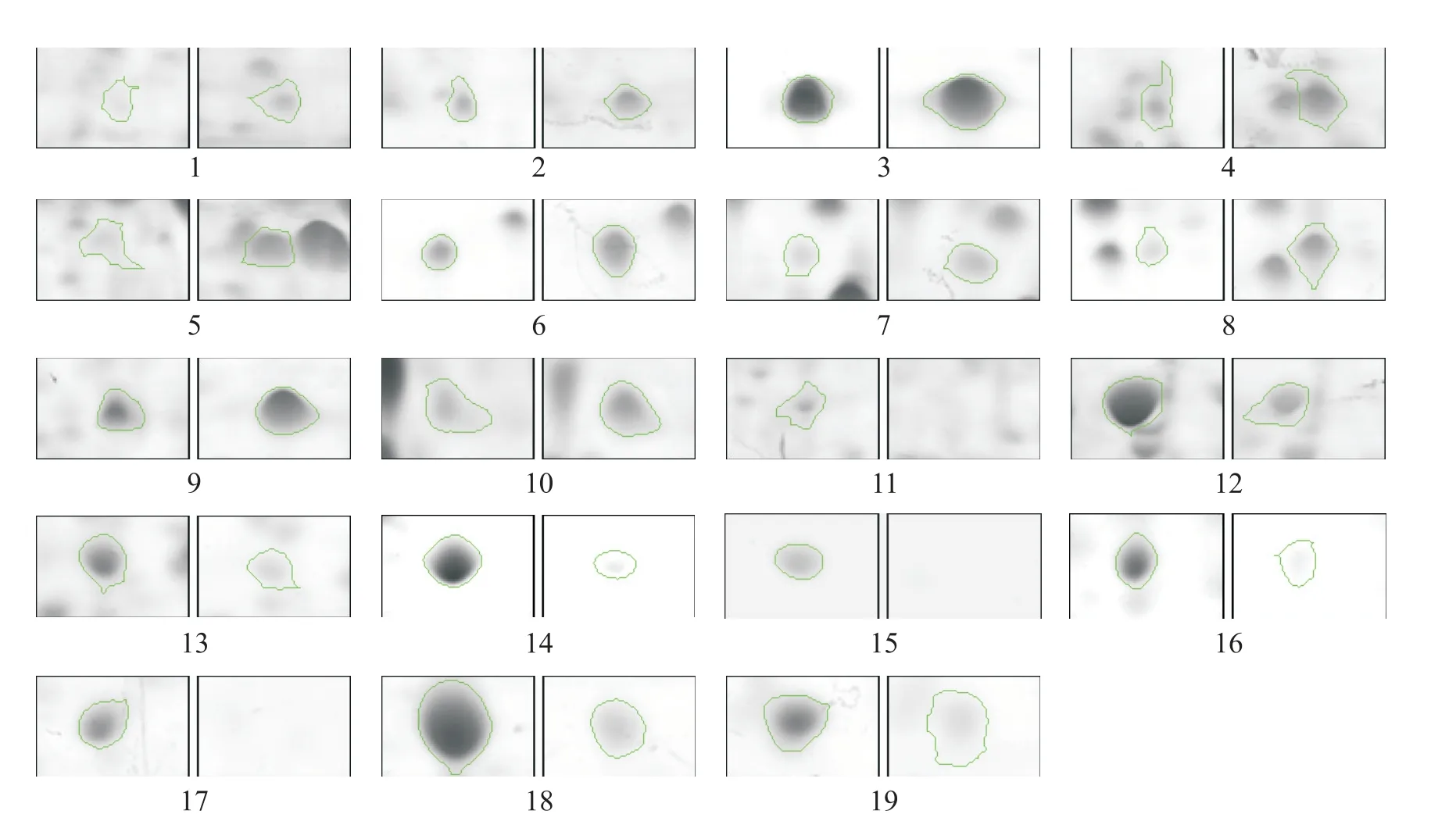
Figure 4. The screenshots of 19 differential proteins chosen for identification by MS. The left image of each pair showed the protein from non-obstructive kidney,while the right one showed the protein from obstructed kidney.图4 19个作质谱鉴定的差异蛋白质截图
4 差异蛋白质的MS分析结果
19 个差异蛋白质点的MALDE-TOP-MS 结果经Mascot 软件查询蛋白质数据库,获得蛋白质的基本信息,见表1;经UniProt 数据库及相关研究文献检索到相应蛋白质的功能注释,见表2。
5 Western blot分析的结果
Western bolt 分析结果显示,sham 组annexin A5蛋白有少量表达,UUO 各组annexin A5 蛋白表达量均显著高于sham 组(P<0.05),以UUO 术后第3 天表达量最高,之后随着梗阻时间的延长而逐渐下降,但仍显著高于sham组,见图5。
讨论
RIF 通常呈慢性、进行性发展,当发展到一定阶段将难以逆转,因此,早期的干预对延缓其进展极为重要。蛋白质作为生命活动的主要参与者,是构成动态生命过程的基础,许多疾病的发生与蛋白质异常有着密切的关系;众多细胞受体、细胞内信号转导分子、酶等蛋白质已成为开发药物的重要靶点;差异蛋白质组学具有传统蛋白质研究方法无法比拟的高通量分析能力,已成为发现疾病相关蛋白质的强有力筛选工具。利用差异蛋白质组学方法分析RIF 早期的蛋白质组表达模式变化,将有助于发掘出阐明其发病机制的有用信息,进而为开发出新的干预策略提供重要的思路。
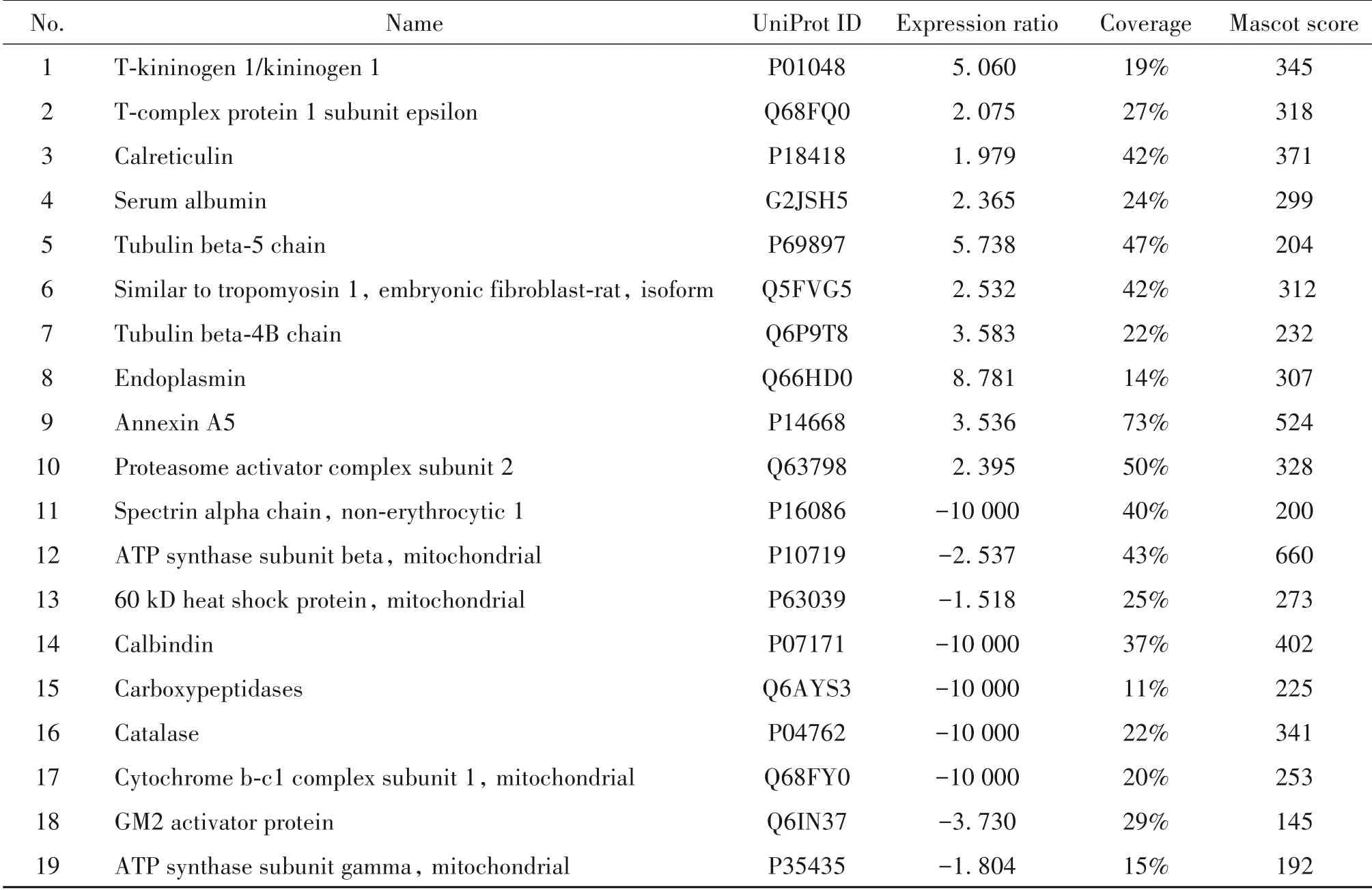
表1 差异蛋白质的质谱鉴定结果Table 1. Results of mass spectrometry analysis for differential proteins
本研究的UUO 模型病理分析显示,输尿管梗阻后7 d的梗阻肾开始出现轻微间质纤维化,此时是组织取材和分析RIF 早期蛋白质组变化情况的合适时间点。考虑到动物蛋白质组表达存在着个体差异,为降低这种因素对差异蛋白质分析可能造成的影响,我们在2-DE 分析中采用实验动物的梗阻侧肾与健侧肾的自身对照;共找到表达量差异≥1.5 倍的蛋白质差异点166 个,其中,梗阻肾表达为上调的有81个,下调有85个。我们选取了其中19个较有代表性的蛋白质差异点进行MS 分析,鉴定出19 种蛋白质,它们的功能涉及血管功能调节、细胞信号转导、氧化应激、抗氧化反应、内质网功能调节、能量代谢和细胞凋亡等多个方面。
随后,我们采用Western bolt 对其中一种差异蛋白annexin A5 在UUO 模型的表达进行了验证,观察了该蛋白在RIF 发展过程中的动态变化情况。这是一种含319 个氨基酸、由单条多肽链构成的蛋白质,属于钙依赖性磷脂结合蛋白家族成员,具有与磷脂酰丝氨酸(phosphatidylserine,PS)特异性结合的特性,以钙离子依赖的方式与磷脂膜相结合;其基因ANXA5定位于4号染色体长臂2区6~8带处,含13个外显子和12 个内含子;是哺乳动物细胞中含量最丰富、分布最广泛的一种膜联蛋白[3-4]。文献资料显示,annexin A5 参与许多生理和病理过程,包括参与凝血、炎症反应、细胞迁移和增殖、细胞凋亡和膜运输等活动的调节过程。该蛋白于1985 年被发现具有抗凝血作用而被命名为抗凝蛋白;它具有抗凝血功能是因为能与PS 结合而掩盖血小板膜上的磷脂结合位点,阻碍凝血因子与膜磷脂结合而激活的凝血启动过程[5]。此外,annexin A5还能下调组织因子(tissue factor,TF)的表达[6]。既往研究资料表明,annexin A5参与细胞凋亡的调节过程;在细胞凋亡早期,PS 从胞膜内侧转位到外侧,PS 的转位会诱导周围的吞噬细胞识别并清除凋亡细胞,但annexin A5与PS 有极高的亲和力,两者结合会阻碍PS 的暴露,从而抑制吞噬细胞对凋亡细胞的识别和结合,进而抑制凋亡进程[7]。Hawkins 等[8]报道,敲除ANXA5基因的DT40 细胞因缺乏annexin A5 而无法发生钙离子依赖的细胞凋亡,这也说明annexin A5 具有抗凋亡活性。还有研究资料显示,annexin A5 可能参与器官纤维化过程。Luo 等[9]报道,硅诱导的肺纤维化小鼠血浆和肺组织annexin A5 含量显著升高,并证实硅诱导的肺纤维化小鼠TGF-β1 和IL-1 表达的上调是依赖于annexin A5 的,他们认为annexin A5 通过促进巨噬细胞活化、促进肺部炎症而介导肺纤维化的发生。Buckley 等[10]报道,特发性肺纤维化患者肺泡灌洗液中含高浓度可溶性annexin A5,annexin A5的高表达与肺部炎症和纤维化存在显著相关性;此外,经annexin A5 处理的肺泡Ⅱ型上皮细胞能刺激培养的成纤维细胞增殖及炎症因子和促纤维化细胞因子的释放。最近有研究报道,annexin A5 通过促进自噬体向溶酶体的递送来促进自噬[11]。我们Western bolt 的检测结果表明,UUO 术后大鼠梗阻肾的annexin A5 表达明显高于正常水平,随后逐渐回降,但在RIF 整个发病过程中始终高于正常水平。然而,目前尚未见有关annexin A5与RIF 发病之间相关性的研究报道。综上所述,annexin A5 与细胞凋亡、炎症调节、肺纤维化发生等病理生理过程有一定相关性,那么annexin A5在RIF 发病过程到底起何种作用?为什么annexin A5 的表达在RIF 早期明显增高后又有所回降,这种回降对RIF 的发生发展有何意义?annexin A5 这种变化情况是否意味着annexin A5仅仅在RIF早期的某种或某些病理变化中发挥重要作用,而非在RIF 整个发病过程都起主导作用?这些都很值得深入探讨,通过进一步研究或许能揭示RIF发病过程中过去不曾被认识的规律。

表2 各差异蛋白质功能的UniProt数据库查询结果Table 2. Functions of the differential proteins retrieved from UniProt database
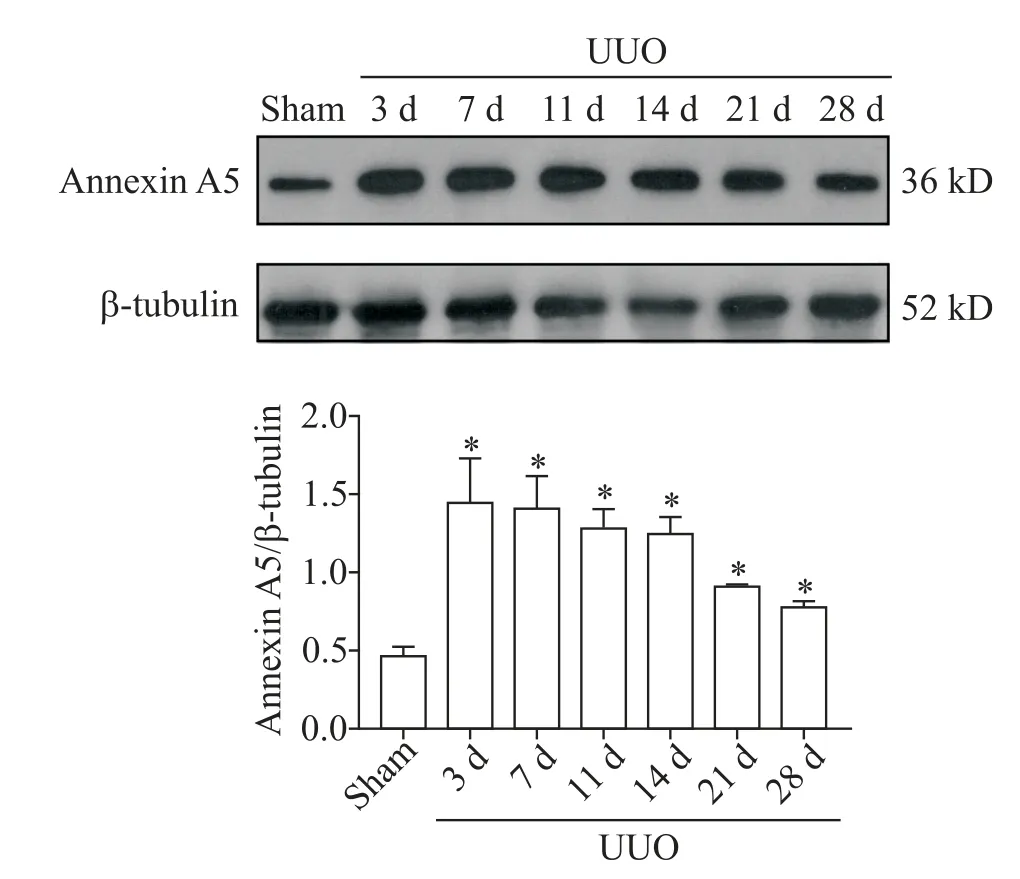
Figure 5. Expression level of annexin A5 in each group. Mean±SD. n=3. *P<0.05 vs sham group.图5 各组大鼠的annexin A5表达情况
