虾青素通过抑制活性氧簇/NLRP3炎症小体减轻对比剂引起的大鼠急性肾损伤*
2021-04-06孙延虎李文华
宋 亮, 姚 舜, 孙延虎, 吴 鑫, 李文华,2△
(徐州医科大学 1心血管病研究所,2附属医院心血管内科,江苏徐州221000)
随着近年来冠心病介入诊疗技术的发展,对比剂的使用日益增多。对比剂急性肾损伤(contrast-induced acute kidney injury,CI-AKI)已经成为医源性肾功能损伤的第3 位原因[1]。CI-AKI 的发病机制尚未完全明确,目前主要认为与对比剂对肾小管上皮细胞的直接肾毒性、肾脏血流动力学改变和氧化应激损伤等有关[2]。CI-AKI 尚无有效的治疗方法,水化疗法已经被证实可以有效预防CI-AKI[3]。多种药物如N-乙酰半胱氨酸(N-acetylcysteine,NAC)、他汀[4-5]等也被研究应用于CI-AKI 的防治。NAC 作为一种公认的抗氧化剂,可以抑制组织活性氧簇(reactive oxygen species,ROS)的生成,减轻大鼠对比剂急性肾损伤已经得到实验证实[6],但尚无循证医学证据证明其在临床CI-AKI的预防中有着积极作用。虾青素(astaxanthin,AST)是一种天然存在的红色类胡萝卜素,是一种强效的抗氧化剂,目前有研究表明虾青素通过减轻氧化应激,抑制细胞凋亡[7],减轻CIAKI,但其具体机制仍未明确。本实验通过大鼠CIAKI 模型,研究核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)在CI-AKI 发生中的作用及虾青素干预效果,为研究预防CI-AKI 药物提供实验依据。
材料和方法
1 实验动物与试剂
SPF级SD雄性大鼠40只,重(180±20)g,购自济南朋悦实验动物繁育有限公司(动物合格证号为1107261911002306)。
2 主要试剂
虾青素、NAC 和N-硝基-L-精氨酸甲酯(N-nitro-L-arginine methylester,L-NAME)购自北京索莱宝;碘海醇(每mL 含350 mg I)购自扬子江药业;吲哚美辛(上海麦克林);4%多聚甲醛(武汉赛维尔);血清肌酐(serum creatinine,SCr)试剂盒和血尿素氮(blood urea nitrogen,BUN)试剂盒(南京建成);RIPA(强)、PMSF、BCA 蛋白浓度检测试剂盒和5×蛋白上样缓冲液(上海碧云天);SDS-PAGE 变性丙烯酰胺凝胶试剂盒(上海生工生物工程);Protein Ladder(10~180 kD)购自Thermo Fisher Scientific;PVDF膜(Millipore);BSA(Vicmed);TUNEL 试 剂 盒(Roche);兔抗NLRP3 抗体(Abcam);兔抗含胱天蛋白酶募集结构域的凋亡相关斑点样蛋白(apoptosisassociated speck-like protein containing a caspase recruitment domain,ASC)抗体和兔抗白细胞介素1β(interleukin-1β,IL-1β)抗体(Bioss);兔抗胱天蛋白酶1(caspase-1)抗体、兔抗IL-18 抗体、鼠抗GAPDH抗体、山羊抗兔IgG 抗体和山羊抗鼠IgG 抗体(Proteintech);ECL 显色液(Bioworld)。实验中虾青素溶解于橄榄油配制成1 g/L 溶液;NAC 和L-NAME 溶解于PBS配制成10 g/L溶液;吲哚美辛溶解于PBS配制成1 g/L溶液。
3 主要方法
3.1 动物分组与造模方法 40 只大鼠随机分为5组,对照组(control组)、虾青素对照组(AST组)、造模(contrast media,CM)组、虾青素预处理治疗组(AST+CM 组)及NAC 预处理治疗组(NAC+CM 组),每组各8 只。大鼠CI-AKI 模型的建立参考前人文献中的方法[8],具体操作如下:所有大鼠禁食禁水12 h 后经10%水合氯醛(3.0 mL/kg)麻醉,除control 组及AST组大鼠外,其他组大鼠经尾静脉依次缓慢注射吲哚美辛(10 mg/kg)、L-NAME(10 mg/kg)和碘海醇(3 g I/kg),注射两种药物中间间隔15 min。对照组及虾青素对照组大鼠则于相同时间点分别依次注射等量PBS、生理盐水和生理盐水。其中AST 组和AST+CM组大鼠于造模前7 d 和造模后3 d 以10 mg/kg 的AST溶液灌胃,其他组大鼠以等体积橄榄油灌胃;NAC+CM 组大鼠造模前12 h 进行10 mg/kg NAC 溶液腹腔注射。所有组大鼠于灌胃第8 天进行CI-AKI 模型的建立,72 h 后心脏穿刺取血6~8 mL,室温静置1 h 后4℃、3 000 r/min 离心15 min,取上清置于-80℃冰箱待用。剪开腹部皮肤及肌肉组织,分离出双侧肾脏,取一部分固定于4%多聚甲醛溶液,4℃冰箱保存,用于石蜡切片的制作及HE 染色,TUNEL,及免疫组化检测。另一部分固定于-80℃冰箱,用于提取组织蛋白及冰冻切片ROS染色。
3.2 血清生化指标的检测 取保存的血清样本,按试剂说明书检测SCr水平和BUN水平。
3.3 HE 染色 取固定于4%多聚甲醛中的肾脏组织,按脱水透明浸蜡、包埋、切片步骤制作石蜡切片,按脱蜡、苏木素-伊红染色、脱水步骤进行切片HE 染色,光学显微镜(×400)观察分析。
3.4 TUNEL实验 取用制作好的石蜡切片,按照组织修复、滴加TUNEL 工作液、DAB 染色、细胞核复染等步骤进行TUNEL 染色,光学显微镜(×400)观察,用ImageJ软件统计分析肾小管上皮细胞凋亡率。
3.5 ROS 染色 取冻存于-80℃的肾脏组织制作肾脏冰冻切片,依照淬灭荧光、滴加ROS 染液、DAPI 复染进行肾组织冰冻切片ROS 染色,荧光显微镜(×400)观察分析。
3.6 免疫组织化学染色 取用制作好的石蜡切片,将其进行抗原修复、封闭等步骤后,按照说明书要求比例配制NLRP3(1∶100)、ASC(1∶100)、IL-1β(1∶100)和IL-18(1∶50)Ⅰ抗工作液孵育过夜后滴加相应Ⅱ抗工作液,随后进行DAB显色和细胞核复染,光学显微镜(×400)观察分析,ImageJ 软件统计分析阳性率。
3.7 Western blot 检测蛋白含量 用RIPA、PMSF 提取组织蛋白,BCA 法测定蛋白浓度,将制好的蛋白样本置入电泳仪电泳,电泳完成后应用PVDF 膜电转,电转结束后脱脂奶粉封闭,按说明书配制抗NLRP3(1∶500)、ASC(1∶1 000)、caspase-1(1∶1 000)、IL-1β(1∶1 000)和IL-18(1∶1 000)抗体工作液,4℃摇床孵育10 h,相应Ⅱ抗(1∶5 000)孵育1 h,ECL 化学发光成像系统检测成像。以GAPDH 为内参照,采用ImageJ 1.40软件进行分析,测其积分吸光度,计算上述蛋白的相对表达量。
4 统计学处理
用GraphPad Prism 8.0 软件对实验数据进行统计学分析。计量数据以均数±标准差(mean±SD)表示,多组间数据的比较采用单因素方差分析(oneway ANOVA),各组间两两比较采用Tukey 检验。以P<0.05为差异有统计学意义。
结果
1 大鼠肾功能指标检测
大鼠血清肌酐和血尿素氮检测结果如表1 所示。与control组相比,AST组大鼠SCr和BUN水平无明显变化,差异无统计学显著性(P>0.05);CM 组大鼠的SCr和BUN水平均明显增高(P<0.01);与CM组相比,给予AST 或NAC 预处理均可以显著下降SCr和BUN的水平(P<0.01)。见表1。

表1 各组大鼠SCr和BUN水平及肾小管上皮细胞凋亡率的检测结果Table 1. The levels of SCr and BUN,and apoptotic rate of renal tubular epithelial cells of the rats in each group(Mean±SD. n=5)
2 肾脏HE染色
肾脏HE 染色结果如图1 所示,control 组及AST组大鼠的肾脏肾小球结构正常,小管上皮完整,无肿胀变性;CM 组大鼠可见肾小管肿胀充血,管腔阻塞,小管上皮细胞空泡样变性,可见少量坏死细胞;AST+CM组和NAC+CM组大鼠的肾脏损伤较CM组明显减轻,可见少量上皮细胞空泡变性及管腔充血。
3 TUNEL检测肾小管上皮细胞凋亡
TUNEL 阳性细胞细胞核被染为棕褐色,结果如图2、表1 所示。与control 组相比,AST 组大鼠肾小管上皮细胞凋亡水平无明显变化,差异无统计学显著性(P>0.05);CM 组大鼠肾小管上皮细胞凋亡水平明显增高(P<0.01);与CM 组相比,AST+CM 组和NAC+CM组的细胞凋亡水平明显降低(P<0.01)。
4 冰冻切片ROS染色
ROS阳性细胞在510~560 nm激发波长下呈红色荧光,正常细胞在330~380 nm 激发波长下成蓝色荧光。ROS 染色结果显示,与control 组和AST 组相比,CM组ROS阳性表达细胞明显增多;与CM组相比,应用AST 和ROS 抑制剂NAC 预处理均可以减少肾小管上皮细胞ROS的生成,见图3。
5 免疫组化染色观察
5.1 NLRP3 炎症小体组分NLRP3 和ASC NLRP3免疫组化结果显示,各组大鼠肾脏组织内均有一定量NLRP3 的表达。与control 组相比,AST 组大鼠NLRP3 表达水平的差异无统计学显著性(P>0.05),CM 组大鼠NLRP3 表达水平显著升高(P<0.01);与CM 组相比,AST+CM 组和NAC+CM 组大鼠NLRP3表达显著减少(P<0.01),见图4。ASC免疫组化结果显示,各组大鼠肾脏组织内均有一定量ASC 的表达。与control 组相比,AST 组大鼠ASC 表达水平的差异无统计学显著性(P>0.05),CM 组大鼠ASC 表达水平显著升高(P<0.01);与CM 组相比,AST+CM 组和NAC+CM 组 大 鼠ASC 表 达 显 著 减 少(P<0.01),见图5。
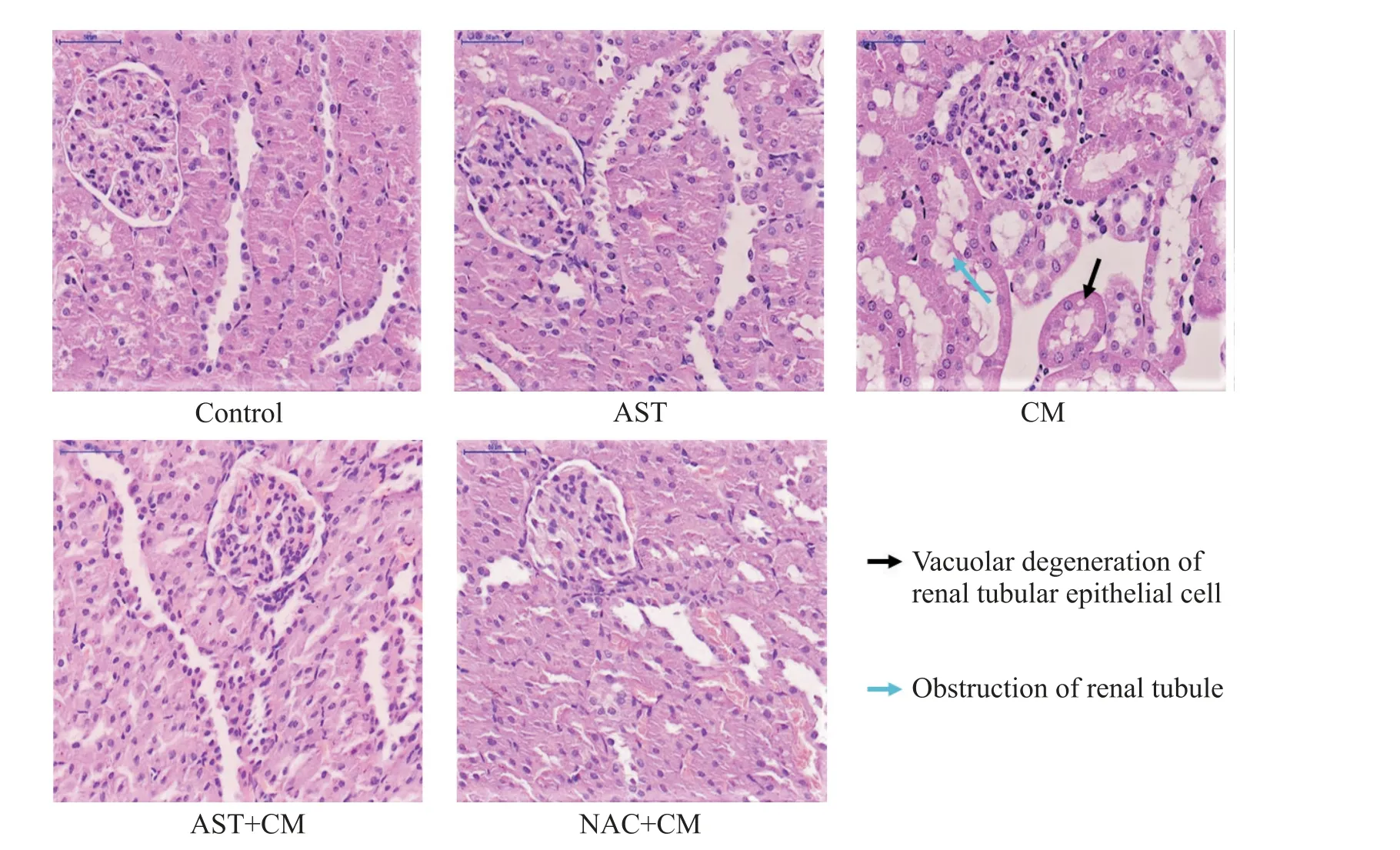
Figure 1. Histopathological observation(HE staining,×400,scale bar=50 μm). Proximal and distal tubules were normal,and no vacuolization in control group was observed. Renal tubular epithelial cells were arranged loosely and disorderly,significant vacuolization,proteinaceous cast and tubular necrosis in CM group were found. These microscopic changes had attenuated in AST and NAC groups.图1 各组大鼠肾脏HE染色
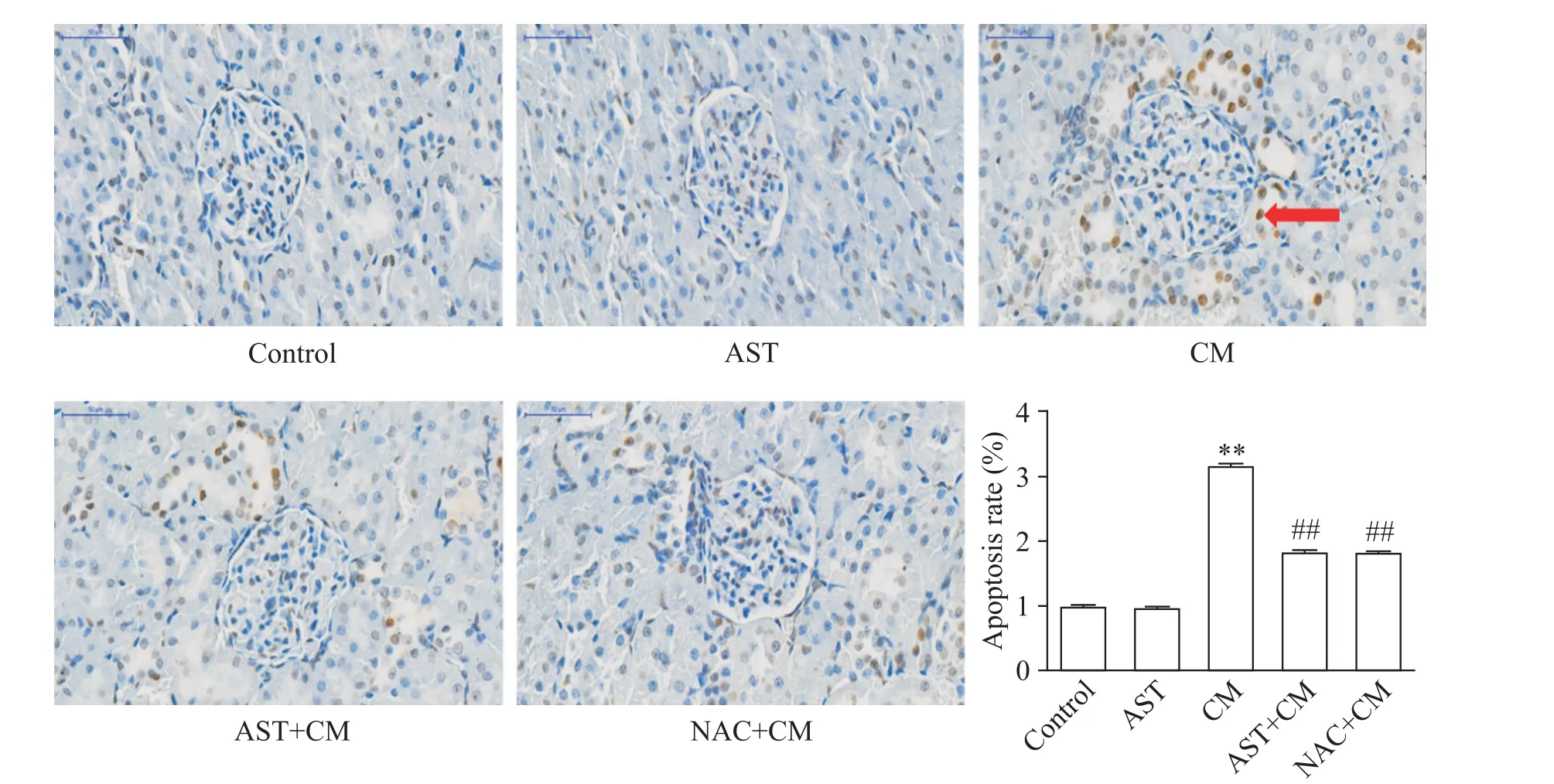
Figure 2. TUNEL staining of rat kidneys in each group showed apoptosis(×400,scale bar=50 μm). Mean±SD. n=5. **P<0.01 vs control group;##P<0.01 vs CM group.图2 各组大鼠肾脏TUNEL染色
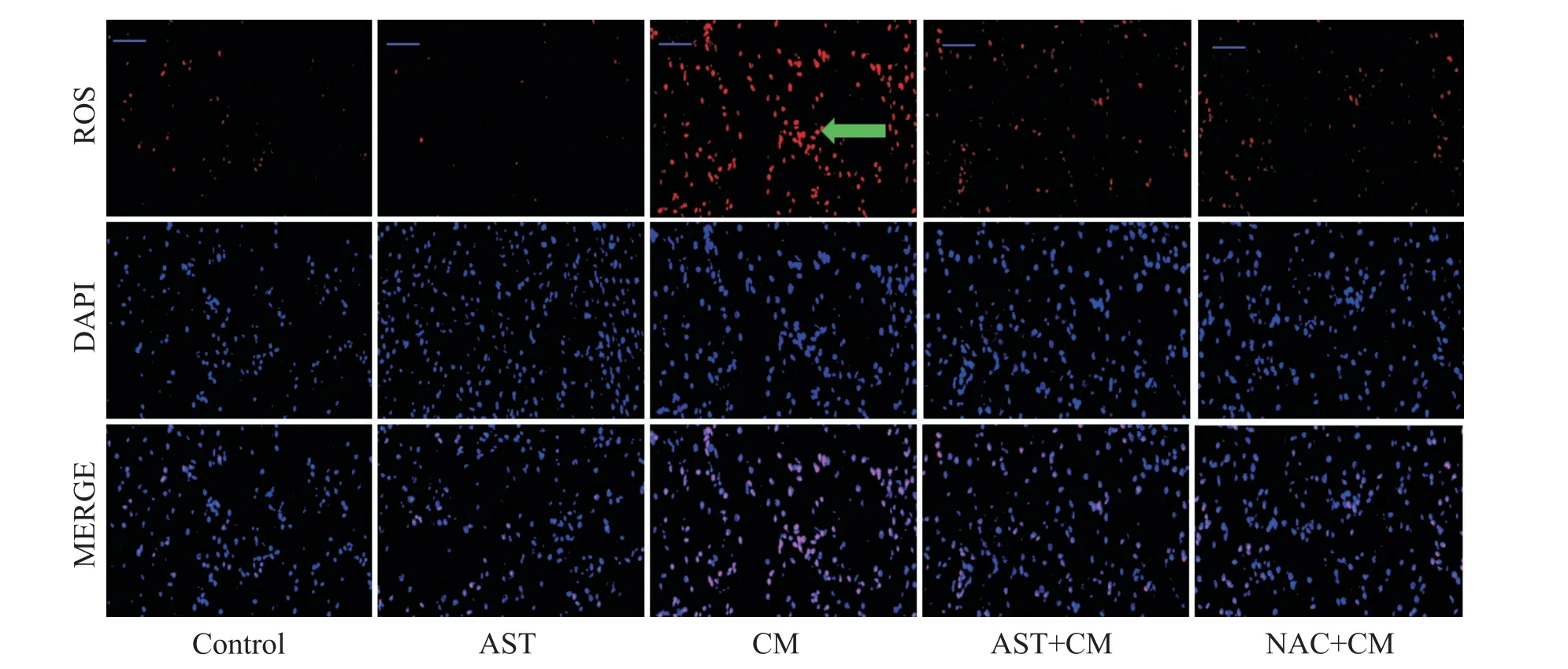
Figure 3. ROS staining of rat kidneys in each group showed oxidative stress(×400,scale bar=50 μm).图3 各组大鼠肾脏冰冻切片ROS染色

Figure 4. Immunohistochemistry results of NLRP3 in each group(×400,scale bar=50 μm). Mean±SD. n=5. **P<0.01 vs control group;##P<0.01 vs CM group.图4 各组大鼠NLRP3免疫组化表达情况
5.2 IL-1β IL-1β 的免疫组化结果显示,各组大鼠肾脏组织内均有IL-1β 表达,control 组和AST 组的IL-1β 表达水平较低;与control 组相比,AST 组大鼠IL-1β 表达水平的差异无统计学显著性(P>0.05),CM 组大鼠的IL-1β 表达水平显著升高(P<0.01);与CM 组相比,AST+CM 组的IL-1β 表达水平降低(P<0.05),NAC+CM 组 的IL-1β 表 达 水 平 降 低(P<0.01),见图6。
5.3 IL-18 IL-18 的免疫组化结果显示,CM 组、AST+CM 组和NAC+CM 组的大鼠肾脏组织内均有一定量IL-18 的表达,而control 组和AST 组的IL-18 表达水平较低。与control 组相比,AST 组大鼠IL-18 表达水平的差异无统计学显著性(P>0.05),CM 组大鼠的IL-18 表达水平显著增高(P<0.01);与CM 组相比,应用AST和NAC预处理均可显著降低IL-18的表达水平(P<0.01),见图7。
6 Western blot检测结果
6.1 NLRP3 炎症小体组分NLRP3、ASC 和caspase-1 p20的表达 如图8所示,与control组相比,AST组大鼠的NLRP3 炎症小体各组分NLRP3、ASC 和caspase-1 p20 的表达水平的差异无统计学显著性(P>0.05),CM 组大鼠NLRP3、ASC 和caspase-1 p20的表达水平均显著增高(P<0.01);与CM 组相比,AST+CM 组和NAC+CM 组大鼠NLRP3 炎症小体各组分的表达明显减少(P<0.01)。
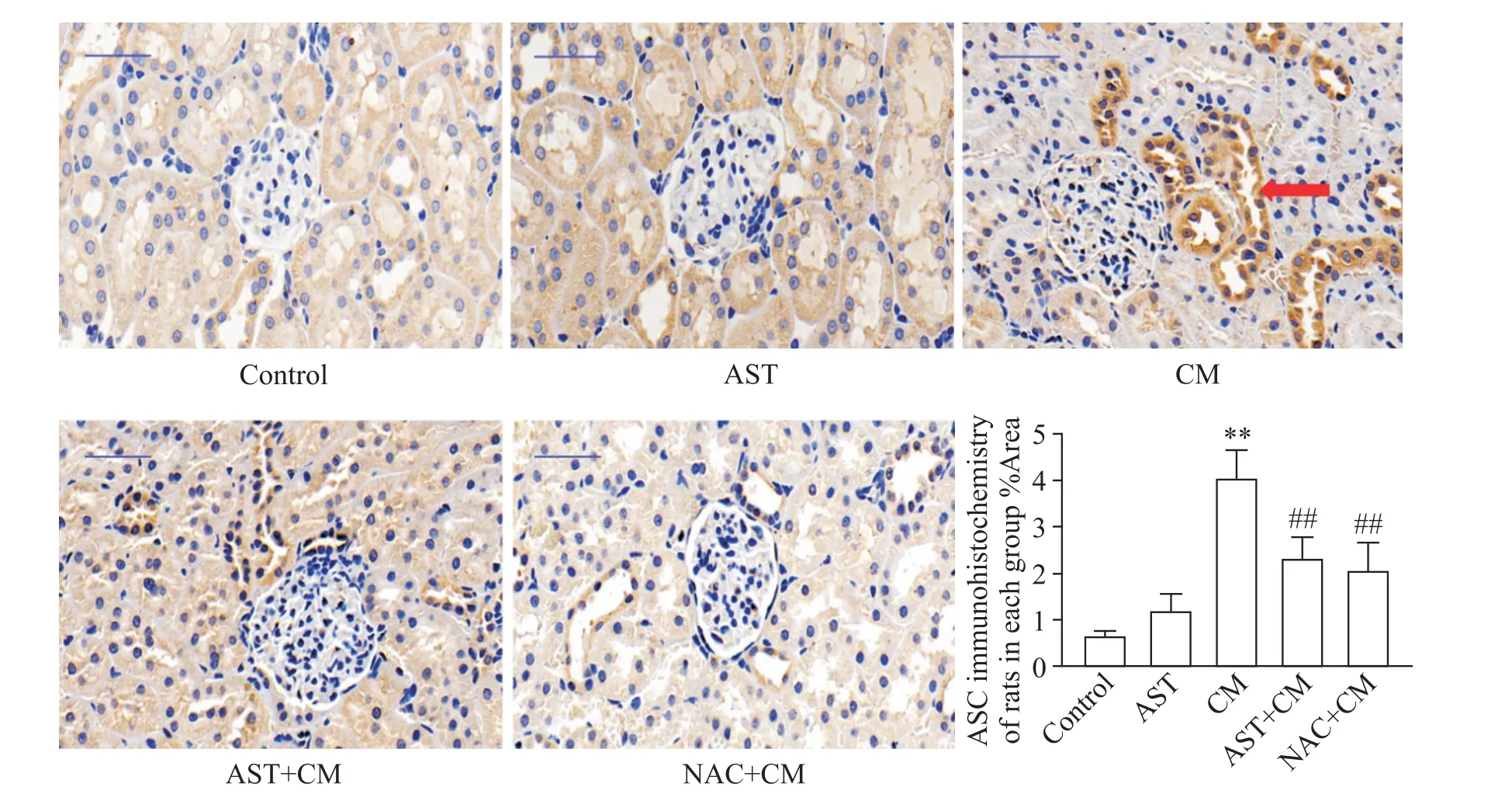
Figure 5. Immunohistochemistry results of ASC in each group(×400,scale bar=50 μm). Mean±SD. n=5. **P<0.01 vs control group;##P<0.01 vs CM group.图5 各组大鼠ASC免疫组化表达情况
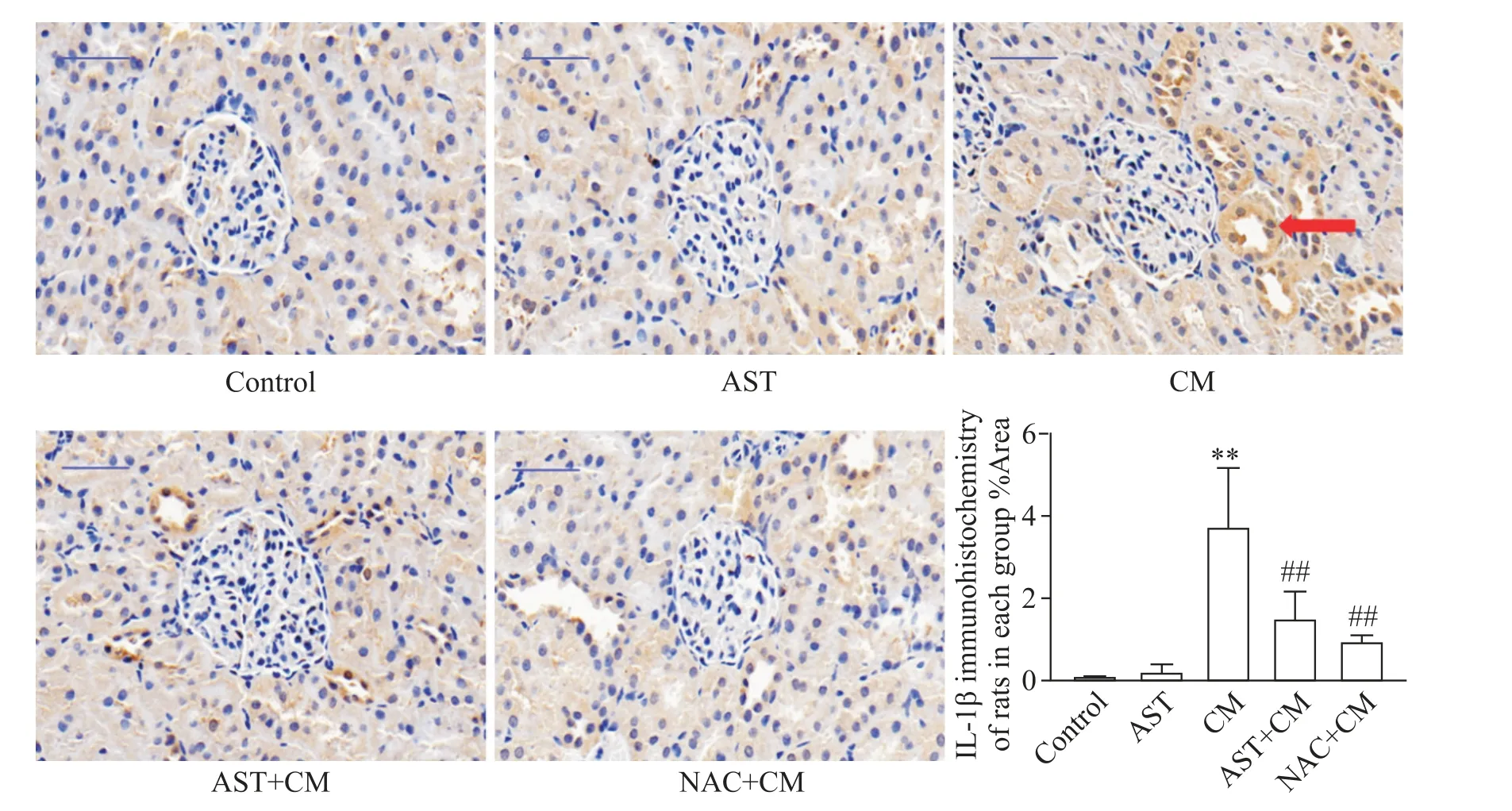
Figure 6. Immunohistochemistry results of IL-1β in each group(×400,scale bar=50 μm). Mean±SD. n=5. **P<0.01 vs control group;##P<0.01 vs CM group.图6 各组大鼠IL-1β免疫组化表达情况
6.2 IL-1β 和IL-18 的表达 如图9 所示,与control组相比,AST 组大鼠的IL-1β 和IL-18 表达水平的差异无统计学显著性(P>0.05),CM 组大鼠的IL-1β 和IL-18表达水平均显著增高(P<0.01);与CM 组相比,应用AST或NAC预处理可显著降低IL-1β和IL-18的表达(P<0.01)。
讨论
CI-AKI 是指应用对比剂后48~72 h 内,SCr 水平升高0.5 mg/dL(44 μmol/L)或较基线升高≥25%,并除外其他肾损伤的可能[9]。CI-AKI 的发生与患者本身和患者接受对比剂的方式都有关。CI-AKI在一般患者中发生率并不高,而慢性肾脏疾病是CI-AKI 最强的危险因素,且患者的基础肾功能越差,发生CIAKI 的风险越高[10]。目前尚无有效治疗CI-AKI 的方法,因此预防受到了临床的广泛关注。目前公认水化疗法是有效的预防措施,但心、肾功能不全患者无法充分水化[11]。现认为CI-AKI发生的病理生理机制主要包括:(1)碘对比剂对肾小管上皮细胞的直接毒性作用,导致细胞功能丧失、细胞坏死和凋亡[12];(2)肾脏血流动力学改变[2];(3)肾髓质对缺氧的高敏感性[13];(4)氧化应激损伤[14]。有实验研究表明,NAC 可以减轻在缺血再灌注引起的氧化应激,其可能改变肾脏血流动力学,直接减弱其氧化应激反应而起到预防CI-AKI的作用[15]。
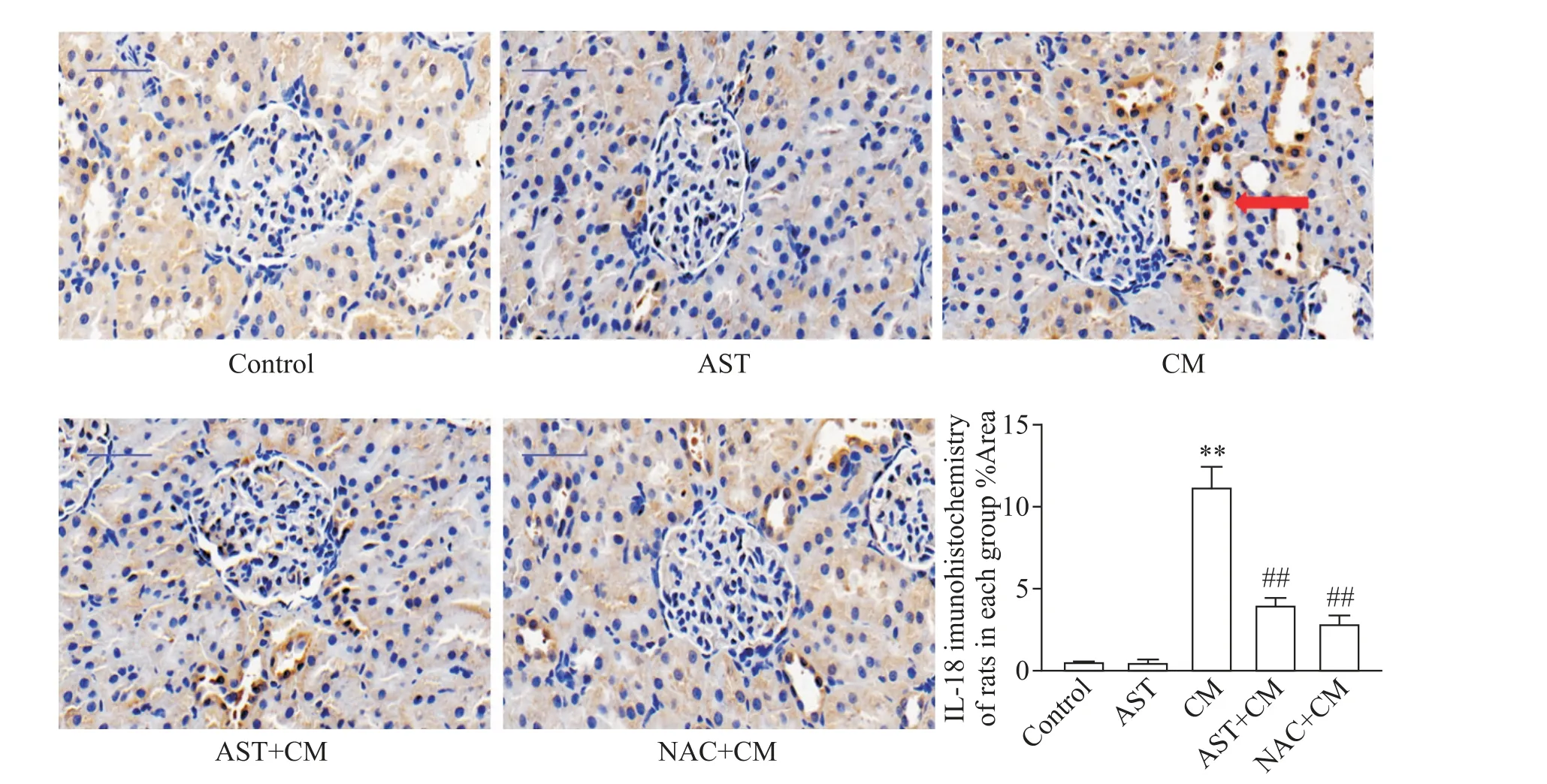
Figure 7. Immunohistochemistry results of IL-18 in each group(×400,scale bar=50 μm). Mean±SD. n=5. **P<0.01 vs control group;##P<0.01 vs CM group.图7 各组大鼠IL-18免疫组化表达情况
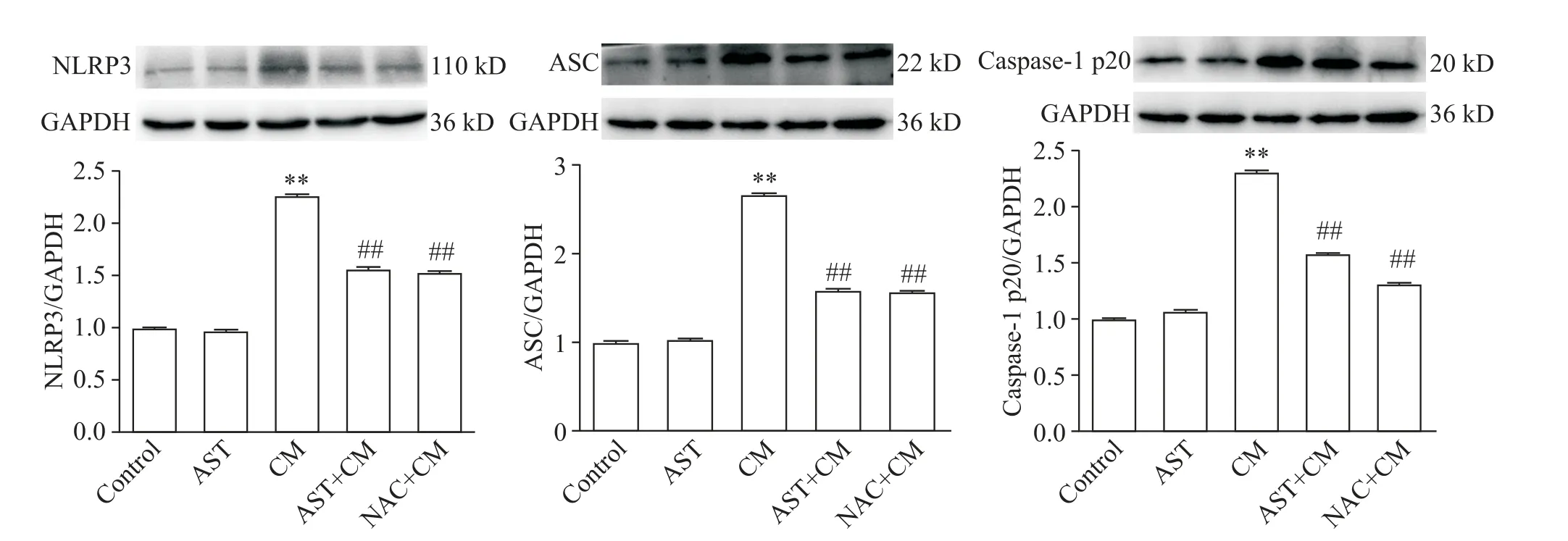
Figure 8. The protein expression of NLRP3,ASC and caspase-1 p20 in the rats of each group. Mean±SD. n=5. **P<0.01 vs control group;##P<0.01 vs CM group.图8 各组大鼠NLRP3、ASC和caspase-1 p20蛋白的表达
NLRP3 是NLR 家 族 的 一员,能 够通 过ASC 与caspase-1组成多蛋白复合体,即NLRP3炎症小体[16]。正常情况下,NLRP3 炎症小体的活化可触发防御性炎症反应,清除病原体。但持续或异常的NLRP3 活化是许多慢性病或退行性疾病的基础。已有多项研究证实,NLRP3 炎症小体的不恰当活化与糖尿病、痛风、动脉粥样硬化、骨关节炎、阿尔茨海默病的发生有关[17-21]。最近的研究表明,NLRP3 炎症小体及其介导的下游细胞凋亡和炎症反应,在CI-AKI 的发生发展中起着重要作用[22-24]。目前NLRP3 炎症小体活化的机制尚未完全阐明。NLRP3炎症小体活化的可能机制包括:(1)K+外流[25];(2)细胞溶酶体的吞噬作用[26];(3)ROS 的生成[27];(4)Ca2+内流[28]。目前ROS 被认为是激活NLRP3 炎症复合物的关键分子之一,ROS 可以通过特有途径诱导NLRP3 炎症小体的组装和激活[29]。
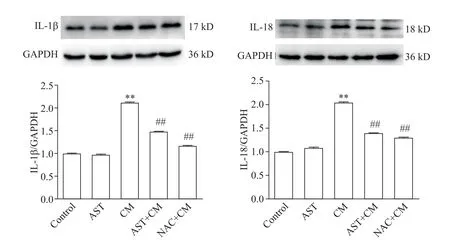
Figure 9. The protein expression of IL-1β and IL-18 in the rats of each group. Mean±SD. n=5. **P<0.01 vs control group;##P<0.01 vs CM group.图9 各组大鼠IL-1β和IL-18蛋白的表达
虾青素作为自然界最强的抗氧化剂,其抗氧化性是维生素E 的数百倍,有报道指出虾青素可以抑制氧化应激诱导的线粒体功能障碍和ROS 的产生,对抗炎、抗凋亡具有积极的作用[30]。有研究表明虾青素可以保护高糖暴露下的近端肾小管上皮细胞[31],改善糖尿病肾病大鼠的炎症反应和凋亡[32]。我们在实验中发现虾青素作为抗氧化剂,与ROS 抑制剂NAC 都可以抑制肾组织ROS 的产生。与此同时,我们发现CI-AKI 大鼠肾脏中NLRP3 炎性体组分和下游炎症介质IL-1β 和IL-18 的表达均明显增高,而虾青素可以拮抗此效应。因此我们推测,虾青素可以通过抑制ROS 的产生,抑制NLRP3 炎症小体的活化,抑制下游炎症反应和凋亡,从而减轻大鼠CIAKI。虽然本实验证实虾青素可以减轻大鼠CI-AKI,为CI-AKI 的预防提供了新的思路,但虾青素对肾脏的保护作用机制和临床应用仍需要进一步研究。
