不同发酵剂对发酵香肠菌相、挥发性风味成分及品质的影响
2021-04-06张香美裴正钰闫洪波
张香美,卢 涵,叶 翠,裴正钰,闫洪波
(河北经贸大学生物科学与工程学院,石家庄050061)
发酵香肠因其特殊风味和品质而受到人们喜爱,但传统自然发酵香肠质量稳定性及安全性难以保证[1]。为实现发酵香肠工业化生产,满足消费者对食品安全和健康追求,保证发酵香肠风味品质,人工接种发酵备受关注。接种发酵剂可缩短成熟时间,提高发酵香肠安全性、稳定性及货架期[2-3],增强风味[4]。此外,发酵剂使用对降低发酵香肠中亚硝酸盐含量也具有一定作用[5]。
发酵香肠中菌群结构和组成对产品品质发挥决定性作用。Illumina MiSeq高通量测序技术已广泛应用于发酵食品微生物群体结构分析,具有较高准确性和灵敏度[6-7]。气相色谱-离子迁移谱分析方法,可实现挥发性有机物(Volatile organic compounds,VOCs)快速检测、识别,Liu等采用该方法分析金华火腿特征香气成分[8],Tian等采用顶空-GC-IMS分析干腌猪肉风味成分[9]。本试验利用从自然发酵肉中筛选出的植物乳杆菌(Lactobacillus plantarum)和腐生葡萄球菌(Staphylococcus saprophyticus)作为菌种,制备复合发酵剂发酵香肠,并设接种商业发酵剂对照和空白对照,探究不同发酵剂对发酵香肠菌相、挥发性风味成分、品质影响,旨在为人工接种发酵香肠质量安全控制提供科学支撑。
1 材料与方法
1.1 材料与试剂
新鲜猪肉购于石家庄市北国超市天河店;一耕一耘盐渍猪肠衣购自京东;商业发酵剂VBM-60购自上海昊岳食品科技有限公司。
菌种:植物乳杆菌b-2(CGMCC No.13413)和腐生葡萄球菌sw50均为实验室分离并保存菌种。
1.2 仪器与设备
FE28型pH计,梅特勒-托利多仪器(上海)有限公司;759CKT紫外可见分光光度计,上海菁华科技有限公司;博勒飞CT3质构仪,美国Brookfield公司;Flavour-Spec®气相色谱离子迁移谱联用仪,德国G.A.S.;CM-700d/600d分光测色计,日本柯尼卡美能达。
1.3 方法
1.3.1 发酵香肠制作
将植物乳杆菌b-2和腐生葡萄球菌sw50分别接种到MRS和LB液体培养基中37℃过夜培养活化,连续活化2代。将活化后b-2菌株以1%接种量接种到MRS液体培养基,37℃培养14 h;将活化后sw50菌株以1%接种量接种到LB液体培养基,37℃150 r·min-1培养24 h。6 000 r·min-14℃离心5 min收集菌体,洗涤3~4次后用无菌生理盐水重悬,调整菌液浓度为109CFU·mL-1备用。
新鲜猪肉(肥瘦比1∶4)→预处理→加入辅料(绵白糖2.5%,食盐2.5%,发色剂0.2%,味精0.3%)→接种发酵剂(107CFU·g-1)→灌肠→37℃控温发酵30 h→烘烤成熟→成品。
本试验分为4组,CK1组:等量无菌生理盐水代替发酵剂;CK2组:接种商业发酵剂VBM-60(木糖葡萄球菌、戊糖葡萄球菌和植物乳杆菌);A组:接种植物乳杆菌b-2与腐生葡萄球菌sw50(1:1);B组:接种植物乳杆菌b-2与腐生葡萄球菌sw50(1∶3)。
每6 h采集1次样品用于测定常规理化指标,每组设3个平行;发酵30 h样品保存于-80℃,用于菌相和挥发性风味物质测定。
1.3.2 菌群高通量测序分析
采 用338F-806R为 引 物 对V3~V4区PCR扩增,构建高通量测序文库,利用Illumina公司Miseq PE300平台对发酵香肠样本测序,每个样品设5次重复。测序完成后,用QIIME2 feature-classifier插件将ASV代表序列比对到GREENGENES数据库,得到物种分类信息表[10]。
1.3.3 发酵香肠挥发性风味组分分析
采用FlavourSpec®气相色谱离子迁移谱联用仪测试。分别取2 g样品于20 mL顶空进样瓶中,40℃孵化15 min,孵化速度为500 r·min-1。顶空进样针温度为85℃,进样500μL。
气相色谱参数为:色谱柱FS-SE-54-CB-1(15 m×0.53 mm),温度60℃,载气为N2,运行30 min,起始流速2 mL·min-1,保持2 min后8 min内增至10 mL·min-1,接着10 min内增至100 mL·min-1,最后10 min内线性增至150 mL·min-1。
1.3.4 发酵香肠感官评价
发酵香肠感官评价参照崔国健方法[11]。评价指标及评分标准见表1。
每个评价指标评分记为Xi(i=1,2,3),总分为X总=0.2X1+0.3X2+0.5X3,最终评分为各X总平均值。

表1 发酵香肠感官评分Table 1 Criteria of sensory evaluation of fermented sausage
1.3.5 质构特性测定
利用配备有TA3/100探头质构仪测定。将发酵香肠切成1 cm3立方体,测前、测中和测后速率均为1 mm·s-1,压缩比30%,触发力10 g。
1.3.6 色差测定
利用柯尼卡美能达分光测色计测定色差,采用D65光源,样品切片后切面覆盖聚乙烯薄膜压平,测定样品明度值(L*)、红度值(a*)和黄度值(b*)。
1.3.7 pH测定
将FE28型pH计校准后,直接插入发酵香肠中测定。
1.3.8 亚硝酸盐残留量测定
发酵香肠中亚硝酸盐残留量测定参照文献12。
1.3.9 TBARS测定
TBARS测定参照段艳方法[13]。以不加样品空白组为对照。TBARS值以每kg脂质氧化样品中丙二醛mg数表示。计算公式如下:TBARS(mg·kg-1)=(A532-A600)/155×1/10×72.6×100。
1.3.10 数据处理与分析
所有试验数据均采用平均值±标准差。采用SPSS 22.0软件分析数据,采用GraphPad Prism 8.02软件作图。高通量测序试验数据均采用平均值。
2 结果与分析
2.1 发酵香肠样品菌相分析
根据OTU划分和分类地位鉴定结果,可获得每个发酵香肠样品在不同分类水平具体组成,选取每个样品在属水平上最大丰度排名前20物种,生成物种相对丰度柱状堆积图(见图1)。

图1 属水平上发酵香肠样品中物种相丰度Fig.1 Relative abundance of microbes in fermentation sausage samples at the genus level
由图1可知,4个发酵香肠样品菌群结构在属水平存在显著差异,接种植物乳杆菌b-2和腐生葡萄球菌sw50的A、B组中乳杆菌科(Lactobacillaceae)细菌占比最高,分别为89.44%和87.69%;其次是葡萄球菌属(Staphylococcus)分别占5.04%和5.34%。接种商业发酵剂CK2组香肠中优势菌为片球菌属(Pediococcus)、葡萄球菌属(Staphylococcus)和乳杆菌科细菌,所占比例分别为88.86%、3.75%和1.69%。不接种发酵剂CK1组中无明显优势菌,梭菌属(Clostridium)、乳球菌属(Lactococcus)、消化链球菌属(Peptostreptococcus)、沙雷菌属(Serratia)、葡萄球菌属和乳杆菌科细菌占比最多,分别为13.84%、12.90%、10.77%、9.28%、9.20%和7.85%。由此可见,添加发酵剂有利于抑制梭菌属和消化链球菌属等有害菌生长,保障发酵香肠品质和质量安全。
2.2 不同发酵香肠挥发性风味组分差异分析
挥发性风味组分测定结果见图2。左侧红色竖线为反应离子峰(Reaction ion peak,RIP),RIP峰两侧每一个点代表一种挥发性有机物。
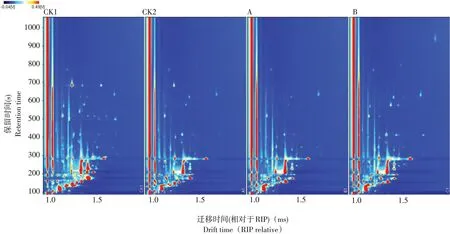
图2 接种不同发酵剂香肠气相色谱离子迁移谱Fig.2 Ion migration spectra of sausages fermented with different starter cultures
由图2可知,4种发酵香肠样品气相离子迁移谱图呈明显差异性。通过与GC-IMS Library Search软件内置2014NIST数据库和IMS数据库数据匹配,共识别出33种挥发性物质,包括酮类4种、醇类5种、醛类12种、酯类7种、酸类2种、烷羟类1种、烯羟类1种、吡嗪类1种。A、B组发酵香肠挥发性风味物质主要有:酮类4种(丙酮、2-丁酮、2-庚酮、呋喃酮)、醇类3种(乙醇、1-辛烯-3醇、正己醇)、醛类9种(2-甲基丁醛、乙缩醛单体、乙缩醛二聚体、戊醛单体、戊醛二聚体、辛醛、庚醛、己醛、3-甲基丁醛)、酯类5种(乙酸乙酯、3-甲基丁酸乙酯单体、3-甲基丁酸乙酯二聚体、丁酸乙酯、γ-丁内酯)、酸类2种(丁酸、异戊酸)、吡嗪类1种(三甲基吡嗪)、烷烃类1种(1,4-二恶烷)、烯烃类1种(E-2-辛烯)。
为更加直观对比不同发酵剂发酵香肠挥发性有机物组分差异性,将每组3个平行样品的GCIMS二维图谱中所有待分析峰,用Laboratory Analytical Viewer软件中Reporter和Gallery Plot插件生成指纹图谱(见图3)。图中每一行为一种样品;图中每一列为同一迁移时间下挥发性有机物组分信号峰。由图3可知,4种发酵香肠样品组间则呈明显差异性,其均有各自特征峰区域。
由于A、B两组添加发酵剂种类相同,所以两种发酵香肠挥发性物质组成相似,但与A组相比,添加1∶3植物乳杆菌b-2和腐生葡萄球菌sw50 B组发酵香肠中三甲基吡嗪、辛醛、庚醛含量较高。
与CK1组相比,B组中乙酸乙酯、2-甲基丁醛、乙缩醛、庚醛、己醛、辛醛、戊醛等物质含量较高。与使用商业发酵剂的CK2组相比,B组样品中乙酸乙酯、3-甲基丁酸乙酯单体、3-甲基丁酸乙酯二聚体、E-2-辛烯、丁酸乙酯、乙醇、三甲基吡嗪等含量较高。
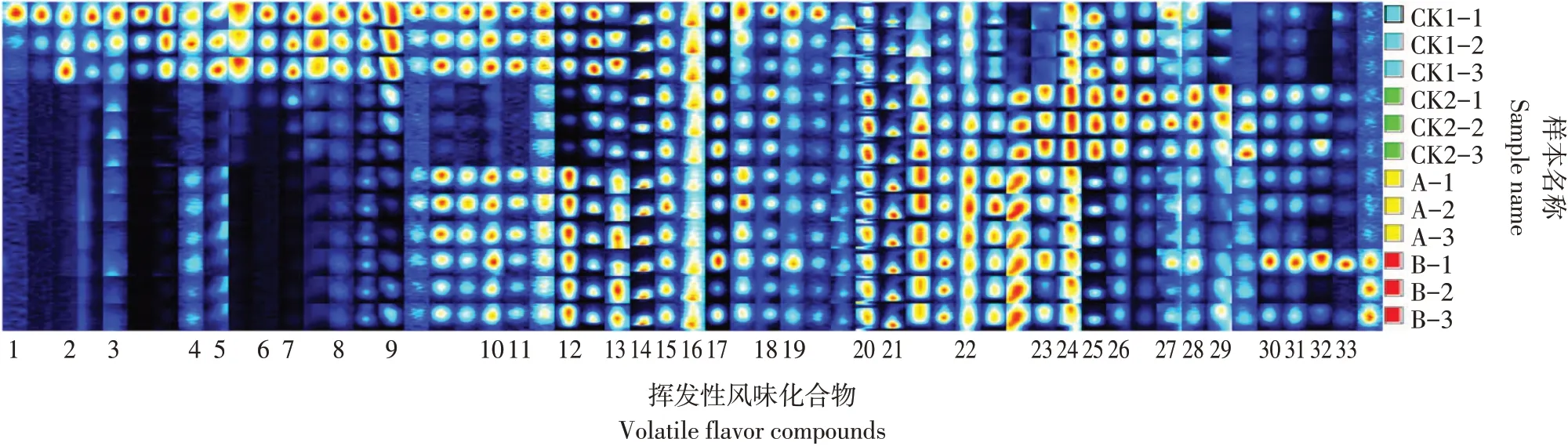
图3 接种不同发酵剂香肠挥发性物质指纹图谱Fig.3 Fingerprint of volatile substances in sausages fermented with different starter cultures
酯类物质是酸和醇通过酯化作用形成,对发酵香肠香气形成具有重要作用,乙酸乙酯具有醚香、果香气味,且呈味阈值低[14];3-甲基丁酸乙酯呈甜香、脂香味,周慧敏等在添加葡萄球菌腊肉中检测到该物质[15]。2-甲基丁醛为高香味活性值风味物质,具有黄油、焦糖风味[16]。乙缩醛是一种重要挥发性风味化合物,在发酵蓝莓酒[17]和食用花朵[18]中均检出该种风味化合物。乙酸乙酯、2-甲基丁醛、乙缩醛、3-甲基丁酸乙酯等挥发性风味物质是B组发酵香肠主体,使其具有明显果香味、脂香味。
2.3 不同发酵香肠感官评分结果
由表2可知,在外观、组织状态、口感与风味等方面,A、B组均优于CK1组发酵香肠,综合感官评价结果也显著优于自然发酵香肠CK1组(P<0.05)。B组在组织状态、口感与风味方面的评分显著(P<0.05)高于A组。B组在外观、口感与风味方面评分显著(P<0.05)高于CK2组。从综合评价结果看,接种1∶3植物乳杆菌b-2和腐生葡萄球菌sw50的B组发酵香肠整体感官品质最优,肠体较为饱满,切面较整齐,咀嚼性较好,有弹性,具有明显发酵香味,口感好。A组、CK2组香肠偏酸,不符合消费者口味。
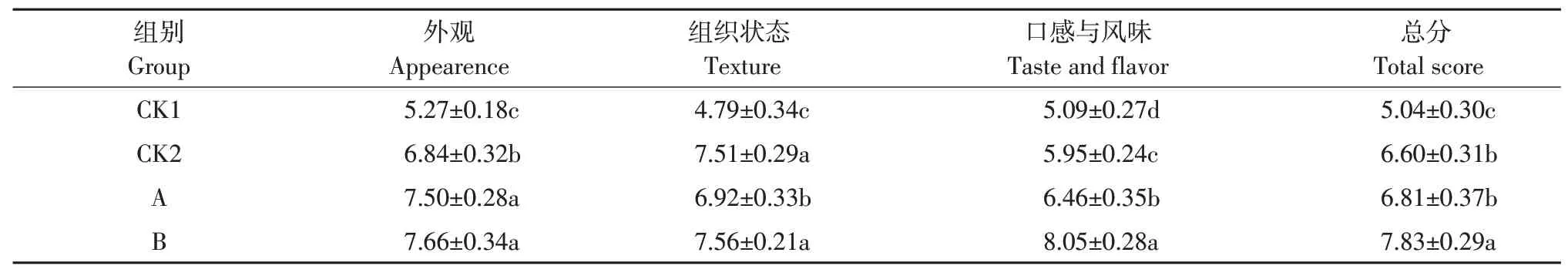
表2 不同发酵香肠感官评分Table 2 Sensory evaluation of different fermented sausages
2.4 不同发酵香肠色泽分析
色泽在较大程度上影响消费者消费欲望。从表3可知,接种发酵剂A、B组发酵香肠L*值、a*值均显著高于CK1组(P<0.05),发酵剂添加有助于发酵香肠色泽形成。B组L*值显著高于A组(P<0.05),A、B组a*值差异不显著(P>0.05)。B组与CK2组L*值、a*值差异均不显著(P>0.05)。各组发酵香肠b*值差异均不显著(P>0.05)。接种1∶3植物乳杆菌b-2和腐生葡萄球菌sw50的B组,其综合色泽指标最优。
2.5 不同发酵香肠质构分析
由表4可知,在质构方面,接种发酵剂A、B组发酵香肠硬度、咀嚼性、弹性、胶着性均显著(P<0.05)高于CK1组,这可能与乳酸菌产酸降低发酵香肠pH有关[19],较低pH使肉蛋白变性和凝固,使香肠结构更加紧密,从而提高香肠质构特性。Lv等研究发现植物乳杆菌与酸肉硬度和胶着性呈正相关[20]。与A组相比,B组硬度、咀嚼性和胶着性更佳(P<0.05)。B组与CK2组硬度、咀嚼性、弹性和胶着性均无显著差异(P>0.05)。

表3 不同发酵剂发酵香肠色泽分析Table 3 Analysis of the color of different fermented sausages
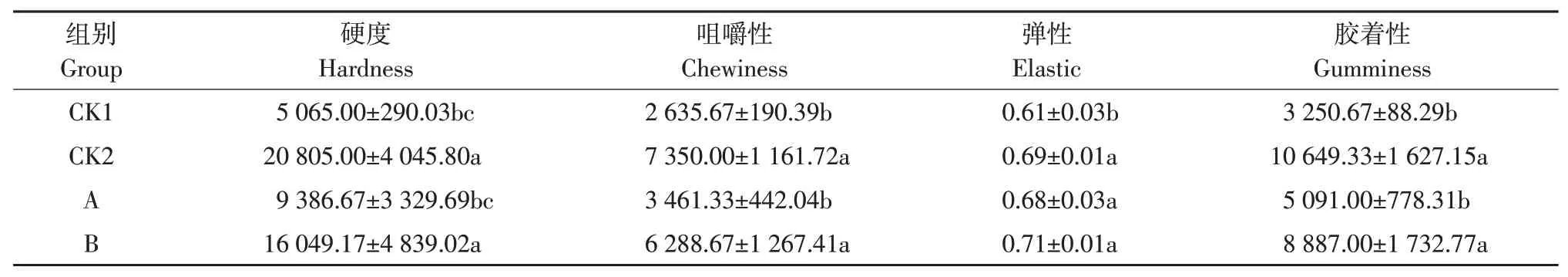
表4 不同发酵香肠质构分析Table 4 Texture analysis of different fermented sausages
2.6 不同发酵香肠pH变化分析
由图4可知,在香肠发酵成熟过程中pH总体呈下降趋势。发酵30 h,CK2、A和B组pH分别降为4.630±0.035、4.907±0.040、5.133±0.045,显著低于自然发酵香肠CK1组(5.593±0.050,P<0.05)。这表明接种发酵剂加快产酸,快速降低香肠pH。
一般来说,pH在48 h内降低到5.3以下即可确保香肠食用安全性,虽然B组香肠pH显著高于A组和CK2组(P<0.05),但在安全范围内。
2.7 不同发酵香肠亚硝酸盐残留量分析
由图5可知,在发酵香肠成熟过程中,添加发酵剂A、B组和CK2组亚硝酸盐残留量均显著低于CK1组。发酵30 h,CK2、A、B组亚硝酸盐残留量分别为0.996±0.100、2.393±0.130和2.906±0.025 mg·kg-1,均低于CK1组,也远远低于国家标准规定30 mg·kg-1。由此可知,接种植物乳杆菌b-2和腐生葡萄球菌sw50有助于降低亚硝酸盐残留量,保证发酵香肠质量安全,Wang等研究结果也表明添加发酵剂可降低发酵香肠中亚硝酸盐残留量[21]。
2.8 不同发酵香肠TBARS值变化分析
脂质稳定对防止食品酸败较重要,硫代巴比妥酸还原值(Thiobarbituric acid reactive substances,TBARS)是反映脂质氧化程度指标之一[20]。各发酵香肠样品TBARS值变化如图6所示。由图6可看出,在各发酵阶段,A、B组TBARS含量均显著低于CK1组和CK2组(P<0.05),发酵30 h,A、B组TBARS值分别为1.44±0.02和1.42±0.05 mg·kg-1,在正常范围(0.6~2.8 mg·kg-1)内[22],而CK1组则超出正常范围,为9.12±1.25 mg·kg-1。A、B两组发酵香肠TBARS值差异不显著(P>0.05)。可见接种植物乳杆菌b-2和腐生葡萄球菌sw50可有效减轻香肠脂质氧化,提高发酵香肠品质,延长货架期。
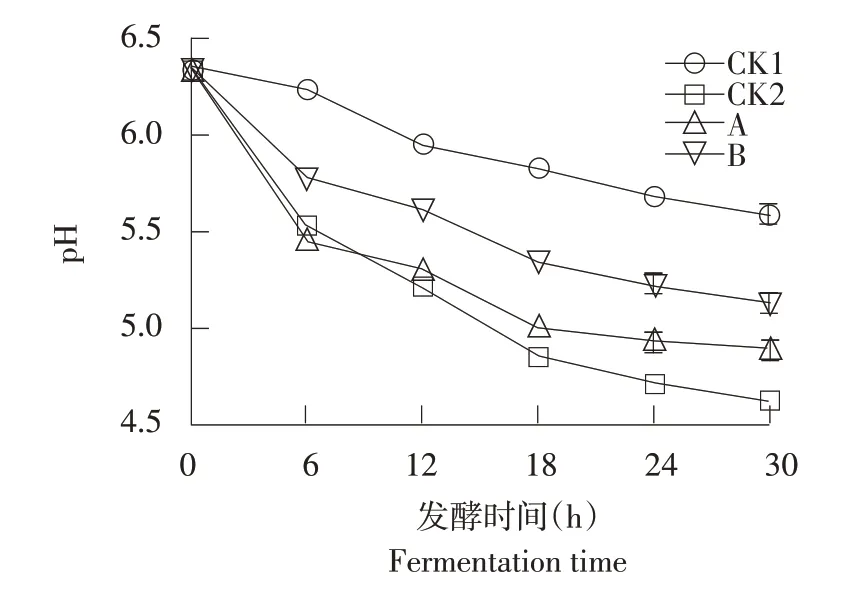
图4 不同发酵香肠pH变化Fig.4 Changes of pH in different fermented sausages

图5 不同发酵香肠亚硝酸盐残留量变化Fig.5 Changes of nitrite residue in different fermented sausages

图6 不同发酵香肠TBARS值变化Fig.6 Changes of TBARS in different fermented sausages
3 讨论
菌群结构与产品品质密切相关。高通量测序分析表明,总体可接受性高B组发酵香肠中优势菌为乳杆菌科细菌和葡萄球菌属细菌。乳杆菌科细菌属于乳酸菌,可产生乳酸降低pH,抑制杂菌生长,影响蛋白凝固,有助于保持良好产品质量[23]。López等研究发现,乳酸菌赋予产品独特发酵风味、改善产品组织结构、促进产品色泽与风味形成[24]。另据报道,某些细菌,尤其是乳酸菌,抑制脂质氧化,原因在于该菌具有较强蛋白水解活性,可释放出具有抗脂质氧化能力活性肽[21,25]。葡萄球菌常存在于发酵肉制品中,可降解蛋白质、脂肪以促进风味物质形成,分解硝酸盐并产生过氧化氢酶,有助于色泽形成[26],凝固酶阴性葡萄球菌(Coagulase-negative staphylococci,CNS)可加速亚硝基肌红蛋白形成,另外CNS具有硝酸还原酶活性可将硝酸盐还原为亚硝酸盐,促进色泽形成并抑制脂质氧化[27]。可见,这两类优势微生物是B组发酵香肠获得优良品质重要保障。据此,可推断发酵香肠中乳酸菌和葡萄球菌促进产品风味、色泽形成,且可抑制脂质氧化,是产品品质和安全重要保障。
接种1∶3植物乳杆菌b-2和腐生葡萄球菌sw50的B组发酵香肠L*值、a*值均显著高于未接种发酵剂CK1组,说明发酵剂添加有助于发酵香肠色泽形成。Essid等研究也发现接种发酵剂香肠显示红色更深[28]。研究表明L.fermentumAS1.1880、L.sakeiC2、L.pentosus(CICC 22226)有助于发酵香肠色泽形成[29],周慧敏等研究则发现添加木糖葡萄球菌和肉葡萄球菌发酵剂对肉制品呈色起辅助作用[15]。
接种植物乳杆菌b-2和腐生葡萄球菌sw50可快速降低pH,抑制杂菌生长,保障发酵香肠质量和安全。不接种发酵剂CK1组,发酵30 h,pH仅降至5.593±0.050,梭菌属、消化链球菌属、沙雷菌属等杂菌甚至是有害菌占比高,造成发酵香肠质量不稳定。
挥发性风味化合物分析表明,接种植物乳杆菌b-2和腐生葡萄球菌sw50发酵香肠乙酸乙酯浓度高,还产生2-甲基丁醛、乙缩醛、3-甲基丁酸乙酯、三甲基吡嗪、戊醛等呈味成分,因此植物乳杆菌b-2和腐生葡萄球菌sw50有望作为生产发酵香肠发酵剂。
由于检测方法、样品性质和数据库限制,部分高通量测序结果注释不到属水平。
4 结论
总体可接受性较高B组发酵香肠优势菌群有乳杆菌科(Lactobacillaceae)细菌和葡萄球菌属(Staphylococcus),其挥发性风味物质有乙酸乙酯、2-甲基丁醛、乙缩醛、3-甲基丁酸乙酯等,具有明显果香味、脂香味、色泽暗红、组织紧密、咀嚼感好、口感好。接种1∶3植物乳杆菌b-2和腐生葡萄球菌sw50可快速降低pH抑制杂菌繁殖,降低亚硝酸盐残留量,抑制脂质氧化,促进色泽及风味物质形成,改善发酵香肠组织结构,提高产品质量和安全水平,适宜作为发酵剂用于发酵香肠生产。
