黄连素促进2型糖尿病大鼠胰高血糖素样肽分泌的分子机制
2021-04-06夏敬胜王倩邹吉利蔡瑜李颖
夏敬胜,王倩,邹吉利,蔡瑜,李颖
(武汉市第三医院药学部,武汉 430060)
2型糖尿病已成为严重危害健康的疾病之一[1-2],其受年龄、遗传、吸烟等多种因素影响[3]。研究发现2型糖尿病与肠道菌群密切相关。肠道内菌群紊乱可导致宿主体质量增加,胰岛素敏感性降低及全身系统性的低度炎症,加速糖尿病发展进程[4-5]。肠道内乳酸杆菌属、双歧杆菌属等菌群能通过产生短链脂肪酸(short-chain fatty acids,SCFAs)以及胆汁酸等自身代谢产物激活短链脂肪酸受体43(short-chain fatty acid receptor 43,GPR43)及G蛋白偶联胆汁酸受体1(G protein-coupled bile acid receptor 1,TGR5),诱导肠激素-胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)分泌[6]。GLP-1也可由前激素转化酶1/3(proconvertase 1/3,PC1/3)切割、转录、修饰胰高血糖素原(proglucagon,GCG)后生成[7]。研究发现GLP-1对β细胞功能有重要调节作用,能抑制β细胞的凋亡,促进β细胞生长及增殖,上调胰岛素的分泌,降低血糖[8-9]。
黄连素是从毛茛科黄连或黄柏根状茎中提取的异喹啉生物碱。临床研究报道,黄连素可用于治疗细菌感染性腹泻,提示黄连素对肠道内致病菌有一定的抑制作用。此外,黄连素具有改善血糖代谢的作用[10-12],但黄连素抗糖尿病的具体作用机制仍不明确。本研究以高糖高脂饮食及注射链脲佐菌素诱导2型糖尿病模型大鼠为研究对象,探究黄连素对GLP-1分泌的影响,为进一步明确黄连素抗糖尿病的分子机制提供理论基础。
1 材料与方法
1.1药品与试剂 黄连素(盐酸小檗碱片)购于成都锦华药业有限责任公司(批号:20180524),链脲佐菌素(streptozotocin,STZ)购于上海金穗生物科技有限公司(批号:20180605),血糖试纸购于罗氏诊断产品上海有限公司(批号:05234450032),利拉鲁肽购于丹麦诺和诺德公司(批号:HP51789),第一链cDNA合成试剂盒购于赛默飞世尔科技有限公司(批号:00705427),DNA marker(批号:S7301)及琼脂糖凝胶DNA回收试剂盒(批号:R6408)均购于北京天根生化科技有限公司,实时荧光定量 PCR 试剂盒购于日本Takara公司(批号:AJ12465A),酶联免疫吸附测定(ELISA)试剂盒GLP-1(批号:20150325)及糖化血红蛋白(批号:20160120)购于南京建成试剂有限公司,核因子κB(nuclear factor kappa-B,NF-κB)(批号:GR3210877-1),胰岛素(批号:GR3210143-5)抗体及Rb lgG(HRP)(批号:GR3183284-5)均购于英国Abcam公司。
1.2仪器与设备 IQ5-5515型实时荧光定量实时荧光定量PCR仪(美国Bio-Rad公司),DanoDrop1000型核酸蛋白检测仪(赛默飞有限责任公司),DYY-2C型凝胶电泳仪(北京六一生物科技有限公司)、CA-2000coda型全自动酶标仪(赛默飞有限责任公司),Nikon Eclipse Ti-SR型置荧光显微镜(日本尼康),HH-SH4型恒温水浴锅(金坛市医疗仪器厂)。
1.3动物模型制备及分组 无特定病原体(SPF)级别的SD大鼠(雄性)50只,购买于长沙市天勤生物技术有限公司(许可证:SCXK-2014-0010),体质量为(180±20)g,8周龄。饲养环境为每日12 h光照,温度(23±1)℃,相对湿度(50±5)%。根据随机数字表法将大鼠随机分为5组(每组10只),并适应性饲养1周。参照FUJIEDA等[13]研究方法构建2型糖尿病大鼠模型,正常对照组始终给予普通饲料喂养12周。其他4组先给予高糖高脂饲料(蔗糖20%,猪油10%,蛋黄粉6%,胆盐0.5%,基础饲料63.5%)喂养8周后,再禁食8 h,一次性腹腔注射STZ(30 mg·kg-1)构建2型糖尿病模型鼠。通过尾静脉采血,检测血糖>16.7 mmol·L-1说明造模成功。利拉鲁肽组(阳性药)每天皮下注射利拉鲁肽0.2 mg·kg-1·d-1,持续4周。小剂量、大剂量黄连素组,分别灌胃给予100 mg·kg-1·d-1[14]及200 mg·kg-1·d-1[15]黄连素,给药容量为1 mL·(100 g)-1,各组连续灌胃4周。
1.4体质量及口服葡萄糖耐量测定 各组大鼠喂养8周,黄连素干预4周,共计12周,所有组从第1周开始至第12周,平均每周称质量3次,记录平均体质量。于第12周末最后一天禁食8 h后,第2天早晨灌胃葡萄糖溶液2 g·kg-1,并在不同时间段(灌胃葡萄糖溶液后0,30,60,90,120 min)取尾静脉血,血糖仪检测血糖值后,计算曲线下面积(area under curve,AUC)。
1.5糖化血红蛋白及GLP-1含量检测 各组大鼠在黄连素干预4周后,使用2 g·kg-1葡萄糖溶液灌胃,并通过腹腔注射氯胺酮和地西泮麻醉后,腹主动脉取血。根据南京建成试剂盒ELISA说明书操作,检测血清中糖化血红蛋白(glycosylated hemoglobin,HbA1c)及GLP-1含量。
1.6苏木精-伊红(HE)染色观察胰腺形态 取大鼠胰腺组织,置于4%多聚甲醛浸泡24 h,石蜡包埋,组织切薄片3~4 μm。将组织切片置于70 ℃恒温箱2 h脱蜡后,分别放入不同梯度乙醇溶液5 min,纯化水3 min,晾片,苏木精染色10 min,纯化水洗1 min,盐酸乙醇分化,自来水洗5 min,磷酸盐缓冲液(PBS)反蓝,再放入不同浓度乙醇浸泡5 min,晾片,封片,显微镜下观察组织形态。
1.7免疫组化检测胰腺组织胰岛素以及NF-κB表达 取大鼠胰腺组织,方法同“1.6”项,将组织置于不同浓度乙醇溶液中后,晾片,加入胰岛素(1:1 000)以及NF-κB(1:500)工作液,放入4 ℃冰箱孵育过夜,第2天取出后洗片,加入二抗室温孵育0.5 h,洗片,显色后,苏木素染色,盐酸乙醇反蓝,晾片、封片,在倒置显微镜下观察组织形态拍片。使用Image-Pro Plus 6.0版软件选取相同的棕黄色作为判断所有照片阳性的统一标准,分析得出组织表达阳性的累积吸光度值(A)。
1.8粪便中DNA提取及纯度检测 在黄连素干预的第4周末最后一天,代谢笼收集各组鼠粪便,并根据粪便DNA提取试剂盒说明书提取粪便DNA。通过DanoDroP1000核酸蛋白仪检测DNA浓度与纯度,DNA样品的A260/A280比值为1.6~1.8(纯度较高,没有污染),继续后续实验。
1.9目标菌的标准品配置及含量检测 目标菌的引物序列(生工生物有限公司合成),经过预变性95 ℃ 3 min,变性95 ℃ 30 s,退火根据各引物条件设置,30 s,延伸72 ℃ 30 s,34个循环。PCR扩增后,进行凝胶电泳、摄像,使用琼脂糖凝胶试剂盒回收DNA产物后,将原样本按照10倍梯度稀释,浓度为1~108拷贝·μL-1作为模板,回收率80%~130%,斜率R值>0.98。将各菌的标准曲线及样本同时进行Q-PCR扩增,并根据试剂盒操作说明书,设置反应条件为95 ℃ 3 min,变性95 ℃ 30 s,根据各引物扩增条件设置退火温度,30 s,延伸72 ℃ 30 s,共40个循环。各菌的引物序列为:梭杆菌属Forward 5′-GTATGTCRCAAGCGTTATCC-3′,Reverse 5′-CGAACAGGATTAGATACCC-3′;乳杆菌属Forward 5′-AGCAGTAGGGAATCTTCCA-3′,Reverse 5′-CACCGCTACACATGGAG-3′;双歧杆菌属Forward 5′-GTCAGCTCGTGTCGTGAG-3′,Reverse 5′-GTCGCATCCCGTTGTACC-3′;总菌Forward 5′-TCCTACGGGAGGCAGCAGT-3′,Reverse 5′-GACTACCAGGGTATCTAATCCTGTT-3′。
1.10荧光定量PCR法检测结肠GCG、PC1/3等基因 取各组鼠结肠组织,按照RNA提取步骤操作后,将产物按照第一链cDNA合成试剂盒逆转录,使用Q-PCR仪检测样本CT值。结果采用ΔΔCT法:A=CT(目的基因,待测样本)-CT(内标基因,待测样本),B=CT(目的基因,对照样本)-CT(内标基因,对照样本),K=A-B,表达倍数=2-K。引物序列为:β-actin:Forward 5′-TGCTATGTTGCCCTAGACTTCG-3′,Reverse 5′-GTTGGCATAGAGGTCTTTACGG-3′;胰高血糖素样肽-1受体(glucagon-like peptide-1 receptor,GLP-1R):Forward 5′-TCTCTAGGCTGCCGACTGGT-3′,Reverse 5′-CTCCGAGAACACCGAGAAGG-3′;GCG:Forward 5′-ACCGCCCTGAGATTACTTTTCTG-3′,Reverse 5′-AGTTCTCTTTCCAGGTTCACCAC-3′;PC1/3:Forward 5′-GGTACCCAAAAACTCCAGCA-3′,Reverse 5′-GGCTTGTTGAGCTTTTCCAG-3′;GPR43:Forward 5′-CTGGCACAGTTCCTTGATCCTCAC-3′,Reverse 5′-GGCAGCAGCAGCAACAGGAG-3′;TGR5:Forward 5′-GCCTGATGCTCATCGCCAACC-3′,Reverse 5′-GGAAGAAGCAGCCAGCAGGTG-3′。
1.11Western blotting检测结肠GLP-1蛋白表达 取结肠组织,按说明书比例加入蛋白裂解液,充分匀浆,4 ℃条件下静置30 min,15 000 r·min-1离心10 min(离心半径12 cm),取上清液并按试剂盒说明书测定蛋白浓度。取蛋白50 μg进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electropheresis,SDS-PAGE),转至聚偏氟乙烯(polyvinylidene difluoride,PVDF)(湿转),5%脱脂奶粉封闭1 h,一抗兔抗鼠GLP-1(Abcam,1:1 000)及兔抗鼠β-actin(Abcam,1:1 000)孵育过夜,TBST洗3次,每次10 min,二抗羊抗兔(Abcam,1:1000)孵育1 h,TBST洗3次,每次15 min,用增强化学发光试剂盒(efficient chemiluminescence kit,ECL)显色曝光。

2 结果
2.1黄连素对体质量、口服葡萄糖耐量、HbA1c的影响 如图1A所示。与正常对照组比较,模型对照组在STZ干预2周后体质量呈下降趋势,但差异无统计学意义(P>0.05)。与模型对照组比较,小剂量、大剂量黄连素组体质量无显著变化(P>0.05)。各组鼠口服灌胃给予2 g·kg-1葡萄糖溶液后,葡萄糖曲线下面积(AUC)能反映口服糖耐量能力(Oral glucose tolerance,OGTT)。如图1B及1C所示,与正常对照组比较,模型对照组血糖值以及AUC明显增加(P<0.01),而小剂量、大剂量黄连素组明显减少AUC(P<0.05,P<0.01),且小剂量、大剂量黄连素组分别在60及120 min降低血糖(P<0.05),说明黄连素能显著改善糖尿病大鼠口服葡萄糖耐受能力。如图1D所示,与正常对照组比较,模型对照组HbA1c含量显著增加(P<0.01)。与模型对照组比较,小剂量、大剂量黄连素组显著降低HbA1c含量(P<0.05,P<0.01),说明黄连素对糖尿病大鼠血糖控制良好。

①与正常对照组比较,P<0.01;②与模型对照组比较,P<0.05;③与模型对照组比较,P<0.01。
2.2粪便中各菌群引物特异性的鉴定 使用2.0%琼脂糖凝胶电泳验证目标菌群的引物特异性,并使用50 bp DNA及100 bp DNA ladder标记扩增产物分子,如图2所示,扩增产物中目标菌群的扩增条带清晰明亮,且未见非特异性扩增条带,说明目标菌群的引物特异性良好。

A.总菌;B.梭杆菌属;C.乳酸杆菌属;D.双歧杆菌属。
2.3黄连素对总菌、梭杆菌属、乳酸杆菌属及双歧杆菌属的影响 如图3A-D所示,与正常对照组比较,模型对照组鼠的梭杆菌属、乳酸杆菌属及双歧杆菌属含量明显减少(P<0.01),但总菌的含量无变化(P>0.05)。与模型对照组比较,小剂量、大剂量黄连素组明显增加梭杆菌属以及乳酸杆菌属含量(P<0.05),但对总菌以及双歧杆菌属的含量无影响(P>0.05)。
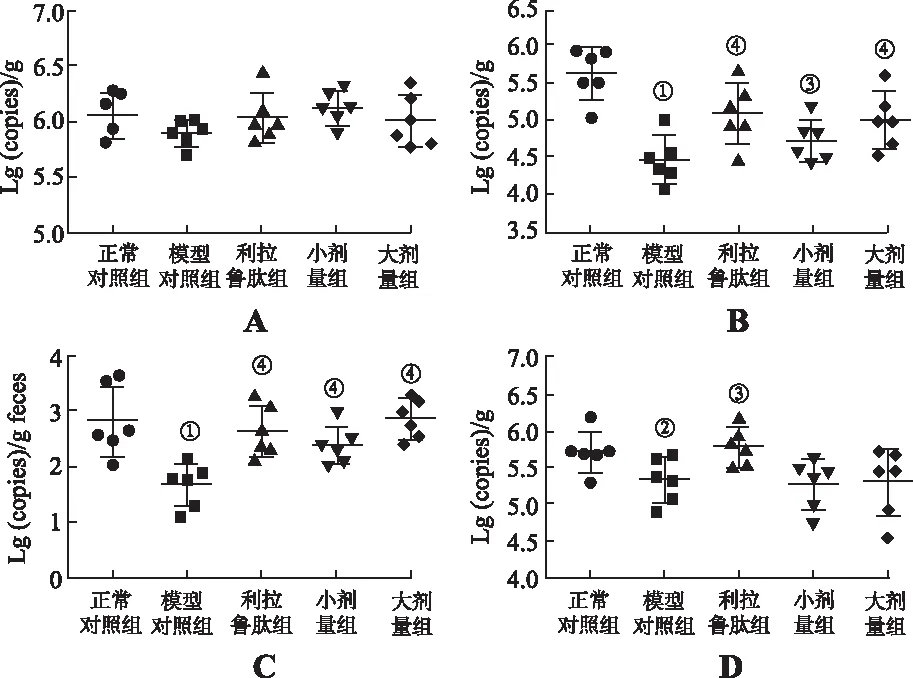
A.总菌;B.梭杆菌属;C.乳酸杆菌属;D.双歧杆菌属;①与正常对照组比较,P<0.01;②与正常对照组比较,P<0.05;③与模型对照组比较,P<0.05;④与模型对照组比较,P<0.01。
2.4黄连素对糖尿病大鼠胰腺组织的影响 如图4所示,正常对照组大鼠胰腺组织结构正常,胰岛内细胞大小均一,胰岛形状规则。模型对照组大鼠胰岛组织形态结构明显异常,胰岛萎缩,岛内细胞数量明显减少,胰岛内出现明显的空泡。与模型对照组比较,低、大剂量黄连素显著增加胰岛内细胞数量,抑制胰岛组织皱缩,改善胰岛形态。
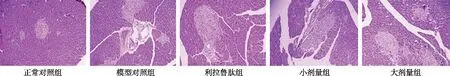
图4 黄连素对糖尿病大鼠胰腺组织影响(×100)
2.5黄连素对糖尿病大鼠胰腺组织胰岛素的表达影响 如图5所示,与正常对照组比较,模型对照组胰岛组织形态明显异常,且胰岛素表达明显减少(P<0.01)。与模型对照组比较,小剂量、大剂量黄连素组明显改善胰岛形态,增加糖尿病大鼠胰岛素的表达(P<0.01,P<0.05)。

①与正常对照组比较,P<0.01;②与模型对照组比较,P<0.05;③与模型对照组比较,P<0.01。
2.6黄连素对糖尿病鼠胰腺组织NF-κB表达影响 如图6所示,与正常对照组比较,模型对照组胰岛组织形态明显异常,NF-κB表达显著增加(P<0.01)。与模型对照组比较,小剂量、大剂量黄连素组显著改善胰岛形态,减少NF-κB蛋白表达(P<0.01)。

①与正常对照组比较,P<0.01;②与模型对照组比较,P<0.01。
2.7黄连素对GPR43、TGR5、GCG及PC1/3 mRNA 表达影响 如图7所示,与正常对照组比较,模型对照组结肠组织GPR43、TGR5、GCG及PC1/3 mRNA 表达显著减少(P<0.01)。与模型对照组比较,小剂量、大剂量黄连素组显著增加糖尿病大鼠GPR43、TGR5、GCG及PC1/3 mRNA表达(P<0.01)。
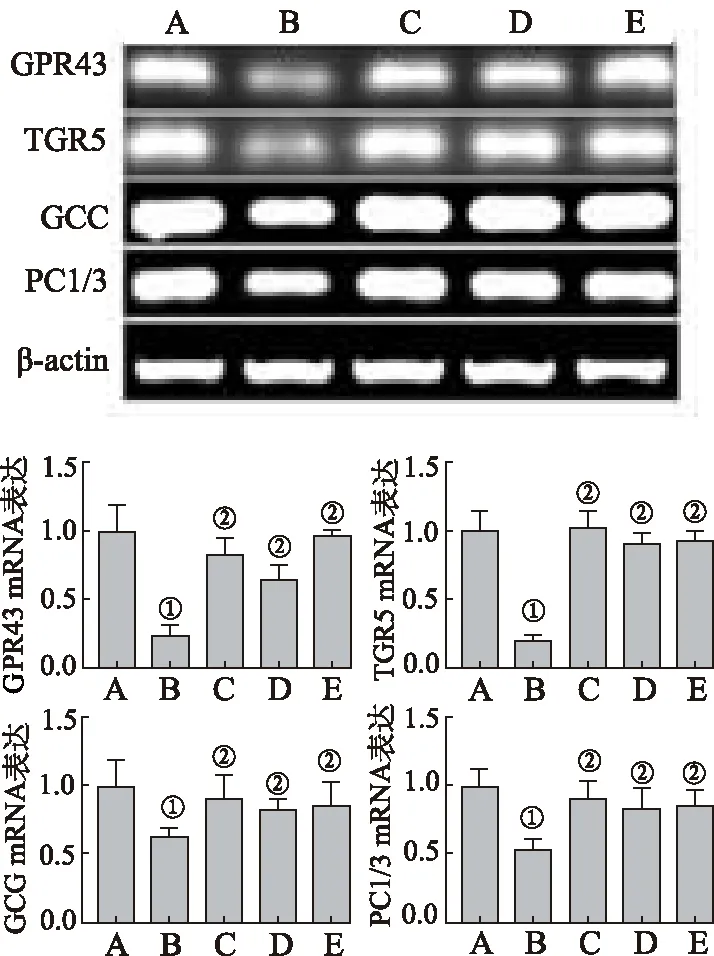
A.正常对照组;B.模型对照组;C.利拉鲁肽组;D.小剂量组;E.大剂量组;①与正常对照组比较,P<0.01;②与模型对照组比较,P<0.01。
2.8黄连素对糖尿病鼠GLP-1的影响 如图8所示,与正常对照组比较,模型对照组血清中GLP-1含量、结肠组织GLP-1R mRNA及GLP-1蛋白表达显著减少(P<0.01)。与模型对照组比较,小剂量、大剂量黄连素组显著增加糖尿病大鼠血清GLP-1含量、GLP-1R mRNA及GLP-1蛋白表达(P<0.05)。

A.正常对照组;B.模型对照组;C.利拉鲁肽组;D.小剂量组;E.大剂量组;①与正常对照组比较,P<0.01;②与模型对照组比较,P<0.05;③与模型对照组比较,P<0.01。
3 讨论
2型糖尿病是一种以高血糖为特征,胰岛素相对缺乏或胰岛素抵抗为主的代谢紊乱性疾病。长期血糖控制不佳是导致糖尿病患者各种并发症以及生活质量降低的主要原因,因此控制血糖是糖尿病治疗的关键目标[16]。口服葡萄糖耐受能力能反映餐后血糖的控制情况,HbA1c能反映2~3个月血糖的控制情况。在本研究中,小剂量及大剂量黄连素组显著改善糖尿病大鼠口服葡萄糖耐受能力,降低HbA1c含量,说明黄连素对糖尿病大鼠血糖的控制情况良好。
研究表明,与正常人比较,2型糖尿病患者血清内GLP-1含量明显减少,并伴有胰岛素分泌能力降低,口服葡萄糖耐受能力受损情况[17]。部分糖尿病患者受益于外源性胰岛素的补充或者通过促进内源性胰岛素的产生,改善糖脂代谢。GLP-1是一种重要的肠道激素,具有葡萄糖依赖性促进胰岛素分泌,改善胰岛功能的作用。研究报道GLP-1能通过与胰岛β细胞的跨膜受体结合,激活环腺苷酸/蛋白激酶A(cyclic adenosine monophosphate/protein kinase A,cAMP/PKA)途径,促进胰岛β细胞分泌胰岛素,同时减少胰岛α细胞中胰高血糖素的分泌,抑制食欲,调控血糖[18]。此外,GLP-1还能抑制β细胞的凋亡,促进β细胞增殖及生长,改善胰岛细胞功能[19]。本研究中黄连素明显促进GLP-1分泌,改善糖尿病大鼠胰腺组织形态,抑制炎症因子NF-κB表达,促进胰岛素分泌,提示黄连素可能是通过增加GLP-1的分泌,改善胰岛功能,促进胰岛素的分泌而发挥降血糖作用。
研究表明GLP-1的分泌与肠道菌群密切相关,GLP-1能通过产短链脂肪酸菌群-SCFAs-GLP-1信号通路以及肠道菌群-TGR5-GLP-1信号通路调控生成[20]。WOLDEAMLAK等[21]报道,与健康人比较,糖尿病患者肠道内菌群多样性、菌落丰度、种类及数量明显减少,以典型的大肠埃希菌等革兰阴性菌增加,乳酸杆菌、梭杆菌属等产短链脂肪酸菌群减少为主。梭杆菌属、乳杆菌属及双歧杆菌属是肠道内有益菌,也被称为产短链脂肪酸菌群,这些菌能通过代谢、发酵碳水化合物、纤维素等物质,生成乙酸、丙酸、丁酸等短链脂肪酸(SCFAs)[22-23]。SCFAs既是机体的能源物质,也是G蛋白偶联受体的天然配体,其能通过激活肠L细胞的GPR43促进GLP-1分泌,改善血糖的调控[24-25]。研究报道,肠道内乳酸杆菌属、双歧杆菌属、普氏菌属等产短链脂肪酸菌群,能通过自身代谢产物乙酸、丙酸、丁酸激活GPR43,促进GLP-1分泌,改善糖尿病大鼠的血糖代谢[26-27]。在本研究中,与模型对照组比较,小剂量、大剂量黄连素组结肠GPR43 mRNA表达显著增加,提示黄连素可能是通过激活GPR43活性诱导结肠GLP-1分泌,这可能与乳酸杆菌属及梭杆菌属的代谢产物SCFAs上调GPR43活性有关。
此外,乳酸杆菌属及双歧杆菌属的代谢物除短链脂肪酸外,还包括胆汁酸及各种次级胆汁酸[6]。胆汁酸能通过激活法尼类X受体(farnesoid X receptor,FXR)及下游TGR5活性,上调GLP-1的分泌,调节脂质、葡萄糖和能量稳态[28]。肠道来源的GLP-1可由PC1/3对GCG进行剪切、修饰后生成GLP-1[17]。SANCHO等[29]报道,在高血糖、高血脂或炎症条件下,胰岛α细胞能通过增加PC1/3基因表达激活GLP-1分泌,这可能有助于抑制高糖及高脂类物质对胰岛α及β细胞的损害。MORIMOTO等[30]发现,胆汁酸能通过上调TGR5活性,促进GCG及PC1/3基因表达,诱导GLP-1分泌。PATHAK等[28]报道,FXR激动剂能通过增加肠内胆汁酸菌群,激活肠TGR5活性,刺激肠L细胞分泌GLP-1,改善肝糖脂代谢。本研究与这些报道一致,在本研究中,黄连素显著增加结肠TGR5、PC1/3、CGC基因表达,提示黄连素可能通过激活TGR5活性,上调PC1/3及GCG基因的表达,诱导GLP-1分泌,这可能与乳酸杆菌属的代谢产物胆汁酸激活TGR5活性有关。
本研究初步探究黄连素对GLP-1分泌的影响,发现黄连素能通过激活GPR43及TGR5活性,上调GCG及PC1/3基因表达,促进GLP-1分泌,其可能是依赖于肠道菌群的代谢产物短链脂肪酸以及胆汁酸的作用。由于肠道内菌群丰富,种类繁多,且结构复杂,肠道内菌群的代谢产物更加丰富多样,而本研究仅对目标菌群进行检测,因此对菌群及其代谢产物的分析存在一定的局限性。今后本研究还将继续使用基因测序方法对肠道内菌群丰度、结构及功能进行预测及分析,或利用靶向代谢组学方法检测肠道菌群代谢产物SCFAs、胆汁酸含量以明确黄连素对菌群的结构及菌群代谢产物之间的关系,为阐明黄连素的抗糖尿病分子机制奠定一定的理论基础。
