水浴法测定饲用植酸酶耐热性方法的研究
2021-04-03王华明
邵 静,于 靖,王 蕊,张 帅,王华明
(1.潍坊康地恩生物科技有限公司青岛分公司,山东青岛 266100;2.潍坊康地恩生物科技有限公司,山东潍坊 261500;3.青岛蔚蓝生物集团有限公司,山东青岛 266100)
植酸酶能够水解植酸或植酸钠中的磷酸基团,最终生成无机磷和肌醇。植酸酶添加于畜禽饲料中,能够有效提高有机磷利用率,降低无机磷的添加比例,既可降低饲料成本,又可减少畜禽养殖中污染物的排放。因此,植酸酶已经成为必不可少的饲料组分,在饲料行业中广泛应用[1-3]。植酸酶添加到饲料中需要经过高温制粒等加工过程,耐高温性能是评定植酸酶的重要指标。国内外科研机构不断筛选和改造植酸酶生产菌种,研究植酸酶耐热机制、获得耐热性更高的植酸酶[4-8]。因此,稳定的耐热性评价方法对于筛选工作的开展也尤为重要。目前,饲料和酶制剂行业对植酸酶耐高温性能评价的主要方法有水浴法、干热法和湿热法[9-13]。其中,水浴法具有操作简单、重复性好等特点,是筛选、评价耐高温植酸酶通用的方法。但是,植酸酶是一种具有生物催化活性的酶蛋白,水浴法测定耐热性的结果容易受到多种因素的影响。本试验从水浴耐热性处理的pH值、酶浓度、缓冲体系等方面对植酸酶耐热性评价方法进行研究,旨在制定更加稳定的植酸酶耐热性评价标准,为酶制剂生产、应用企业制定植酸酶耐热性评价标准提供参考。
1 材料与方法
1.1 试验材料
植酸酶A、B、C、D、E、F、H、J、K 购自国内外酶制剂生产厂家;植酸钠购自罗定市宝日植酸钠有限公司。
1.2 试验试剂
缓冲液Ⅰ为0.25 mol/L 乙酸-乙酸钠缓冲液,pH值5.5。缓冲液Ⅱ为0.25 mol/L乙酸-乙酸钠缓冲液,含有0.5 g/L 牛血清白蛋白、0.5 g/L 曲拉通X-100,pH 值5.5。耐热稀释缓冲液用于耐热试验中植酸酶的浸提和稀释,酶溶解在该缓冲体系中进行耐热性处理。
1.3 仪器设备
BSA224S-CW 分析天平(德国赛多利斯)、DK-98-Ⅱ-双列四孔恒温水浴锅(天津泰斯特仪器有限公司)、V-1800可见分光光度计(上海美谱达仪器有限公司)。
1.4 试验方法
植酸酶酶活力检测依据《GB/T 18634—2009饲用植酸酶活性的测定分光光度法》。以植酸钠为底物,在37 ℃、pH值5.5条件下,酶与底物反应30 min,在酸性终止液中,产物无机磷与钒钼酸铵生成黄色复合物,415 nm波长下测定吸光度。植酸酶酶活力定义为:每分钟水解植酸钠生成1 μmol无机磷的酶量定义为一个单位,以U表示。
植酸酶经过多年的菌种开发与优化,目前市售耐高温植酸酶耐热水平普遍较高,本研究中水浴耐热性评价选择水浴温度为80 ℃和85 ℃。

式中:U为样品水浴处理后酶活力;U0为样品水浴处理前酶活力。
1.4.1 酶浓度对水浴法测定植酸酶耐热性的影响
首先测定植酸酶A、B、C、D、E、F 的酶活力,根据初始酶活力,将样品稀释不同倍数使植酸酶酶活力为400、200、100、20 U/mL,作为待处理酶液备用。
以缓冲液Ⅰ为耐热稀释缓冲液,取4.5 mL耐热稀释缓冲液加入15 mm×100 mm 的玻璃试管中,置于80 ℃或85 ℃水浴中预热10 min,加入0.5 mL待处理酶液,此时酶液的最终处理浓度分别为40、20、10、2 U/mL,准确计时5 min,将处理试管取出,立即放于冰水浴中冷却至室温。测定处理前后植酸酶酶活力,并计算耐温率。
1.4.2 不同缓冲体系对水浴法测定植酸酶耐热性的影响
分别选择水、缓冲液Ⅰ、缓冲液Ⅱ为耐热稀释缓冲液,将植酸酶D、E、F 稀释一定倍数,使其酶活为200 U/mL。取4.5 mL相应的耐热稀释缓冲液加入15 mm×100 mm的玻璃试管中,置于80 ℃水浴中预热10 min,加入0.5 mL待处理酶液,准确计时5 min,将处理试管取出,立即放于冰水浴中冷却至室温。测定处理前后植酸酶酶活力,并计算耐温率。
1.4.3 pH值对水浴法测定植酸酶耐热性的影响
选择最适反应pH值不同的3种植酸酶H、J、K,分别使用国家标准GB 18634—2009 缓冲液Ⅰ(pH 值5.5)和蔚蓝标准缓冲液Ⅰ(pH 值5.0)作为耐热稀释缓冲液,浸提并稀释植酸酶至200 U/mL,取4.5 mL 相应的耐热稀释缓冲液加入15 mm×100 mm 的玻璃试管中,放于85 ℃水浴中预热10 min,加入0.5 mL 待处理酶液,准确计时5 min,将处理试管取出,立即放于冰水浴中冷却至室温。测定处理前后植酸酶酶活力,并计算耐温率。
2 结果与分析
2.1 不同处理液酶活对植酸酶耐热性的影响
将酶稀释到不同酶活力浓度,经水浴加热处理后,不同酶制剂所表现的耐热性不同,见表1。
由表1 可知,80 ℃水浴处理时,植酸酶A、B 耐热性较差,耐温率低于50%。此时,随着处理液酶浓度的降低,植酸酶的耐热性明显提高。植酸酶C、D、E耐热性较好,耐温率高于60%,处理液的酶浓度对植酸酶耐热性基本没有影响。
85 ℃水浴处理时,植酸酶A、B、C耐热性较差,其耐热性同样随着处理液酶浓度的降低而升高。植酸酶D、E 耐热性较好,结果不受处理液酶浓度影响。
由此可见,植酸酶水浴耐热性结果受处理液酶浓度的影响,对耐热性较差的酶样品明显。原因可能是由于在高温条件下分子热运动剧烈,分子间相互碰撞更加强烈,当酶蛋白三级结构因受到高温作用而不稳定时,强烈的分子间作用力会增加三级结构的破坏。酶浓度低时,分子间作用力减少,对酶蛋白的三级结构的破坏相对减少。因此,制定水浴法测定植酸酶制剂产品耐热性检测方法时,需要考虑这个因素,在确保处理液酶浓度一致的条件下测定耐热性。
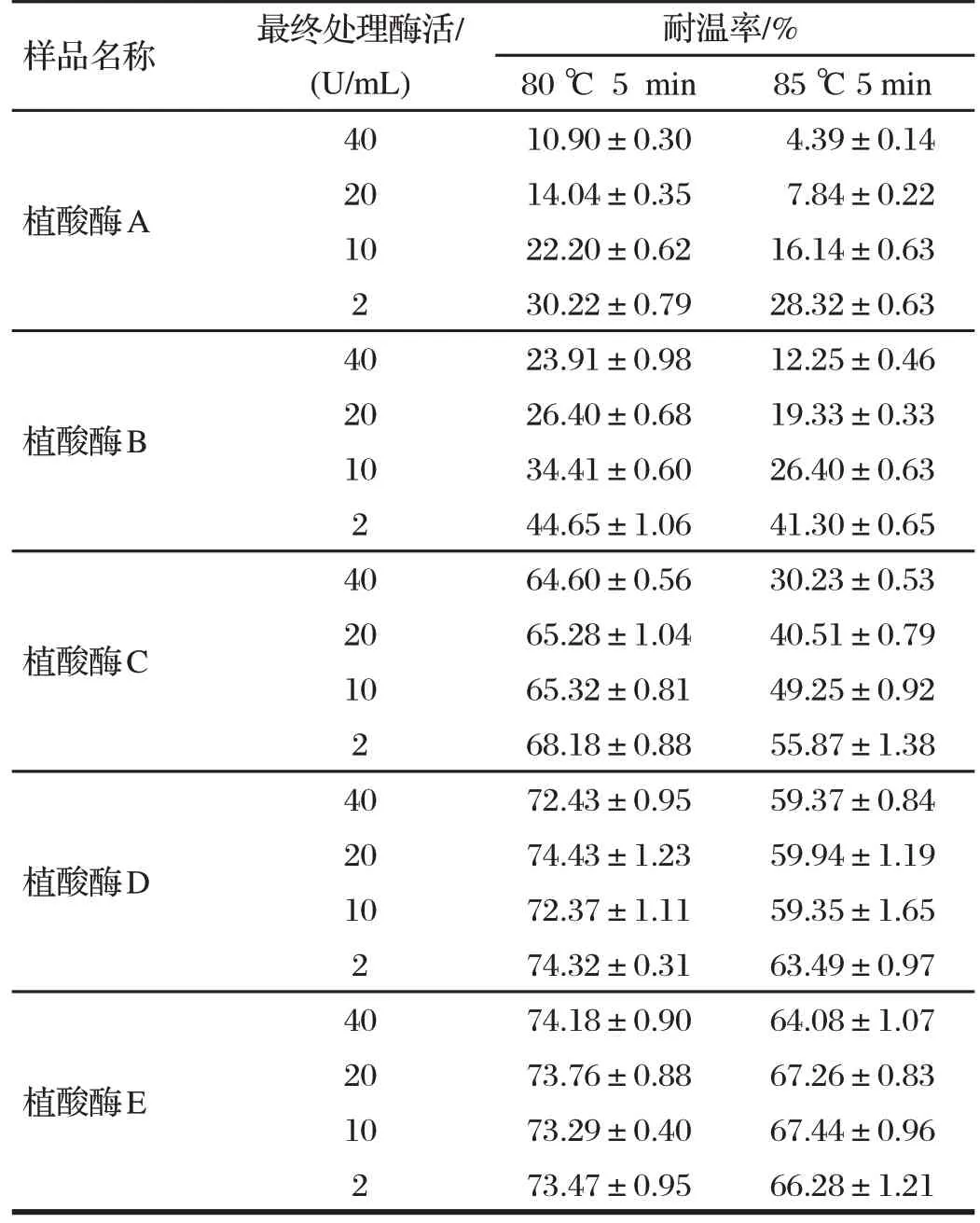
表1 不同处理液酶活对植酸酶耐热性的影响Tab.1 Effect of different dilution on the temperature-resistance of phytase
2.2 不同缓冲体系对水浴法测定植酸酶耐热性的影响
使用不同耐热稀释缓冲液稀释植酸酶,80 ℃水浴处理5 min,结果见表2。
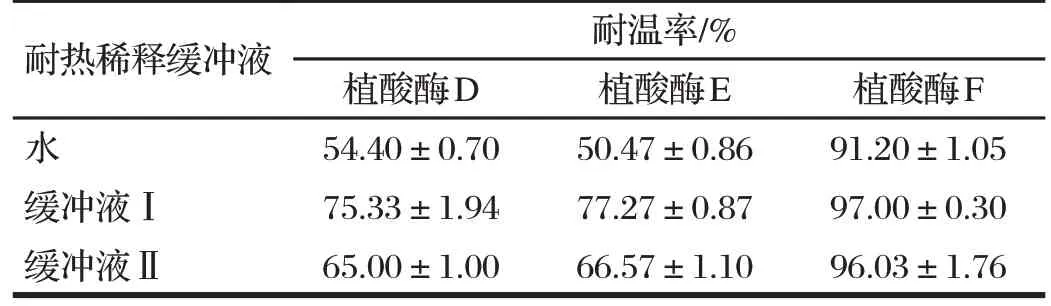
表2 不同缓冲体系对水浴法测定植酸酶耐热性的影响Tab.2 Effect of different buffer systems on the determination of heat resistance of phytase by water bath
由表2 可知,植酸酶D、E、F 耐温率分布在50%~97%之间,以缓冲液Ⅰ作为稀释缓冲液时植酸酶耐热性最好,其次是缓冲液Ⅱ,以水作为稀释缓冲液时的耐热性耐温率最低。推其原因是缓冲液中含有盐离子,能够增强蛋白质的刚性[6],并且能够提供相对稳定的pH 值条件,对酶蛋白具有一定的稳定作用。另一方面,缓冲液Ⅱ含有一定浓度的牛血清白蛋白和曲拉通X-100,这两种物质在测定植酸酶酶活力的时候具有增溶剂的效果,但是在高温水浴处理的时候,高浓度的牛血清白蛋白可能增加分子间相互作用,大量的蛋白分子间相互碰撞增加了植酸酶失活率。因此,在水浴法测定植酸酶耐热性时,建议使用只含有盐的缓冲液Ⅰ作为稀释缓冲液,减少引入其他物质、避免对耐热处理过程产生干扰。
2.3 pH值对水浴法测定植酸酶耐热性的影响
选择最适pH 值不同的3 种植酸酶,在不同pH 值条件下进行水浴耐热性处理,85 ℃处理5 min 测定耐热性,见表3。

表3 pH值对水浴法测定植酸酶耐热性的影响Tab.3 Influence of pH value on the determination of heat resistance of phytase by water bath method
由表3可知,植酸酶H的最适pH值为5.5,其pH值5.5条件下测定耐热性比pH值5.0测定时高约15%;植酸酶J、K 的最适pH 值为4.0~4.5,使用蔚蓝标准pH 值5.0 条件处理时,耐热性比国标条件高10%~20%。
因此,在接近植酸酶最适pH 值条件下进行耐热性处理,测得的耐热性结果一般会相对较高。但是以往对植酸酶的评价中也发现存在部分稳定性好的植酸酶,对pH 值不敏感,在本研究的两种pH 值条件下处理耐热性结果差别不大。
3 结论
本试验结果表明,缓冲体系中酶浓度越低,耐热处理缓冲液中成分越简单,检测到的植酸酶耐热性越高,处理条件在酶的相对稳定的条件时,耐热性结果越高。最适pH 值条件下进行耐热性处理,耐温率相对较高。酶作为一种活性蛋白,酶活力测定就会受到多种成分的干扰,耐热性是在高温抗逆条件下对酶进行处理,检测更容易受到干扰。
除了本研究所测定的3 种条件,比如酶制剂的载体成分、加热处理的时间,处理液的体积、加入处理时所使用试管的规格等因素都会对耐热性结果有一定的影响。作为酶制剂的生产、应用企业,在使用水浴法评价酶制剂热性时,需要制定详细的标准化方法才能保证每次检测获得较好的重复性和平行性。
