鸡源大肠杆菌临床株的分离鉴定及药敏试验
2021-04-03邹导夫吉艺宽李美娣
邹导夫,吉艺宽,李美娣
(梅州职业技术学院,广东梅州 514011)
大肠杆菌(Escherichia coli)学名大肠埃希氏菌,在养鸡业中长期存在,各种日龄的鸡均可感染,其中2~4周龄雏鸡易感性最高,发病时表现为急性败血症状,病死率较高[1-2]。由于耐药菌株的出现,大肠杆菌病已成为养鸡业中的重要挑战[3],其治疗过程中难以针对性用药,增加用药成本,造成不必要的经济损失。
大肠杆菌的血清型较多[4-5],目前无法用疫苗进行预防控制,发病后通常使用抗生素进行治疗。由于长期使用抗生素,大肠杆菌耐药性普遍且耐药谱不断扩大[6-7],导致有效治疗药物日渐减少,增加治疗的难度。本研究通过对广东某养鸡场疑似大肠杆菌致死鸡进行细菌分离鉴定,并进行药敏试验,为该场大肠杆菌病的综合防控提供基础依据。
1 材料与方法
1.1 病料采集
广东博罗地区某养鸡场在30 日龄前后爆发细菌性疾病,出现腹泻症状,每日死亡率约1%。剖检死鸡可见包心、包肝等现象,使用多种抗生素均无效。采集30日龄病死鸡肝脏。
梅州地区某养鸡场40日龄开始出现轻微的拉稀症状。经剖检未见包心、包肝等现象,未用抗生素,采集40日龄病死鸡肝脏。
1.2 试验试剂
麦康凯琼脂培养基、MH 琼脂培养基、LB 肉汤培养基均购自广东环凯微生物科技有限公司;药敏片红霉素(15 μg/片)、青霉素(10 u/片)、氨苄西林(10 μg/片)、头孢唑林(30 μg/片)、庆大霉素(10 μg/片)、诺氟沙星(10 μg/片)、环丙沙 星(5 μg/片)、复 方 新 诺 明(23.75 μg/片)、氯 霉 素(30 μg/片)、丁胺卡那霉素(30 μg/片)购自杭州微生物试剂有限公司。
1.3 仪器设备
SW-CJ-2F超净工作台(苏州真田洁净设备有限公司)、SYQ-DSX-280A高压蒸汽灭菌锅(上海申安医疗器械厂)、THZ-92B恒温震荡摇床(上海博迅医疗生物仪器股份有限公司)、CX21 双目显微镜[奥林巴斯(中国)有限公司]、HPX-9272MBE恒温培养箱(上海博迅实业有限公司)、101-3鼓风干燥箱(上海苏进仪器设备厂)、TGL-16G离心机(上海安亭科学仪器厂)、Life Express PCR扩增仪(杭州博日基因扩增仪)、DYY-6C电泳仪(北京六一生物科技有限公司)。
1.4 大肠杆菌的分离纯化
1.4.1 分离培养
新鲜肝脏在火焰上消毒,用无菌接种针插入肝脏,划线接种于麦康凯琼脂培养基中,于(36±1)℃培养18~24 h,根据大肠杆菌在麦康凯上的生长特性,挑取单个粉红色可疑单菌落继续划线于麦康凯琼脂培养基中纯化培养。
1.4.2 革兰氏染色镜检
将疑似菌株进行革兰氏染色镜检,于显微镜下观察细菌的形态。
1.5 分子生物学鉴定
1.5.1 引物设计与合成
参考毛福超等[8]设计大肠杆菌特异性扩增引物进行合成,其上游引物序列为:EC370-F:5'-GATAAG CCCGCAGTCACCT-3',下游引物序列为:EC370-R:5'-TCCCGTAACTCATCACCATCA-3',预计扩增片段大小为370 bp。引物由生工生物工程(上海)股份有限公司合成。
1.5.2 可疑菌株DNA提取
挑取经镜检的可疑菌落,接种于LB 肉汤中,于(36±1)℃震荡培养18~24 h得出新鲜菌体培养物,以大肠杆菌44102 株做阳性对照,无菌水作阴性对照,进行DNA提取。提取步骤:吸取1 mL菌液于1.5 mL无菌离心管中,以12 000 r/min 离心1 min,弃去上清液,用无菌去离子水反复洗涤2 次,后100 μL 无菌水重悬,置于沸水浴中煮沸20 min,于12 000 r/min离心1 min,取上清液做DNA模板。
1.5.3 PCR扩增和凝胶电泳
参照TaKaRa Premix Taq Version 2.0 使用说明书,将Premix Taq 12.5 μL、DNA 模板1 μL、上游引物1 μL、下游引物1 μL、无菌蒸馏水9.5 μL准确量取加入PCR管中,吹打混匀。各组分充分混匀后,设置PCR扩增反应为:95 ℃预变性5 min、95 ℃变性30 s、61 ℃复性30 s、72 ℃延伸55 s 和72 ℃后延伸10 min,其中95 ℃变性、61 ℃复性和72 ℃延伸设定30个循环。取样品10 μL立刻进行琼脂糖凝胶电泳(电压150 V,电泳时间25 min),在凝胶成像系统读取结果,测序。
1.6 药敏试验
参照常规K-B 药敏纸片扩散法对分离的菌株进行红霉素、青霉素、氨苄西林、头孢唑林、诺氟沙星、环丙沙星、复方新诺明、氯霉素、庆大霉素和丁胺卡那霉素的药敏试验。取大肠杆菌新鲜培养肉汤,调整菌液浓度为1.0×106CFU/mL,用移液枪吸取100 μL 加入LB 琼脂平板,采用无菌玻璃棒涂布均匀,放置5~10 min,待平板水分被完全吸收后,使用镊子取药敏纸片,贴于平板表面,轻轻按压使其贴平,重复2 个平行,置于37 ℃培养18~24 h,观察结果,使用游标卡尺测量抑菌圈大小,并做好记录。结果判断参照SN/T 1944—2016《动物及其制品中细菌耐药性的测定——纸片扩散法》[9]。
2 结果与分析
2.1 细菌的分离培养及镜检结果(见图1、图2)

图1 麦康凯培养基培养结果Fig.1 Culture results of strains on McConnell medium
由图1可知,分离菌株在麦康凯培养基上呈浅红色、菌落中心显桃红色、圆形湿润、表面光滑、边缘整齐、菌落周围麦康凯培养基变成粉红色。
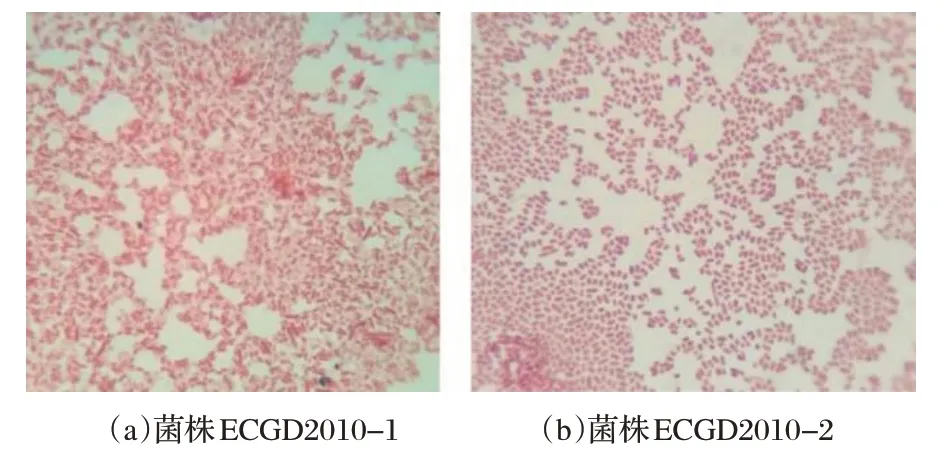
图2 革兰氏染色镜检结果Fig.2 Microscopic examination results of Gram stain
由图2可知,革兰氏染色后,在显微镜下可见菌株为革兰氏阴性菌,呈红色短杆菌,中等大小、两头钝圆,未见荚膜和芽孢,初步分离得到2 株大肠杆菌分离株,并命名为ECGD2010-1和ECGD2010-2株。
2.2 PCR扩增鉴定结果(见图3)
由图3可知,从平板挑取菌落接入肉汤培养基中,经提取菌株DNA作为模板,用大肠杆菌引物进行PCR扩增,扩增产物经1.0%琼脂糖凝胶电泳分析后,与DL5000 DNA Marker 和DL2000 DNA Maker 做比较,发现扩增片段在400~500 bp 之内,与阳性对照所处位置一致,和预期目的片段长度相符,条带单一光亮。经测序后比对结果,显示所分离菌株序列与大肠杆菌的同源性分别为99.0%和98.9%。
2.3 药敏试验结果(见图4)
由图4 可知,ECGD2010-1 菌株对红霉素、青霉素、氨苄西林、头孢唑林、诺氟沙星、环丙沙星、复方新诺明、氯霉素表现为耐药,仅对庆大霉素和丁胺卡那霉素表现为敏感;ECGD2010-2 菌株仅对氨苄西林表现为耐药,对青霉素、诺氟沙星、红霉素、头孢唑林、庆大霉素、环丙沙星、复方新诺明、氯霉素、丁胺卡那霉素均表现为敏感。
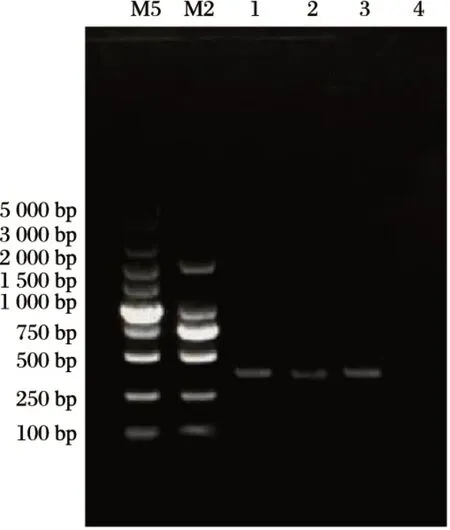
图3 琼脂糖凝胶电泳图Fig.3 Agarose gel electrophoresis

图4 药敏试验结果Fig.4 Drug sensitivity test results of strain
3 讨论
广东省是养禽大省。每年由于大肠杆菌感染导致的经济损失巨大,其中主要是因为大肠杆菌的血清型较多。目前尚未有商品化疫苗上市,无法对其进行预防控制,发病后通常使用抗生素进行治疗。长期大量使用抗生素引起细菌耐药性[10],且耐药谱不断扩大[6-7],导致有效治疗药物日渐减少,从而增加治疗的难度和成本。因此,对大肠杆菌临床流行病学检查及耐药性监测是大肠杆菌病综合防控的关键手段之一。此外,在用药方面,需要通过交叉用药、联合用药等方式,避免耐药性产生,从而达到综合防控的目的。
本试验结果显示,分离自广东博罗地区某鸡场的大肠杆菌菌株对青霉素等均表现为耐药,仅仅对庆大霉素和丁胺卡那霉素敏感,药敏试验结果与主诉结果基本相同。分离自广东梅州地区某鸡场的大肠杆菌菌株仅对氨苄西林表现耐药,而对其他抗生素均表现为敏感。经分离鉴定,在麦康凯琼脂培养基上可见粉红色或者浅粉色圆形菌落,表面光滑,直径1~3 mm,符合大肠杆菌在麦康凯琼脂培养基上的菌落特征。进一步做革兰氏染色镜检鉴定,结果显示为革兰氏阴性菌,呈红色短杆菌,符合大肠杆菌的革兰氏染色特征。经PCR 扩增测序后,扩增出的片段长度在250~500 bp 之间的单一条带,序列在NCBI 基因库上经过同源性比对显示ECGD2010-1 和ECGD2010-2 与大肠杆菌的同源性为99.0%和98.9%,确定所分离出的菌株均为鸡源性大肠杆菌。
4 结论
本试验结果表明,分离自广东博罗地区某养鸡场和梅州地区某养鸡场的菌株为鸡源大肠杆菌,命名为ECGD2010-1 株 和ECGD2010-2 株。ECGD2010-1 对 庆大霉素和丁胺卡那霉素敏感;ECGD2010-2株除对氨苄西林耐药外,对其他抗生素均表现出高度敏感。
