H9N2 AIV 对鸡、鸭和小鼠部分炎性因子和钙调蛋白的影响
2021-04-03马卫红赵福琼刘海繁姚红艳李卫鹏欧德渊
马卫红,赵福琼,刘海繁,姚红艳,李卫鹏,钱 林,欧德渊*
(1.贵州大学动物科学学院,贵州 贵阳 550025;2.惠水县农业农村局,贵州 惠水 550600;3.长顺县农业农村局,贵州 长顺 557000)
禽流感(avian influenza,AI)是由正黏病毒(avian influenza virus,AIV)引起的禽类传染病。根据病毒的毒力不同,分为高致病性和低致病性禽流感[1]。低致病性禽流感(LPAI)能感染禽类,各种日龄的家禽都可发生感染[2],常能引起鸡的炎性损伤[3]。低致病性H9N2AIV 能感染人和多种哺乳动物[4],并引起一定程度的炎性损伤[5]。白细胞介素2(interleukin-2,IL-2)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)在机体的炎症反应和免疫反应起着重要作用。有研究发现,炎症性肠病患者血清TNF-α、IL-2 水平表达上升[6]。IL-2 主要由CD4+细胞、CD8+细胞和NK 细胞产生,对机体细胞免疫和体液免疫均有良好的促进和提升作用,而TNF-α 作为重要的炎症细胞因子,对免疫具有调节作用。史丹丹等[7]研究表明,钙调蛋白(calmodulin,CaM)能参与介导急性骨骼肌炎症反应。CaM可能通过调节细胞内Ca2+的浓度,或者直接参与介导炎症和免疫反应。AIV感染不同种类动物,引起的症状不同,可能跟机体的免疫反应和炎性反应有关。试验通过观察鸡、鸭和小鼠外周血中IL-2 和TNF-α 以及肺组织中CaM的转录和表达情况,了解低致病性H9N2AIV对鸡、鸭和小鼠造成炎性损伤的情况,以期为低致病性禽流感对不同种类动物致病机制提供参考。
1 材料与方法
1.1 试验动物
24 只52 日龄黑羽乌骨鸡和24 只52 日龄樱桃谷肉鸭购自贵阳绿源禽业有限公司。24 只6~8 周龄昆明系小鼠购自贵阳医学院。
1.2 病毒
鸡源H9N2AIV,EID50=10-7.62,由贵州省动物疫病与兽医公共卫生重点实验室保存并馈赠。
1.3 试验试剂
鸡、鸭和小鼠IL-2、TNF-α、CaM ELISA 试剂盒均购自科诺迪生物有限公司;M-MLV反转录酶、TaqDNA聚合酶、SYBR Premix Ex Tap Ⅱ均购自TaKaRa公司。
1.4 试验动物分组及处理
按动物种类将24 只鸡、24 只鸭和24 只小鼠随机分成4组,0、3、6、9 d作为分组标记。0 d作为阴性组,静脉注射0.2 mL PBS,12 h 后采集其外周血和肺组织,3、6、9 d 作为阳性组,参考文献静脉注射0.2 mL H9N2AIV[8],在感染AIV 3、6、9 d后分别采集其外周血和肺组织。
1.5 测定指标及方法
1.5.1 IL-2、TNF-α含量
按照鸡、鸭和小鼠IL-2、TNF-α ELISA 试剂盒说明书进行检测。
1.5.2 CaM mRNA水平
参照GenBank中相关序列和参考文献设计鸡、鸭和小鼠β-actin内参基因及CaM基因引物,见表1。引物均由生工生物工程(上海)股份有限公司合成。用Trizol法提取各组肺组织中的总RNA,转化为cDNA 后进行荧光RT-PCR扩增。扩增体系:SYBR Premix Ex Tap Ⅱ5 μL、模板1 μL、上下游引物各0.5 μL、ddH2O 3 μL。扩增程序:95 ℃预变性30 s;55 ℃退火、延伸30 s,每个循环结束时进行荧光信号检测,共40 个循环,反应结束后温度降到65 ℃,再以0.5 ℃、20 s升温至95 ℃并检测荧光信号得到熔解曲线。经荧光检测后得到相应的CT值,根据2-ΔΔCt法计算各组动物CaM的相对表达量。

表1 鸡、鸭和小鼠β-actin内参基因及CaM基因引物Tab.1 The β-actin gene and CaM gene primers in chicken,duck and mice
1.5.3 CaM含量
将鸡、鸭和小鼠肺组织加等量的PBS 研磨后,取上清液-20 ℃冷冻保存,按照CaM ELISA试剂盒说明书进行操作,计算各组动物肺组织中CaM的含量。
1.6 数据统计与分析
试验所得数据采用SPSS 20 软件进行单因素方差分析,应用Duncan's法进行组间数据的多重比较,结果以“平均值±标准误”表示,P<0.01表示差异极显著,P<0.05表示差异显著。
2 结果与分析
2.1 H9N2 AIV 对鸡、鸭和小鼠血清中IL-2 含量的影响(见表2)
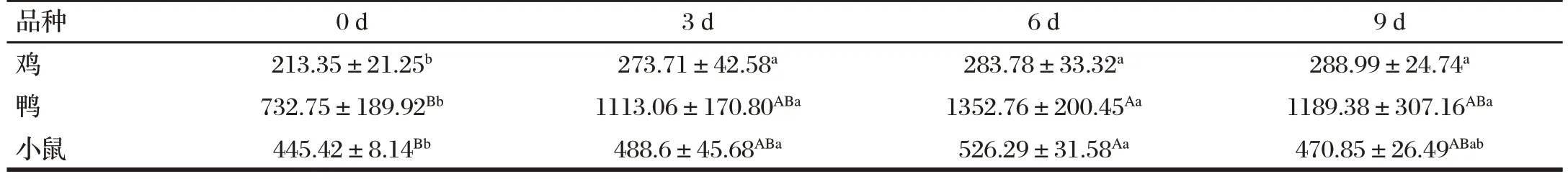
表2 H9N2 AIV对鸡、鸭和小鼠血清中IL-2含量的影响Tab.2 Effect of H9N2 AIV on the serum IL-2 content of chickens,ducks and mice(n=6) 单位:ng/L
由表2可知,与0 d(感染前)比,鸡的IL-2浓度在感染H9N2AIV 3、6、9 d后均显著升高(P<0.05);鸭的IL-2浓度在感染H9N2AIV 3、9 d后显著升高(P<0.05),6 d后极显著升高(P<0.01);小鼠的IL-2浓度在感染H9N2AIV 3 d后显著升高(P<0.05),6 d后极显著升高(P<0.01)。在感染H9N2AIV前后,鸭的IL-2浓度最高,其次是小鼠,最后是鸡。
2.2 H9N2 AIV 对鸡、鸭和小鼠血清中TNF-α 含量的影响(见表3)
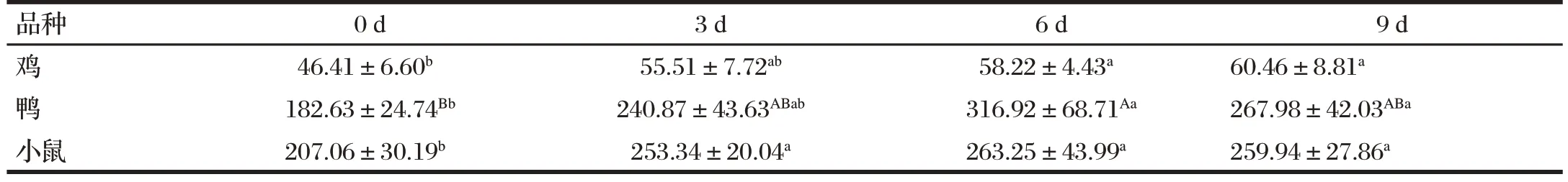
表3 H9N2 AIV对鸡、鸭和小鼠血清中TNF-α含量的影响Tab.3 Effect of H9N2 AIV on the serum TNF-α content of chickens,ducks and mice(n=6) 单位:ng/L
由表3 可知,与0 d(感染前)比,鸡的TNF-α 浓度在感染H9N2AIV 6、9 d 后均显著升高(P<0.05);鸭的TNF-α 浓 度 在 感 染H9N2AIV 6 d 后 极 显 著 升 高(P<0.01),9 d 后显著升高(P<0.05);小鼠的TNF-α 浓度在感染H9N2AIV 3、6、9 d 后显著升高(P<0.05)。在感染H9N2AIV 前后,小鼠的TNF-α 浓度最高,其次是鸭,最后是鸡。
2.3 H9N2 AIV对鸡、鸭和小鼠肺组织CaM的影响
2.3.1 H9N2AIV 对鸡、鸭和小鼠肺组织CaM 转录的影响(见表4)

表4 H9N2 AIV对鸡、鸭和小鼠肺组织CaM转录的影响Tab.4 Effect of H9N2 AIV on CaM transcription in lung tissues of chickens,ducks and mice(n=6)
由表4可知,与0 d(感染前)比,鸡的CaM转录水平在感染H9N2AIV 3、9 d 后显著升高(P<0.05),6 d 后极显著升高(P<0.01);鸭的CaM转录水平在感染H9N2AIV 6 d后显著升高(P<0.05);小鼠的CaM转录水平在感染H9N2AIV 3 d后显著升高(P<0.05),6 d后极显著升高(P<0.01)。在感染H9N2AIV 3、6、9 d后鸡的CaM转录水平均高于鸭和小鼠。
2.3.2 H9N2AIV 对鸡、鸭和小鼠肺组织CaM 含量的影响(见表5)

表5 H9N2 AIV对鸡、鸭和小鼠肺组织CaM含量的影响Tab.5 Effect of H9N2 AIV on the content of CaM in lung tissues of chickens,ducks and mice(n=6) 单位:μg/L
由表5可知,与0 d(感染前)比,鸡的CaM含量在感染H9N2AIV 6 d 后极显著降低(P<0.01),9 d 后显著降低(P<0.05);鸭的CaM含量在感染H9N2AIV 9 d后极显著降低(P<0.01);小鼠的CaM含量在感染H9N2AIV 6 d后极显著降低(P<0.01)。在感染H9N2AIV 3、6、9 d 后,鸡的CaM含量最高,其次是鸭,最后是小鼠。
3 讨论
3.1 H9N2 AIV对鸡、鸭和小鼠IL-2、TNF-α含量的影响
研究表明,禽流感感染患者体内血清细胞因子水平显著升高[9],通常情况下宿主感染AIV 后会立即产生大量的细胞因子,随后启动局部或全身的炎症反应[10]。IL-2可以激活巨噬细胞、淋巴细胞等能产生TNF-α、INF-α和NO细胞因子,增强机体免疫应答,参与机体的炎症反应[11]。IL-2对机体免疫反应具有促进作用[12]。研究发现,人工感染H9N2AIV 后第4 d 鸡脑组织中IL-2 的mRNA 含量极显著上调[13]。而TNF-α作为典型的炎症细胞因子,也是最重要的促炎因子,可以直接参与炎症反应[14-15]。TNF-α适量的表达,有助于激活机体的免疫,但过量表达就会造成炎性损伤,甚至会导致细胞凋亡[16]。在试验中,在感染AIV 3 d 后鸡、鸭和小鼠IL-2 含量均显著升高,6 d 时鸭和小鼠的IL-2 含量极显著升高,而在感染AIV 6d 后鸡和小鼠的TNF-α 含量均显著升高,鸭极显著升高,说明在感染AIV后鸡、鸭和小鼠均发生了免疫反应和炎性反应,在6 d 时3种动物的免疫和炎性反应最为明显,而3种动物相比,鸭的IL-2 和TNF-α 变化最明显,小鼠的IL-2 变化最明显。大量研究结果表明,鸡与鸭的免疫反应基因结构和表达特征具有显著差异,这些差异可能与它们对AIV抵抗力不同相关[17]。而鸭和小鼠在感染AIV 前后,IL-2、TNF-α 浓度均较鸡高,可能鸭和小鼠感染AIV无明显症状与细胞因子参与免疫反应有关。
3.2 H9N2 AIV 对鸡、鸭和小鼠CaM mRNA 的转录水平及含量的影响
CaM在动物机体细胞内能与很多配体相互作用,参与介导炎症反应、代谢、细胞凋亡、肌肉收缩、记忆活动、神经生长及免疫反应等生命活动[18],同时CaM可以直接参与动物机体的炎症和炎性反应[19]。Ca2+被称为是细胞内的第二信使,而CaM可通过调节机体内Ca2+浓度来调节细胞的功能[20]。若发生细胞内Ca2+超载、Ca2+分布紊乱,就有可能引起细胞毒性,导致细胞的死亡[21]。在细胞凋亡和自噬过程中,Ca2+引起的依赖信号转导机制涉及不同的CaM调控系统[22],而自噬过程可以通过Akt-mTOR、MAPK 和NF-κB信号等通路参与H9N2AIV 诱导的急性肺损伤[23]。感染AIV 后,鸡、鸭和小鼠的CaM 的转录水平显著上调,在6 d时达到最大值,这与其炎性反应是一致的。但鸡和小鼠在感染AIV 后6 d的CaM 表达量却极显著下降,而鸭在感染后9 d CaM表达量极显著下降,CaM可能参与炎性反应的初始阶段,对炎性反应有促进作用,或许是直接参与炎性反应,所以导致CaM 的转录水平显著升高。H9N2AIV 感染可抑制鸡的免疫应答,其中对细胞免疫应答的抑制更为明显[24],所以对CaM 的表达有抑制作用,可能通过抑制CaM 的表达来减轻机体的免疫反应,但AIV 如何影响CaM mRNA 的转录和CaM 的蛋白表达,其机制还有待进一步探讨。
4 结论
本研究表明,鸭和小鼠外周血IL-2、TNF-α 含量在感染前后均比鸡高,而鸭和小鼠肺的炎性损伤也较鸡轻,说明AIV 造成的炎性损伤可能与IL-2、TNF-α 含量有关。感染AIV后,CaM在3种动物肺组织中的转录水平显著升高,但其在肺组织中的含量下降,说明CaM 在AIV 造成的肺组织炎性损伤中可能起重要作用,但AIV对CaM的表达有抑制作用,具体机制还需要进一步研究。
