日本血吸虫平衡型核苷转运蛋白3基因(SjENT3)的RNA干扰研究
2021-04-02吴洛滨任雨琪秦芳林刘金明金亚美
吴洛滨,任雨琪,秦芳林,刘金明,金亚美
(1.上海师范大学 生命科学学院, 上海 200234; 2.中国农业科学院 上海兽医研究所 农业部动物寄生虫学重点实验室, 上海 200241)
血吸虫病是由血吸虫感染引起的一种仅次于疟疾的常见热带寄生虫病,常发于中东,南美和东南亚部分地区,尤其是在撒哈拉以南的非洲地区发病率很高[1];据保守估计,至2018年全世界仍至少有2.3亿人感染血吸虫[2].目前治疗血吸虫病主要是应用化学药品,如使用吡喹酮对感染血吸虫病的个体进行治疗,可取得良好的治疗效果[3],但化学药物治疗不能预防再次感染,且化疗药物的大量广泛使用可能导致耐药性虫株的出现[4].
血吸虫虫体线性,雌雄异体,雌虫所产大量虫卵不仅会造成宿主严重的病理损害,排出体外也会造成疾病的再传播[5].在血吸虫的正常发育过程中,雌虫的生殖发育需要与雄虫的持续合抱,来自雄虫的刺激对雌虫的发育与保持雌虫的繁殖能力必不可少.单性感染的雌虫处于生殖系统不完善的发育阻遏状态,两性感染的合抱雌虫一旦与雄虫分开,也会出现个体逐渐变小,生殖器官退化等现象.血吸虫雄虫通过一种非精子传递的方式调控着雌虫的生长发育,但其影响雌虫生长发育的具体机理尚不清楚[6].
实验室前期对单性感染和两性感染雄虫的蛋白质组比较研究发现日本血吸虫平衡型核苷转运蛋白3(SjENT3)在18,21,23,25d 4个检测时间点合抱雄虫体内的表达皆高于其在单性感染雄虫体内的表达,推测该蛋白可能会与血吸虫雌雄合抱,雌雄虫间信息传递有关,并进而影响血吸虫雌虫的生长生殖发育.
平衡型核苷转运蛋白(Equilibrative Nucleoside Transporters, ENTs)是一类存在于大多数真核生物细胞中的膜蛋白,能够介导核苷、核碱基和其他核苷类似物的转运[7].ENTs通过跨膜转运核苷参与和调节着生物体内诸多生理、生化反应,例如能量代谢、信号转导、神经发育、细胞和组织发育等[8];其传递核苷类似物穿透生物膜的功能对于许多用于抗癌和抗病毒的核苷类似药物的跨膜转运起着重要作用[9].ENTs家族包含ENT1,ENT2,ENT3和ENT4 4个成员[10-11].ENT3蛋白含有一个相对较长的亲水N-端区域,其在酸性条件下(pH5.5~6.5)具有最大的转运活性[12].ENT3蛋白除广泛存在于人体器官外,还存在于人体的核内质溶酶体系统.Hyde等[13]和Baldwin等[14]发现ENT3蛋白能够有效转运嘧啶和嘌呤类核苷以及抗癌类药物,其介导的抗癌和抗病毒的核苷类似药物穿线粒体膜的转运可能与核苷药物的线粒体毒性有着密切联系.
为了研究SjENT3在血吸虫生长发育中的作用,我们利用qRT-PCR技术分析了其在血吸虫生长发育的不同时间、血吸虫雌雄虫体内以及单性感染雄虫与两性感染合抱雄虫体内的转录水平,并通过RNA干扰技术敲降SjENT3基因的转录,分析其转录水平下降对血吸虫生长发育及生殖能力的影响.
1 材料与方法
1.1 材料
1.1.1 主要试剂
Hieff qPCR SYBR Green Master Mix, Hifair Ⅱ 1st Strand cDNA Synthesis Kit购自上海翊圣生物科技有限公司;TRIzol reagent购自上海英潍捷基生物公司;siRNA由上海吉玛制药技术有限公司合成;qRT-PCR引物由上海擎科生物科技有限公司合成.
1.1.2 生物材料
日本血吸虫中国大陆株尾蚴由中国农业科学院上海兽医研究所钉螺室提供.通过将阳性钉螺暴露在光下可以获得具有活力的尾蚴.雄性BALB/c小鼠(n=70;年龄: 4~6周)采购于上海杰思捷实验动物有限公司.
1.2 方法
1.2.1 虫体的收集
BABL/c小鼠以腹部贴片法感染日本血吸虫[15],分别在感染后7,14,18,21,25,28,35,42d剖杀,以肝门静脉灌注法收集虫体;将感染后18,21,25,28,35,42天的部分合抱雌雄虫人为分离,分别收集雌虫与雄虫虫体;使用雄性尾蚴感染小鼠,收集18,21,23,25天单性感染雄虫虫体.所收集虫体均用磷酸盐缓冲液(PBS, pH7.4;137mmol/L NaCl, 2.7mmol/L KCl, 10mmol/L Na2HPO4, 2mmol/L KH2PO4)洗涤3次,除去残留宿主碎片后冻存于液氮中备用.
1.2.2 SjENT3蛋白的氨基酸序列分析
利用ProtParam工具计算SjENT3蛋白质(TNN11866.1)的理论分子量、等电点以及氨基酸组成.利用SignalP3.0分析蛋白质有无信号肽;利用TMHMM服务器分析蛋白有无跨膜结构;通过BLAST搜索到SjENT3在小鼠以及人类体内的同源蛋白质序列(Mouse,NP_076085.1;Humans,NP_060814.4),通过DNAMAN软件对其进行同源性分析.
1.2.3 荧光定量PCR(qRT-PCR)
使用TRIzol从收集的日本血吸虫中提取总RNA,然后使用PrimeScript RT试剂盒反转录为cDNA.根据SjENT3的基因序列(AY814163.1),利用NCBI Primer BLAST设计引物(正向)5’-CACCGACTGATGGTTGGTACA-3’和(反向)5’-AGCAGCGTTCTTTACCACTTG-3’;对所得的cDNA进行qRT-PCR分析,扩增产物的大小为80bp;使用NADPH基因作为内源性对照,引物(正向)5’-CGAGGACCTAACAGCAGAGG-3’和(反向)5’-TCCGAACGAACTTTGAGACC-3’,扩增产物的大小为174bp;使用ABI PRISM 7500实时PCR系统(Applied Biosystems)采用荧光染料法进行荧光定量PCR,每个反应均做3孔重复,使用ABI 7500 V2.0.5软件分析结果,用2-ΔΔCt法计算基因相对表达情况.
1.2.4 RNA干扰
上海吉玛基因有限公司(中国上海)设计并化学合成了针对SjENT3基因不同区域的3种特异性siRNA(S1,S2,S3)和对照siRNA(NC)(表1).小鼠经腹部皮肤感染大约200条日本血吸虫尾蚴,并分为5组(每组两只).感染后第22天时通过尾静脉给小鼠注射siRNA(S1,S2,S3和NC),每次注射2.5nmol siRNA(冻干状态的siRNA先用125μL DEPC水溶解),同时设置PBS(pH7.4)对照,48h后收集虫体,提取虫体RNA并反转录为cDNA后,利用qRT-PCR评估S1,S2,S3的干扰效果.
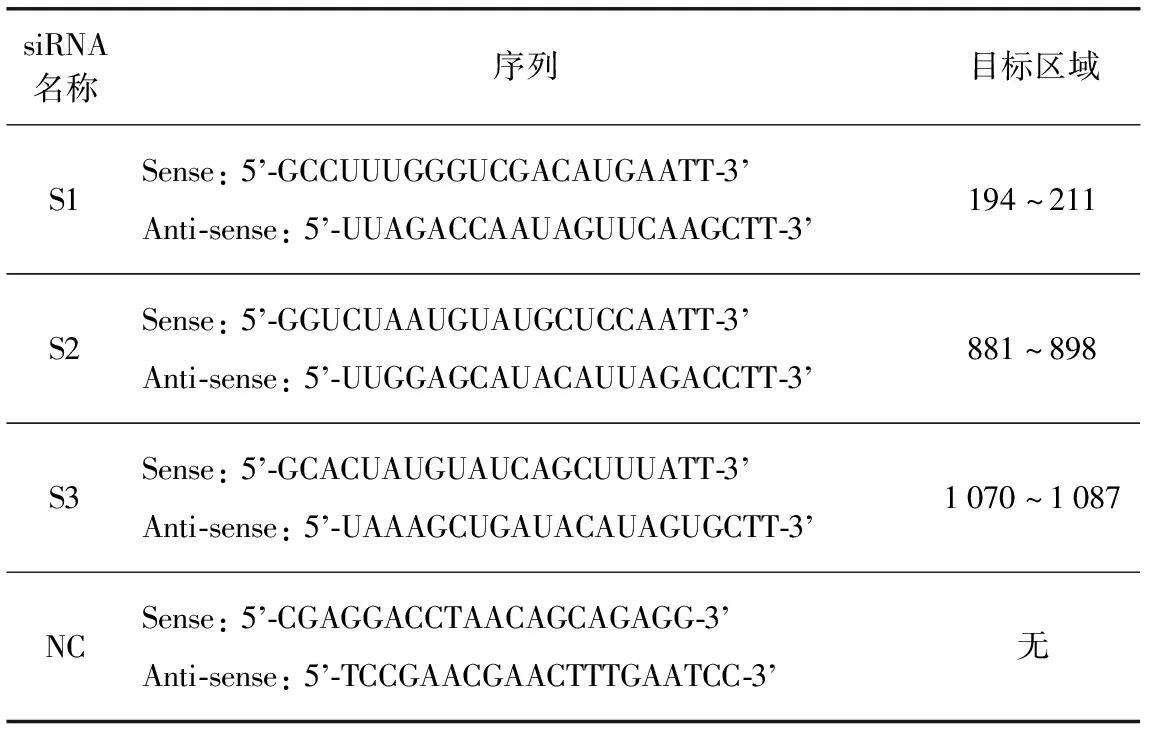
表1 SjENT3基因siRNA序列
12只BABL/c小鼠,平均分为3组,每组4只小鼠.于感染后第4天,选择S1,S2,S3中干扰效果最佳的siRNA,每组小鼠尾静脉分别注射该siRNA、PBS、NC,每4d干扰一次,共干扰10次,42d后剖杀收集虫体并计数,qRT-PCR检测干扰效果.
1.2.5 肝组织虫卵计数
收集肝脏并称重,加入PBS(pH7.4),用匀浆机混匀后,定容至20mL,取1mL肝脏匀浆液,加入等体积10%(密度)NaOH,37℃水浴锅中消化30min,消化完全后混匀取3份50μL样品,镜检计数虫卵,计算成虫数和每克肝脏荷卵数及它们对应的减少率.每克肝脏荷卵数减少率=(对照组每克肝脏荷卵数-处理组每克肝脏荷卵数)/对照组每克肝脏荷卵数×100%;每雌虫肝脏荷卵数=肝脏荷卵数/雌虫数;每雌虫肝脏荷卵数减少率=(对照组每雌虫肝脏荷卵数-处理组每雌虫肝脏荷卵数)/对照组每雌虫肝脏荷卵数×100%.
1.2.6 虫卵孵化
取4mL肝脏匀浆液于细颈平底烧瓶中,加入去氯水,并用一薄层棉花覆盖在液面下5cm处,26℃孵化6h后收集棉花上层清液,转移至15mL离心管中,加入50μL碘酊染液固定毛蚴,4000×g离心5min,吸去上清,定容至2mL,混匀取3份50μL样品,镜检计数尾蚴,计算孵化率和孵化率减少率.孵化率=总毛蚴数/总虫卵数;孵化率减少率=(对照组孵化率-处理组孵化率)/对照组孵化率×100%.
1.2.7 统计学分析
数据表示为平均值±标准偏差(SD).所有统计分析经过t-test检验.P≤0.05被认为具有统计学意义.
2 结 果
2.1 SjENT3蛋白氨基酸序列分析
SjENT3蛋白的理论分子量为63.3kDa,等电点为8.60,具有信号肽与10个跨膜结构域,将SjENT3蛋白与小鼠和人类体内的同源蛋白序列进行氨基酸序列比对,同源性分别为21.76%、22.09%(图1,第114页).
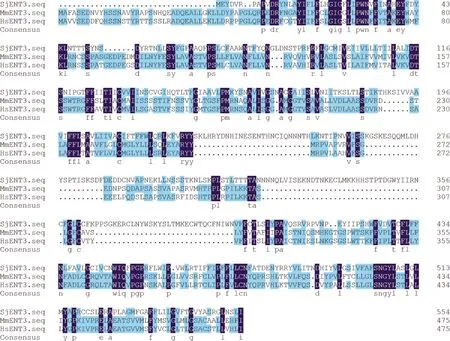
图1 SjENT3蛋白质序列比对分析
2.2 qRT-PCR分析SjENT3基因转录水平分析
使用TRIzol试剂从收集的7,14,18,21,25,28,35,42d日本血吸虫虫体中提取总RNA,然后使用Prime Script RT试剂盒进行反转录.利用qRT-PCR分析SjENT3基因的转录水平,结果表明,SjENT3基因从7d到21d逐渐上升,并在21d达到最高,之后逐渐下降,在42d降到最低(图2(a),第114页).将分开收集的18,21,25,28,35,42d的曾合抱雌、雄虫体提取总RNA并反转录,对SjENT3基因在其中的转录水平进行qRT-PCR分析,结果表明,SjENT3基因在各检测时期雄虫体内的转录水平明显高于雌虫,在不同时间点雄虫体内和雌虫体内的转录态势和其在不同发育时间点虫体内的转录态势一致(图2(b),第114页).对处在不同感染状态雄虫虫体进行分析,发现SjENT3基因在感染后21,23,25d合抱雄虫体内的转录水平皆显著高于其在同时段单性感染雄虫体内的表达,其在感染后18d两种感染状态虫体间的转录水平没有显著性差异(图2(c),第114页).
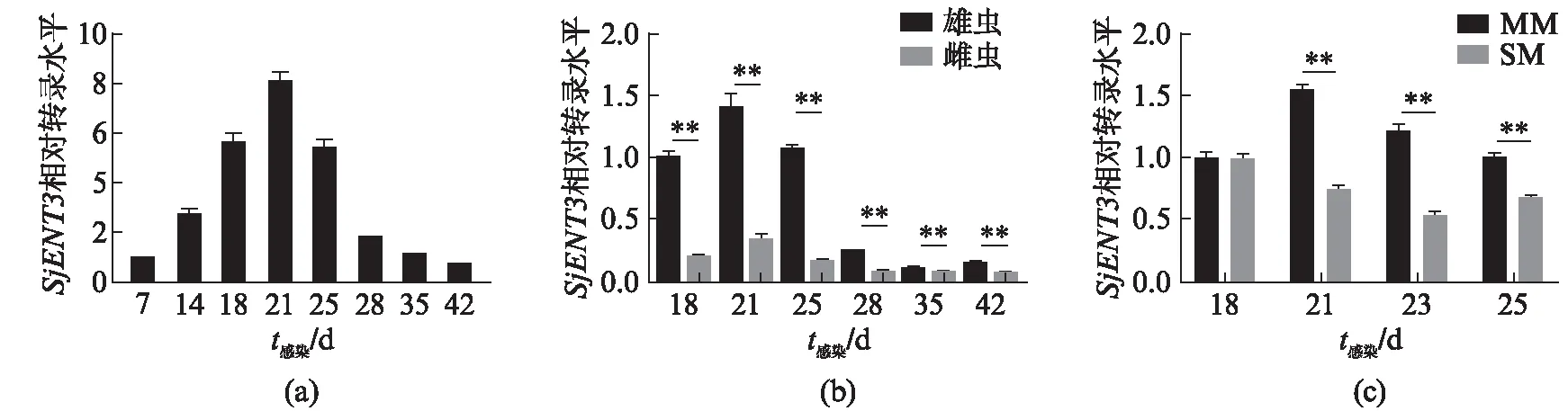
图2 SjENT3基因在日本血吸虫体内转录水平分析
2.3 SjENT3基因RNA干扰实验
2.3.1 特异性siRNA对SjENT3基因转录水平的影响
通过小鼠尾静脉注射不同的siRNA,利用qRT-PCR分析各组中SjENT3相对内参基因SjNADPH的表达量时发现:相对于PBS组与NC组,S1干扰组转录水平分别下降64.4%与65.4%;S2干扰组转录水平分别下降64.7%与65.6%;S3干扰组转录水平分别下降35.4%与37.1%(图3(a)).相对于PBS组与NC组,S2 siRNA长期干扰组SjENT3基因的转录水平分别下降75.9%与76.2%(图3(b)).
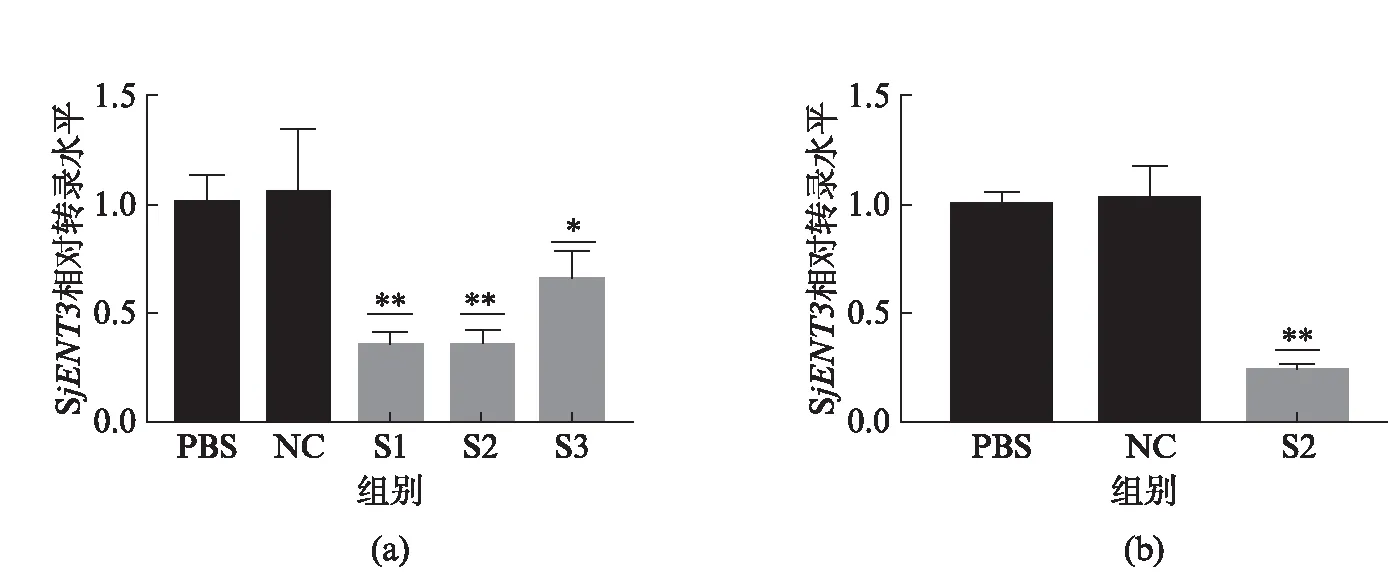
图3 qRT-PCR 检测siRNA干扰效果
2.3.2 长期干扰SjENT3基因的表达对血吸虫生长、生殖的影响
用干扰效果较好的S2 siRNA对血吸虫体内SjENT3基因进行长期干扰,对受干扰虫体的生存能力和繁殖能力进行比较分析,结果发现: 相对于PBS组和NC组,SjENT3基因表达被长期干扰会引起小鼠体内成虫存活能力下降18.07%和24.45%,其产卵引起的每克肝脏荷卵数下降61.71%和57.47%;雌虫产卵能力下降57.28%和42.28%,干扰SjENT3基因的转录水平对虫卵的孵化能力没有明显的影响(表2).
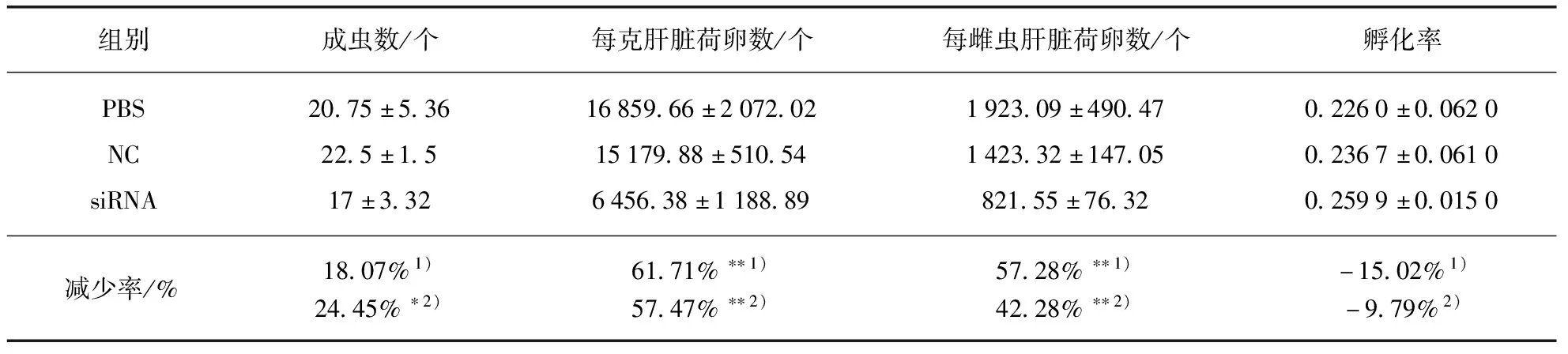
表2 长期干扰SjENT3对日本血吸虫存活和繁殖能力的影响
3 讨 论
血吸虫病流行历史悠久,分布广泛,危害严重,为人畜共患的重大疫病之一.虽然化学药物吡喹酮对其有良好的治疗效果,但其不能预防重复感染,且对童虫期血吸虫杀伤效果欠佳[16].日本血吸虫的终宿主为哺乳类,中间宿主为淡水钉螺[17].日本血吸虫毛蚴进入钉螺体内可进行大量的无性繁殖,多批次逸出尾蚴,尾蚴可感染多达40种哺乳类动物,血吸虫在终末宿主体内可存活十数年,持续向外界环境中释放虫卵,造成血吸虫病的再流行.日本血吸虫的中间宿主钉螺生命力极强,个体小、数量大、繁殖快、难以消灭[17].水资源开发,气候和环境变化,人口流动都可能导致钉螺滋生地范围扩大,致使血吸虫病传播到新的地区[18],且到目前为止血吸虫病尚无可用疫苗,化疗药物吡喹酮又有导致产生抗药虫株的可能,因此亟待开发血吸虫病防控新途径.
ENT3蛋白作为核苷类似药物穿膜的转运分子被广泛应用于抗癌和抗病毒治疗.我们发现日本血吸虫ENT3蛋白与宿主相关蛋白同源性低,可否根据此特性筛选治疗血吸虫病的核苷类药物则值得探讨.本研究发现,随着血吸虫的生长发育,SjENT3转录水平逐渐上升,且其在同时期雄虫体内的含量显著高于雌虫,说明SjENT3在血吸虫尤其是雄虫的生长发育中有着重要的作用,可能为满足其快速生长需要大量的核苷类物质和能量时提供帮助.前期研究发现在蛋白水平上,SjENT3在两性感染雄虫体内表达量颇高,本研究在转录水平上分析了SjENT3在两性感染雄虫和单性感染雄虫体内的表达,21,23,25天的结果与蛋白质组学结果相符合.
随着生物科学技术的日新月异,出现了多种基因功能研究手段[19],但目前能应用于日本血吸虫基因功能研究的仍是RNA干扰技术.RNA干扰是基因转录后的沉默过程,由双链RNA触发,能够导致同源mRNA的不稳定[20].本研究通过尾静脉注射siRNA长期干扰宿主体内日本血吸虫SjENT3的转录,发现SjENT3的低表达会影响血吸虫的生存能力,干扰导致宿主体内虫荷率下降24.44%,干扰SjENT3的表达还引起雌虫产卵能力的下降,平均雌虫产卵能力约下降42.28%,进而导致宿主肝脏荷卵数下降57.47%.我们的研究发现(表2):SjENT3不仅在雄虫体内大量表达,其在雌虫体内也有一定的表达,且其在两性感染和单性感染雄虫体内的差异表达说明该蛋白有可能参与血吸虫雌雄虫间的合抱、信息和物质传递等生理过程.干扰导致雌虫产卵能力下降可能是由于雌虫体内SjENT3的水平下降,也可能是由于雄虫体内SjENT3水平的大幅度降低,间接影响雌雄虫间相互作用而导致的.
本研究分析了SjENT3在血吸虫体内的表达情况,并观察、统计分析了该基因沉默对血吸虫生长生殖的影响,结果初步表明SjENT3基因参与了日本血吸虫尤其是雄虫的生长发育,并可能与血吸虫雌雄虫合抱及其相互间信息传递有一定的关系.
