孤独谱系障碍相关基因dia1r斑马鱼突变体的构建及行为学表型探析
2021-04-02何克喆
何克喆,皮 妍,郭 苏
(1.复旦大学 生命科学学院, 上海 200438; 2.加州大学旧金山分校 生物工程与治疗科学系 加利福尼亚, 美国 94143-2811)
人类dia1r(delete-in-autism 1 related gene)基因,又名dipk2b(divergent protein kinase domain 2B),位于人类基因组的X染色体上[1],是孤独症谱系障碍相关基因.dia1r是DIA1家族同源基因[2],这个家族有3个基因,分别是dia1a,dia1b,dia1r,他们共同包含了FAM69蛋白激酶结构域[3-4].
dia1r基因只存在于脊椎动物中,与脊椎动物的全基因组重复事件(Genome Wide Repeat events, WGD)和动物进化出高级神经系统的时间高度吻合.通过对多种鱼类进行基因组测序并对比后发现,dia1r只存在于群居性鱼类的基因组中,而更加独居性的鱼类基因组中则没有发现[2].目前,已经有两例脆性X染色体综合征(Fragile X Syndrome, FXS)患者中发现了dia1r的非同义突变[5-6].还有一些文献报导了包含dia1r基因在内的Xp11.3染色体区域与神经系统的疾病相关[7],此区域的缺失导致了一例男性孤独症高易感性[8]和一例先天性Kaburi综合征[9].另一项临床病例发现,缺失dia1r可能会导致患者出现面部畸形、智力障碍和语言发育迟缓等症状[10].对雏鸡发育过程中cdia1r表达的分析表明,该基因在卵黄囊血管母细胞、血岛和背主动脉、心内膜和头部血管内皮细胞中表达[11],这些区域的共同特征是都具有造血能力.进一步的研究发现,cdia1r在血源性内皮细胞中的表达量更高,在脑神经上皮中的血管内皮和类似小胶质细胞的分离细胞中也有表达[11].其他模式生物中的研究也发现dia1r在造血细胞和神经系统中表达,在斑马鱼胚胎的造血祖细胞和内皮细胞(cc058基因)[12]、胚胎和成年小鼠大脑的内皮细胞和小胶质细胞(4930578C19Rik基因)[13]以及人内皮细胞中都检测到了dia1r同源基因的转录本[14].这些进化及临床证据均暗示dia1r与神经系统的发育及孤独症谱系障碍的产生有着密切的联系.
孤独症谱系障碍(Autism Spectrum Disorders, ASDs)是一种由遗传因素影响的神经系统疾病,临床上主要有3个诊断依据: 语言障碍、社交障碍和重复刻板的行为[15].因此,相比于解剖学、生理学等检测方法,行为检测方法往往能够提供与人类ASDs的核心症状更相关的数据[16],而行为学实验也成为了在动物模型中鉴定ASDs的重要依据.近年来,越来越多的研究人员使用斑马鱼作为ASDs的动物模型.与小鼠不同,斑马鱼在白天活跃,对光暗周期的偏好更类似于人类[17],再加上体积小、繁殖能力强、胚胎期透明、行为学表型丰富等优点[18-19],斑马鱼在高通量行为学实验中有着巨大的优势,目前已越来越广泛地用于ASDs的研究之中.
本研究通过CRISPR/Cas9系统构建斑马鱼的dia1r基因敲除突变体,成功获得了稳定遗传的纯合突变体.同时本研究也检测了dia1r敲除突变体的行为学表型,对纯合突变体幼鱼进行了自发运动能力分析、趋触性分析、光暗交替刺激分析,对纯合突变体成鱼进行了新缸实验分析、社交偏好分析.
1 材料和方法
1.1 实验动物和菌株
野生型斑马鱼(AB品系)由复旦大学遗传学重点实验室斑马鱼研究中心提供.养殖系统由上海海圣生物实验设备有限公司提供,斑马鱼喂养及产卵方案依据相关文献建立,并按照Kimmel等人描述对胚胎进行发育阶段分期[20].本研究中斑马鱼的相关实验全部按照复旦大学动物伦理委员会的规定进行.载有pT7-gRNA的E.coliDH5α菌株和载有pGH-T7-zCas9的E.coliDH5α菌株均由范德堡大学分子生理学与生物物理学系陈文标教授实验室提供.
1.2 方法
1.2.1 构建斑马鱼CRISPR/Cas9基因敲除系统
从Ensembl网站(http://asia.ensembl.org/index.html)下载dia1r基因序列(ENSDARG00000061747),选取其进化最保守的区域蛋白激酶结构域所对应的序列设计gRNA(guide RNA),通过CCTop网站(https://crispr.cos.uni-heidelberg.de/)[21]、麻省理工学院张锋实验室网站(https://zlab.bio/guide-design-resources)[22]和CHOPCHOP网站(http://chopchop.cbu.uib.no/)[23]分别设计评分,根据三者反馈的列表综合选取最优的gRNA序列,其靶标位点为GAGAGGAAAACAGGGTCCTGAGG(表1,已用下划线标出),其中AGG为PAM序列.

表1 实验所用引物
将pT7-gRNA作为模板,以gRNA引物和载体通用引物分别作为正反向引物,扩增gRNA体外转录线性化模板.回收纯化后再使用MEGAscriptTMT7 Transcription Kit(Invitrogen,AM1333)体外转录gRNA,转录产物使用Spin Sequencing Reaction Clean-Up试剂盒回收纯化,经Nanodrop测定浓度后,置于-80℃保存.
pGH-T7-zCas9载体[24]上的Cas9序列针对斑马鱼进行过密码子优化,因此更适用于本实验.扩增培养载有pGH-T7-zCas9的E.coliDH5α菌株并获得质粒pGH-T7-zCas9,使用限制性内切酶XbaⅠ对载体进行酶切,将酶切产物进行凝胶电泳分离,使用胶回收试剂盒回收线性化质粒片段.将回收的线性化质粒片段作为模板,使用T7 mMESSAGE mMACHINE Kit(Ambion, AM1344)体外转录获得Cas9 mRNA.使用Poly(A)Tailing Kit(invitrogen, AM1350)为Cas9 mRNA进行3’末端加Poly A尾反应.所得的反应产物使用MEGAclear Transcription Clean-Up Kit(Invitrogen, AM1908)回收.回收产物经Nanodrop仪器测定浓度后,保存于-80℃.
1.2.2 构建dia1r基因斑马鱼敲除突变体
将Cas9 mRNA和gRNA分别用RNase free water稀释,并配置显微注射缓冲液,缓冲液中Cas9 mRNA终浓度为300ng/μL,gRNA终浓度为20ng/μL.在斑马鱼胚胎受精后的单细胞期对细胞进行显微注射,注射的斑马鱼胚胎数量应不少于100颗,并留下至少30颗同批未注射胚胎作为对照组.
等到胚胎发育至1dpf(days post fertilization)时,取实验组斑马鱼胚胎和对照组斑马鱼胚胎分组提取基因组DNA.设计引物以基因组DNA为模板PCR扩增gRNA靶标位点上下游序列(flanking sequence),使用PpumⅠ对扩增产物进行酶切,检测gRNA靶标位点的基因编辑效率.将检测结果为阳性的PCR产物进行测序确认是否发生基因编辑.根据测序结果,把发生基因编辑的斑马鱼胚胎培养至成鱼,称为F0代突变体.
1.2.3 筛选获得稳定遗传的纯合敲除突变体
将F0代成鱼与野生型成鱼外交(out cross),取10颗所得胚胎于1dpf时期抽提基因组,PCR扩增靶标位点上下游序列后,测序确认是否产生碱基移码突变.但由于此时无法单胚胎检测基因组,所以要将F0代成鱼与野生型成鱼外交获得的F1代胚胎培养至成鱼,通过剪尾测序的方法检测F1代成鱼基因型.F1代成鱼为杂合敲除突变体,为防止gRNA探针脱靶对实验结果产生影响,将F1代杂合敲除突变体与野生型外交,获得的胚胎养大至成鱼后剪尾检测基因型,筛选获得F2代杂合敲除突变体.
将获得的F2代杂合敲除突变体养至成鱼,自交后获得F3代胚胎,将胚胎培养至成鱼,剪尾检测基因型,检测完成后分缸培养.将F3代纯合突变体自交,收集F4代胚胎并养至成鱼.F4代斑马鱼均为无母源表达的纯合突变体,即稳定遗传的dia1r纯合突变体.
1.2.4 行为学实验
将获得的斑马鱼dia1r-/-突变体自交,所繁殖的同一批胚胎放入培养箱中养至7d.以同批次野生型幼鱼作为对照组,在24孔板中每孔加入1mL蓝水,放入一条7dpf幼鱼.做好标记后将24孔板放入Noduls行为学分析仪箱体内,视频记录实验数据,使用graphpad软件进行实验数据的分析与作图.实验过程中,温度保持在28.5℃左右.记录斑马鱼行为时,周围保持安静,以排除噪音对实验的干扰.
1.2.4.1 旷场实验
斑马鱼在24孔板中自由游动(图1(a)),箱体内的摄像机可以记录其运动轨迹,根据运动轨迹统计运动距离、平均速度、活跃程度、角速度等参数[25-26].

图1 行为学实验模式图
趋触性是指在一个新奇的环境中,斑马鱼是否会自发的接近容器的边缘地带的特性.趋触性可以衡量斑马鱼对一个陌生环境的焦虑程度[27].将24孔板中的每个孔划分为中心区和外周区这两个面积相同的观察区(图1(a)),通过计算斑马鱼幼鱼在两个观察区内游动的距离比值来考查趋触性.计算公式为: 趋触值=(外周区游动距离-中心区游动距离)/(外周区游动距离+中心区游动距离).
1.2.4.2 光暗交替实验
为了检测突变体斑马鱼在不同光照条件下自发运动能力、趋触性等特征,通过控制行为学实验仪器的光照强度,可以考察dia1r-/-幼鱼对光暗交替刺激的反应.首先将斑马鱼幼鱼放入明场环境下适应30min,再以5min的频率进行光暗交替刺激.以10s为单位统计幼鱼在细分时间内的平均运动速度和趋触值,观察斑马鱼突变体与野生型的区别.
1.2.4.3 新缸实验
使用新缸实验分析斑马鱼成鱼的焦虑程度.将斑马鱼成鱼放置在一个长30cm、宽为10cm、高为15cm的透明鱼缸中观察10min.透明鱼缸从上到下等分为3个区域,分别为顶部区(upper zone),中间区(middle zone)和底部区(bottom zone),使用摄像机记录斑马鱼成鱼在这3个区域所持续的时间(图1(b)).实验结束后,将使用的斑马鱼放回到斑马鱼系统中.
1.2.4.4 成鱼社交偏好实验
将斑马鱼放入成鱼社交偏好实验装置(图1(c))中.在缸的一侧放入5~6条斑马鱼,另一侧则不放任何物体,通过斑马鱼在社交区(conspecific arm)与空箱区(empty arm)的游动时间比值来计算斑马鱼社交偏好值[28].计算公式为: 社交偏好值=(社交区游动时间-空箱区游动时间)/(社交区游动时间+空箱区游动时间)×100%.
2 结果与分析
2.1 检测CRISPR/Cas9系统定点基因编辑效率
将合成的gRNA和Cas9 mRNA混匀后,显微注射进单细胞期胚胎中,以5颗为一组,选取3组注射后24h的斑马鱼胚胎扩增其上下游序列(引物见表1),检测基因编辑效率.研究发现所选取的3组胚胎均被限制性内切酶PpumⅠ切割,但都没有切割完全(图2),说明注射组斑马鱼的确发生了基因编辑.考虑到PpumⅠ酶切效率低,无法准确反映基因编辑效率,同时也使用TA克隆对突变效率进行了检测,结果表明: 3组中突变效率分别为6/8,7/8,6/8,平均效率为79%,其中包括4种缺失突变,-1bp占比50%,-2bp占比4%,-13bp占比15%,-15bp占比10%,均为有义突变.

图2 检测gRNA效率
2.2 鉴定稳定遗传的dia1r基因敲除突变体斑马鱼
F0代成鱼与野生型鱼进行1∶1交配,收集获得的F1代胚胎养至性成熟,剪尾鉴定其基因型.F1代中共检测了32条成鱼,其中有12条出现双峰,说明这12条F1代成鱼为杂合突变体,突变效率为37.5%.使用TA克隆检测杂合突变体的突变类型,其中5条雌鱼和3条雄鱼出现单拷贝1bp缺失,1条雄鱼和1条雌鱼出现单拷贝13bp缺失,2条雄鱼出现单拷贝15bp缺失,具体缺失碱基位置见图3(a)(第40页).所获得的F1代杂合突变体分别为dia1rΔ1/wt(单拷贝缺失1bp),dia1rΔ13/wt(单拷贝缺失13bp),dia1rΔ15/wt(单拷贝缺失15bp).其中dia1rΔ15/wt会导致DIA1R蛋白缺失5个氨基酸,并不发生移码突变,而dia1rΔ1/wt和dia1rΔ13/wt则为同一个阅读框,会发生同样的无义突变导致蛋白翻译提前终止,dia1rΔ13/wt会比dia1rΔ1/wt多缺失4个氨基酸(图3(b),第40页).3个突变体都破坏了DIA1R蛋白的功能结构域FAM69蛋白激酶结构域.
将F1代成鱼中dia1rΔ1/wt与野生型斑马鱼杂交,所产的F2代胚胎培养至成鱼后剪尾鉴定基因型,共鉴定30条F2代成鱼,其中杂合突变体13条,5条雌鱼8条雄鱼,野生型17条.将F2代杂合突变体雌雄鱼自交,获得F3代胚胎,长至性成熟后鉴定其基因型,共鉴定34条,其中纯合突变体8条,杂合突变体19条,野生型7条(图3(c),第40页).为了去除母源携带的dia1rmRNA的影响,将F3代纯合突变体自交,收集F4代胚胎并养至成鱼.F4代斑马鱼均为无母源表达的纯合突变体,即稳定遗传的dia1r-/-纯合突变体.

图3 F1杂合突变体及F3代成鱼基因型的鉴定
2.3 持续光照条件下dia1r-/-幼鱼自发运动能力降低
获得dia1r-/-纯合突变体后,我们观察其对斑马鱼的死亡率、发育、形态、致畸率等基本表型有无影响,发现其与野生型对照组无差异(数据未显示).为了进一步观察dia1r突变对斑马鱼的影响,我们进行了行为学分析.以野生型幼鱼为对照组,分析dia1r-/-幼鱼的自发运动能力.结果表明,相对于野生型幼鱼,dia1r-/-幼鱼自发运动速度显著降低(图4(a,c)).将斑马鱼运动速度超过0.4cm/s时定义为狂躁状态[25],dia1r-/-幼鱼在10min内出现狂躁状态的次数较野生型幼鱼显著下降(图4(b)).这两个指标都说明dia1r-/-幼鱼自发运动能力较野生型有所降低.

图4 持续光照条件下dia1r-/-幼鱼自发运动降低
2.4 持续光照条件下dia1r-/-幼鱼趋触性减弱
趋触性能够反映斑马鱼在陌生环境中的焦虑程度,趋触性强的幼鱼在24孔板中会紧贴孔壁游动(如图5(a),左侧趋触性强于右侧)[25].在对dia1r-/-幼鱼的进行趋触性分析时发现,相较于野生型斑马鱼,dia1r-/-幼鱼在外周区和中心区的游动速度有显著差异,在外周区的游动速度更快(图5(b)).而且,对比野生型幼鱼分别在外周区及中心区的持续时间,可以发现dia1r-/-幼鱼在两个区域所持续的时间差值相对于野生型幼鱼更小(图5(d)).通过上文中公式计算趋触值,可以看到dia1r-/-幼鱼相比于野生型幼鱼趋触性显著减弱了(图5(c)),说明dia1r-/-幼鱼较野生型幼鱼有更低的焦虑水平.

图5 持续光照条件下dia1r-/-幼鱼趋触性降低
2.5 光暗交替条件下dia1r-/-幼鱼对光照变化比野生型更加敏感
有文献报导表明在黑暗条件下,斑马鱼幼鱼更倾向表现出焦虑行为[29-30],在不同的光照条件下斑马鱼的行为差异成为检测神经系统疾病的依据[31].图6(a)中可以看出,在光暗交替过程中,黑暗条件下dia1r-/-幼鱼与对照组幼鱼的游动速度没有明显的差异,而当转换为光照条件时,则dia1r-/-幼鱼的游动速度低于对照组幼鱼.
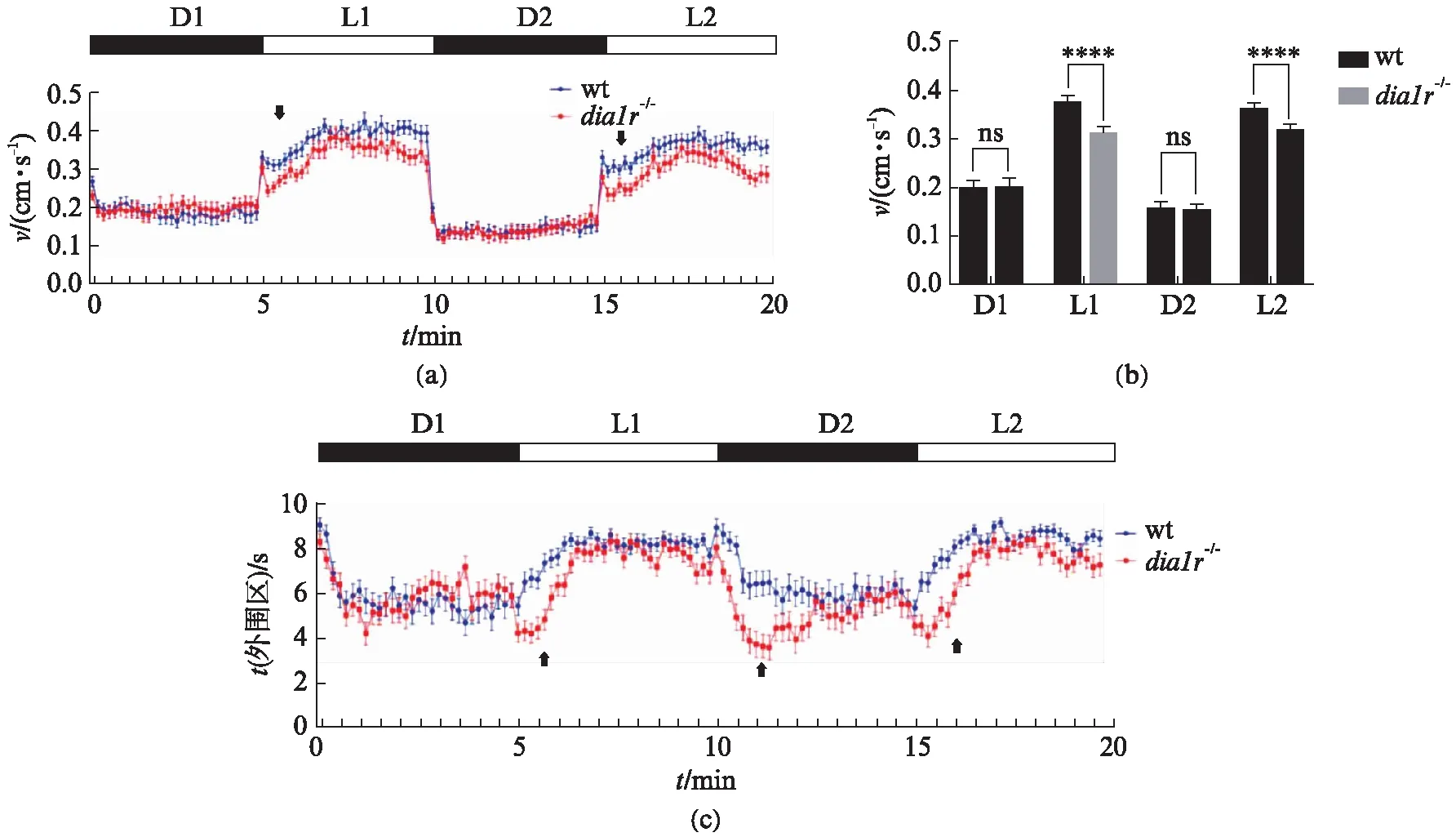
图6 光暗交替条件下dia1r-/-幼鱼与wt幼鱼的行为差异
图6(b)中统计了D1、L1、D2、L2 4个时期幼鱼的运动速度,在L1、L2两个时期dia1r-/-幼鱼与野生型幼鱼具有显著性差异.同时在光暗交替的瞬间,dia1r-/-幼鱼表现出更加突出的自发运动(图6(a)中箭头处),说明其对光暗交替表现出更大的惊吓反应.对dia1r-/-幼鱼在外周区累计持续的时间进行统计,也发现在光暗交替的瞬间,突变体斑马鱼会更多的脱离外周,向中心区移动(图6(c)中箭头处),这两者都说明了dia1r-/-幼鱼对光暗交替刺激更加敏感.
2.6 dia1r-/-成鱼比野生型成鱼表现出更低的焦虑水平
dia1r-/-斑马鱼在成年后仍可以存活和繁殖.我们使用新缸实验检测dia1r-/-成鱼的焦虑程度.当斑马鱼成鱼被突然置于陌生的环境中时,通常会选择趋向于在底部活动,并减少探索行为以保证安全[32].随着斑马鱼逐渐适应新的环境,其探索行为通常会增加,在鱼缸顶部的活动时间也会增加[33].我们使用具有顶部区、中间区和底部区的三室透明水箱进行试验(图7(a)),我们发现dia1r-/-成鱼在顶部区、中间区的时间显著多于野生型成鱼,而在底部区的时间显著低于野生型成鱼(图7(c)).并且,dia1r-/-成鱼和野生型成鱼的运动速度没有显著差异(图7(b)),说明该表型并非由运动缺陷引起.这些数据表明,dia1r-/-成鱼比野生型成鱼的焦虑水平要低.
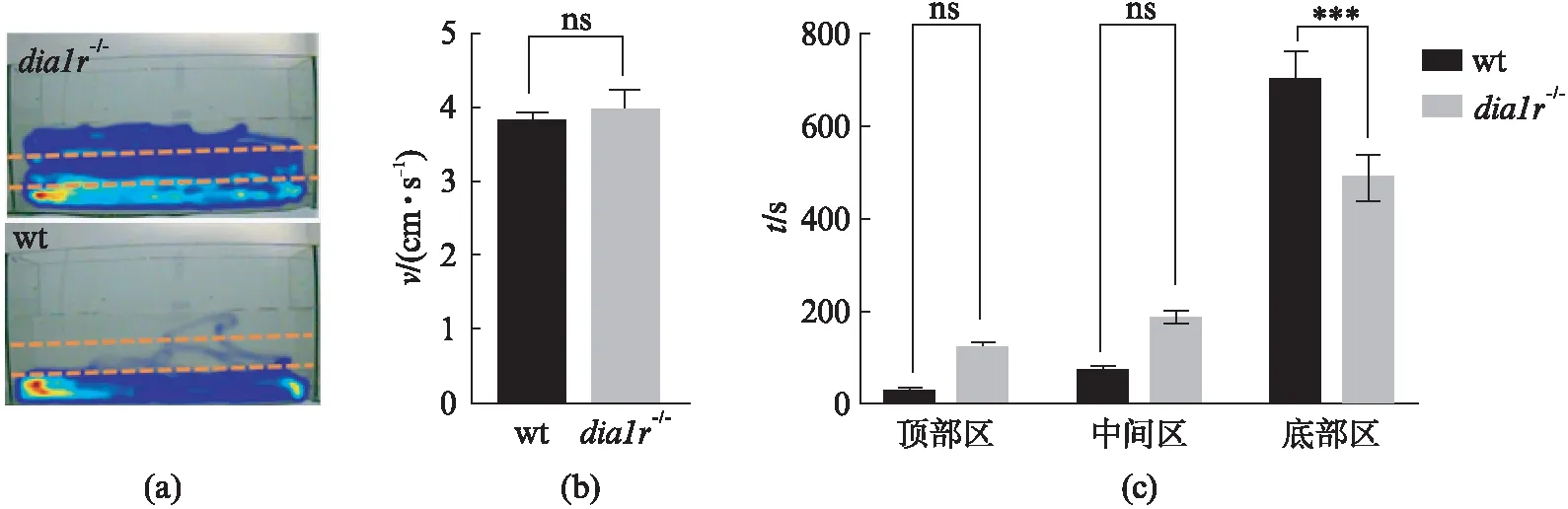
图7 dia1r-/-和野生成鱼新缸实验结果
2.7 雄性dia1r-/-成鱼比野生型成鱼表现出更弱的社交偏好
待dia1r-/-斑马鱼长至成鱼后,检测其自发运动能力和社交偏好.使用6月龄dia1r-/-雌鱼10条,dia1r-/-雄鱼10条,野生型雌鱼10条,野生型雄鱼10条,逐一放入装置中检测,社交偏好强的斑马鱼更喜欢在conspecific arm区域游动(例如图8(a),右缸较左缸鱼具有更强的社交偏好).分别对比雌性和雄性斑马鱼后发现,dia1r-/-成鱼的自发运动速度与对照组之间的差异并不具有显著性(图8(b)).通过上文中公式计算社交偏好值,研究表明,雌性dia1r-/-成鱼较对照组的社交偏好没有显著差异,而雄性dia1r-/-成鱼相比于对照组表现出更弱的社交偏好(图8(c)).

图8 dia1r-/-和野生成鱼社交偏好实验结果
3 讨 论
CRISPR/Cas9是一种目前使用广泛的基因组靶向编辑技术,现在已有实验室成功通过添加不同的gRNA以实现在多个基因位点同时引入突变[34],为高通量基因编辑提供一种技术途径.但与此同时,CRISPR系统的脱靶效应(off-target)也不可忽视,脱靶效应可能会在非特异靶向位点造成基因编辑,破坏未知基因的功能,从而对基因突变表型鉴定带来诸多不利影响[35],是CRISPR系统用于高通量基因编辑技术必须要克服的一个阻碍.目前已有多种方法减少CRISPR系统的脱靶效应的影响[36],本研究为了避免脱靶效应导致的非特异性基因编辑,从两个方面进行了改进: 首先,使用多个gRNA设计平台分别对不同gRNA候选靶位点的脱靶效应和序列特征打分,选取综合评分最好的gRNA;第二,将杂合突变体与野生型斑马鱼交配繁殖,从而尽可能地筛选清除掉与实验位点不连锁遗传的脱靶位点上的基因突变.
近年来,斑马鱼已经成为ASDs研究领域十分重要的动物模型[37].许多行为测试已经在斑马鱼模型中被开发出来,包括对社会互动、求新、求爱、抑制回避、恐惧和焦虑反应、重复/刻板行为、癫痫和攻击的评估等[38-40].一些斑马鱼ASDs基因缺陷模型也表现出行为学的异常,例如2016年Hoffman等敲除ASDs相关基因cntnap2后发现突变体斑马鱼表现出夜间亢奋行为[41].而syngap1和shank3a双基因敲除表现出运动能力下降、无效逃逸行为和类癫痫样行为[42].shank3b基因的敲除导致斑马鱼的运动能力和社会交往能力下降[25].dyrk1a基因敲除的斑马鱼表现出社交障碍[43].本文对所构建的dia1r纯合突变体进行的行为学分析表明,相较于野生型对照组,纯合突变体幼鱼在持续光照条件下自发运动能力减弱,趋触性减弱,而在光暗交替情况下,纯合突变体幼鱼表现出对光照刺激更强的敏感性.这些结果与ASDs相关基因shank3b[25]、dyrk1a[43]等基因的行为学表型类似,但尚不确定这些表型是否是ASDs相关基因在斑马鱼中的普遍表型.另外,我们也观察到雄性纯合突变体成鱼比野生型成鱼表现出更弱的社交偏好,而在雌性成鱼中则没有显著性的差异.这种因为性别差异而导致表型不同的现象在ASDs相关基因的研究中普遍存在,在人类ASDs患者[44-46]和小鼠[47-48]中都有发现,但其中具体的机制还不是很明确.
在本研究中,我们成功获得稳定遗传的dia1r基因敲除纯合突变体,并通过行为检测发现纯合突变体幼鱼自发运动能力减弱,趋触性减弱,而且雄性纯合突变体成鱼表现出更弱的社交偏好.这些结果与其他ASDs相关基因的行为学表型类似,给了我们一些对dia1r基因功能的猜测,为更进一步的机制研究奠定了良好的基础.同时,本文所构建的dia1r纯合突变体也有望成为ASDs疾病模型,为进一步揭示孤独症谱系障碍的致病机制及药物筛选提供工具.
