鱼菜共生系统中植物根系微生物及氮转化影响因素研究进展
2021-04-02邱楚雯王韩信施永海
邱楚雯,王韩信,施永海
(上海市水产研究所 上海市水产技术推广站,上海 200433)
鱼菜共生是水产养殖与水耕栽培结合的一种绿色养殖模式,该模式可以同时生产两种经济作物(包括水产品和菜).鱼菜共生模式通过蔬菜将养殖水体中残饵、粪便等产生的过剩营养物质(氮、磷等)转化为植物能量,净化池塘水质,实现经济效益和生态效益的双赢[1].为实现水生动物和水培植物的合理搭配及大规模种养,国际上的主流做法是将养殖池和种植区域分离,养殖池和种植区域通过水泵实现水循环和过滤.在栽培部分,主要的技术模式有营养膜管道栽培、深水浮筏栽培或浮筏栽培、基质栽培等[2].尽管有关鱼菜共生系统的研究越来越多,但鱼菜共生系统中有关植物根系微生物的研究相对滞后.在鱼菜共生系统中,微生物发挥着重要的作用[3],其中植物根系微生物有助于促进植物生长,抑制病原菌生长[4-7].与此同时,植物根系微生物的群落结构受到环境因子的影响.随着各种“组学”技术(宏基因组组学、转录组学、蛋白质组学、代谢组学等)的发展,有助于更深入地认识鱼菜共生系统中的植物根系微生物群落结构,这对今后进一步推广鱼菜共生绿色养殖新模式具有重要意义.
1 鱼菜共生系统概述
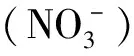
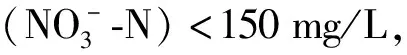
2 鱼菜共生系统中的植物根系微生物
在鱼菜共生系统中微生物是连接水生动物排泄物(高浓度铵)和植物肥料(低铵和高硝酸盐的组合)的桥梁[20].鱼菜共生系统中物质循环需要微生物参与,而植物要吸收营养物质则需要根系微生物的参与.
2.1 水培植物根系微生物
植物根系微生物通常包括3个部分: 与外界土壤接触的根际微生物、根系表面的根表微生物和根系内部的根系内生菌.根际微生物主要生活在外界的环境中,将环境中的无机物转化为有机物,为植物生长提供养料.根表微生物主要生活在根系的表面,可形成厚密的套膜,保护内部的根系,抵御病原物入侵.在鱼菜共生系统中种植作物后,微生物利用植物分泌物、营养液和植物残体,其群体会迅速扩大.植物微生物群落的建立是植物与根际微生物相互作用的结果[21-23].在鱼菜共生系统中,植物生长促进微生物(Plant Growth Promoting Microbes, PGPM)可提高植物吸收养分的能力[24].水培系统中植物根际促生细菌(Plant Growth Promoting Rhizobacteria, PGPR)常见种类有假单胞菌属(Pseudomonas)[25],芽孢杆菌属(Bacillus)[26],肠杆菌属(Enterobacter)[27],链霉菌属(Streptomyces)[28],黏帚霉属(Gliocladium)[29],木霉属(Trichoderma)[30].水培体系中的PGPR可以固氮,能够从环境中吸取养分,促进植物生长,还能够控制环境胁迫,与病原菌竞争实现生物防治,可用作生物肥料、生物控制剂和生物介质.Urakawa等研究发现生物浮床的植物根系微生物群落还包括鱼腥藻(Anabaena)、根瘤菌(Rhizobium)和红杆菌(Rhodobacter).其植物根系的微生物群落与周围水样的微生物群落较为相似[31].
2.2 植物根系微生物的作用
2.2.1 抵抗病原
鱼菜共生技术面临的主要挑战之一是疾病控制.由于使用高浓度的植物保护剂可能会对水生动物有害,鱼菜共生系统需要利用微生物对植物进行生物防控.将PGPM整合到鱼菜共生系统中可缓解系统中微量营养素的波动,防止植物病原体的大量繁殖,达到生物防治的目标.在鱼菜共生系统中假单胞菌是很重要的植物根系微生物.它能够增强抗性诱导,产生抗菌化合物,争夺生存空间和营养,保护其生长的表面免受疾病(如由腐霉(Pythium)引起的根腐病)[32-34]伤害,起到生物防控的作用.Schmautz等对鱼菜共生系统的植物根系微生物进行宏基因组检测,发现根中伯克霍尔德菌(Burkholderiales)、黄杆菌(Flavobacteriales)和假单胞菌属分布相对较多,表明生菜植株可能选择了一个能够对其根进行内在生物控制的群落[34].假单胞菌对赤霉病菌和根腐病菌有拮抗作用.水栽番茄、黄瓜、生菜和马铃薯经过假单胞菌的处理可使根和茎重增加,根腐病减轻[35-37].Lee等通过在水培生菜根部周围使用绿针假单胞菌(Pseudomonaschlororaphis),可增强植物的抗感染能力,促进植物健康[38].在水培辣椒上引入绿针假单胞菌能有效地抑制腐瓜果霉(Pythiumaphanidermatum)和宽雄腐霉(Pythiumdissotocum)的侵染,控制根腐病[39].芽孢杆菌也可起到预防或减弱植物致病菌的作用[40].Niazi等研究表明芽孢杆菌基因组通过产生植物激素和抗菌/抗真菌化合物,促进植物生长和抑制植物病害[41].丛枝菌根真菌(Arbuscularmycorrhizaefungi)可抑制镰刀菌(Fusariumspp.)对水培番茄根腐病的诱导作用,对水培植物的健康起到重要的作用[42].在黄瓜和番茄水培系统中,生物防治剂链孢黏帚霉(Gliocladiumcatenulatum)对防治由腐霉属或镰刀菌引起的根病有显著效果[28-29].还有木霉菌对根的处理也可减轻黄瓜叶斑病症状[30].
2.2.2 促进生长
鱼菜共生系统中缺乏铁元素,荧光假单胞菌Pf-5(PseudomonasfluorescensPf-5)可以增加根系的铁载体的产量,促进铁进入植物根系[43],对植物生长有利.Pf-5被认为是一种有价值的PGPM,可以改善铁缺乏造成的影响[24].Lee等研究也发现水培植物系统的PGPM有许多能够产生铁载体的物种,可提高植物对养分的利用率[44].除了能够促进铁吸收的PGPM之外,鱼菜共生的植物根系中还存在促进磷吸收的PGPM——丛枝菌根真菌.鱼菜共生系统中磷浓度较低,丛枝菌根真菌可促进磷的吸收,对植物生长有利[45-46].芽孢杆菌也可促进植物生长.Gül等研究发现芽孢杆菌能提高番茄的水分利用效率[47].还有地衣芽孢杆菌(B.licheniformis)可增加番茄和辣椒的直径和重量,促进了作物高产[48].除此之外,固氮菌也被认为是促进作物生长的重要因子[49].根瘤菌是主要的固氮菌,同时被认为是PGPM成员之一.
2.2.3 促进氮利用

在鱼菜共生系统中3种主要的硝化细菌为硝基杆菌(Nitrobacter)、亚硝基单胞菌(Nitrosomonas)和硝基螺菌(Nitrospira)[53].过去研究认为硝化作用要由AOB和NOB分两步进行,硝基杆菌是主要的AOB,硝基杆菌或硝基螺菌是主要的NOB.但实际上由氨到硝酸盐的一步完全硝化作用比两步硝化作用更有利[51].目前,有关硝基螺菌可作为完全氨氧化剂的观点不断被证实.Blackburne等发现在亚硝酸盐和铵离子浓度较低的环境中,硝基螺菌比硝基杆菌更普遍[54].Bartelme等发现在循环水养殖的生物滤池中,硝基螺菌是最主要的硝化细菌,而未检测到硝基杆菌[55].今后可研究鱼菜共生系统中植物根系硝基螺菌的不同菌株,并确定这些菌株的存在对NUE的影响.此外,可否在水培植物根系构建生物膜促进营养物质的吸收也有待进一步研究.
2.3 其他
在鱼菜共生系统中,过量的固体废物增加了对氧的需求,导致根际缺氧,并可能产生有毒的氨和亚硝酸盐.鱼菜共生系统要适当的进行固体废物管理,保持植物根部周围的氧气梯度,促进PGPM定植,防止植物病原生长.与土壤栽培相比,水培植物由于悬浮在水里,水环境更有利于病原体的均匀分布和迁移,增加了病原体内化的风险.食源性病原体可能更有机会接触植物根系后再附着其上,造成食品安全风险.因此,需要关注鱼菜共生系统中农产品的食品安全问题[56].
从基因层面上,PGPR肠杆菌科和假单胞菌功能注释的基因预测结果显示,PGPR含有参与合成硫化氢(H2S)的基因,这些基因有助于植物生长.PGPR携带有碳水化合物代谢基因,表明PGPR能有效利用根系分泌物等有机物质作为能量来源.PGPR还具有产生抗氧化酶、过氧化氢酶和超氧化物歧化酶的基因[57].此外,微生物群落的微小变化还可能对宿主的健康产生巨大影响.如经过荧光假单胞菌处理的拟南芥,其基因型发生巨大变化[58].
3 鱼菜共生系统中氮转化的影响因素
鱼菜共生系统的植物根系微生物在氮转化中发挥着重要的作用,其中硝化细菌、反硝化细菌等微生物可以促进氮循环.鱼菜共生系统中影响氮转化的各种因素(pH、DO、水力负荷(Hydraulic Loading Rate, HLR)、碳氮比(C∶N)等)及其与生物物种的关系如图1所示.
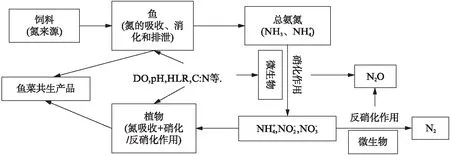
图1 鱼菜共生系统中氮转化示意图
3.1 pH
在鱼菜共生系统中,pH是影响水生动物代谢、微生物活动和植物利用氮源效果的主要因素[59-60].然而,系统中的3种主要生物体(鱼类、硝化细菌和植物)的最适pH值范围有所不同.鱼菜共生系统中最常见品种尼罗罗非鱼的最佳pH值7.0~9.0;3种主要硝化细菌(硝基菌属、亚硝基梭菌属和亚硝基螺旋藻属)的最适pH值范围分别为7.5,7.0~7.5和8.3[61-62].硝化效率受pH值的影响.硝化作用的最佳pH值范围为7.0~9.0,处在较高pH值时硝化效率更高.水培植物可生长的pH范围为5.5~6.5,最适pH值为5.8~6.2.溶液的pH值影响营养物的溶解性,特别是微量金属.当pH值超过7.0时,植物对铁、锰、铜、锌和硼等基本营养物质的可利用性较差,在pH<6.0时,磷、钙、镁、钼的溶解度急剧下降.为平衡硝化作用和养分利用率的要求,鱼菜共生系统pH值可维持在接近7.0较为合适[16].
3.2 溶解氧(DO)
由于好氧微生物(如: 硝化细菌和异养生物)和水生生物的活动,鱼菜共生系统的植物根区周围以及生物滤池的DO降低.当DO低时会导致氮受反硝化作用而损失.为了维持硝化细菌活性,生物滤池的DO应该在1.7mg/L以上[63].Kim等利用TAN含量225~450mg/L的合成废水进行研究,结果表明当DO低于4mg/L时,AOB活性降低;而当DO低于2mg/L时NOB活性降低[64].在鱼缸和生长床入口DO含量未达到5~6mg/L时会对鱼类和植物造成压力[65].因此,在鱼菜共生系统中,经过植物后的水进入养殖系统内之前需要复氧,使DO达到5mg/L以上.
3.3 水力负荷(HLR)
水力负荷是指沉淀池、生物滤池或植物生长床等单位表面积中的液体流量.在水中,微生物和营养物与植物根系的最佳接触时间受HLR控制[66].Endut等研究发现当鱼菜共生系统中HLR为1.28m/d时,植物的NUE最高[67].当HLR低时会导致缺氧,引起反硝化作用,导致氮从水中流失;当HLR高时会减少了循环水与植物根系的接触时间,同时水还会冲走附着在植物根系和生物滤池介质上的微生物[67-68].
3.4 氮浓度

4 鱼菜共生系统中根系微生物群落的研究手段
由于鱼菜共生系统是由水产养殖、水培植物及微生物组成的多元结构,植物根系微生物群落复杂多样,对微生物群落的分析可为改进优化鱼菜共生系统提供指导.自然界中可在实验室条件下培养的细菌很少,要反映环境中菌群的结构组成不能仅仅依靠传统的分离培养方法[73].目前,环境微生物的研究多数采用新一代的高通量测序技术,其能够较准确地定性和定量分析微生物多样性和丰度,有利于深入准确地了解环境微生物[74-76].利用宏基因组和转录组技术对原核生物多样性的分析.特别是基于种内细菌16S rRNA基因的扩增和序列分析,被认为是分类和鉴定细菌物种的“金标准”.细菌以外的微生物,除了使用18S(真核生物),26S(真菌)和16S与26S(酵母)rRNA克隆文库来描述微生物群落,还可以利用宏基因组学[77].利用分子生物学方法,可以开展植物PGPR的全基因组鉴定、微生物群落分析以及基因型的改变的研究.下一代测序(Next Generation Sequencing, NGS)可通过分析群体样本基因组数据(宏基因组学)来表征微生物群落,揭示时空系统发育变化和跟踪病原体.NGS还可用于在水生动物中追踪特定的菌株,消除携带有毒菌株的种群,同时保留其他菌株的携带者[78].宏基因组学方法可用于研究以前无法培养的物种.蛋白质组学还可通过与共生微生物群落相关的分泌蛋白的分析,来研究特定环境条件下细菌种类或菌株的致病性或共生关系[79].在特定环境条件下微生物群落的代谢组学研究揭示了营养物质的生物地球化学循环和变化效果.将代谢组学与基因功能研究相结合在推进鱼菜共生系统植物根系微生物研究方面具有巨大的潜力[80].
5 展 望
随着鱼菜共生研究的不断深入,未来的鱼菜共生系统中植物根系微生态群落研究可以选择从以下几个方面入手:(1)根的健康对植物的生存至关重要.鱼菜共生系统中微生物在根的定植是PGPM的一个重点研究领域;(2)鱼菜共生系统中PGPM的研究应注重PGPM参与下系统中营养成分动态变化,及其对植物作用的相关机制,有利于创造更多价值;(3)健壮菌种,筛选性能优良、对植物生长有利的PGPM,将其生产分离并加以应用;(4)与基于复杂的土壤栽培系统相比,鱼菜共生系统在高度监控和控制的环境中运行(例如,pH、温度、水力保持时间、营养浓度等),这为PGPM研究提供了可扩展、可高度复制和可调节的实验环境,在这样的研究环境中获得的发现可以更直接地转移到工业或实际应用中.
