钙化性纤维性肿瘤5例临床病理观察并文献复习
2021-04-01曾也婷王心睿齐兴峰谢飞来曲利娟
曾也婷,王心睿,齐兴峰,谢飞来,曲利娟
钙化性纤维性肿瘤(calcifying fibrous tumor, CFT)是一种良性间叶源性肿瘤,好发于儿童及青少年;常见发病部位包括胃、小肠、胸膜及盆腔等。CFT发病率低,发生于肾脏者临床少见,文献仅报道1例[1]。本文现收集5例CFT并复习相关文献,分析其临床病理学特征、诊断、鉴别诊断及预后,以提高临床与病理医师的认识水平。
1 材料与方法
1.1 材料收集2012~2019年中国人民解放军联勤保障部队第900医院病理科5例CFT。患者女性3例,男性2例,年龄26~52岁,平均37岁。
1.2 方法所有标本均经10%中性福尔马林固定,石蜡包埋,常规切片,行HE及免疫组化SP法染色。一抗CD31、CD34、STAT6、Ki-67、IgG、IgG4、CK、HMB-45、Melan A、S-100、SMA、desmin、EMA及SP试剂盒,均购自福州迈新公司。
2 结果
2.1 临床特点例1,男性,26岁,于左肩部发现一肿物。例2,女性,52岁,半年前无明显诱因出现上腹部闷胀不适,饭后加重,电子胃镜示胃体隆起性病变。例3,女性,40岁,1年前无明显诱因反复出现上腹闷痛,进食后加重。电子胃镜示胃体中部后壁见一直径0.6 cm广基黏膜隆起,表面光滑(图1A)。例4,女性,35岁,5天前因下腹痛就诊,腹部CT示右肾上极占位性病变(图1B、C)。例5,男性,31岁,于半年前无意间发现睾丸处结节,彩超示左侧精索区实性结节(表1,图1D)。
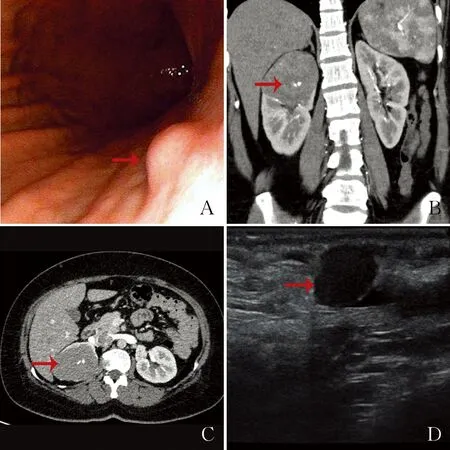
图1 钙化性纤维性肿瘤的内镜及影像学检查:A.胃体中部后壁见一广基黏膜隆起(箭头所示);B.CT冠状面示右肾上极一等密度软组织肿物,边界清晰,中央见钙化(箭头所示);C.CT横断面示右肾上极一等密度软组织肿物,边界清晰,中央见钙化(箭头所示);D.彩超示左侧精索区实性结节 (箭头所示)

表1 5例钙化性纤维性肿瘤的临床特点
2.2 病理检查
2.2.1眼观 送检标本为类圆形、球性或不规则结节状,周界清晰,最大径0.6~7.0 cm,切面呈灰白色,无明显包膜。质稍韧,部分区域有砂砾感。
2.2.2镜检 本组5例病理改变基本相似,肿瘤主要为束状、胶原化的纤维组织,其间夹杂少量血管及梭形细胞,局灶可见钙化,间质内见多少不等的淋巴细胞、浆细胞浸润,部分区域聚集成簇,无明显生发中心(图2A~D)。
2.3 免疫表型CD31、CD34呈血管内皮阳性,STAT6呈胞质弥漫阳性,浆细胞IgG呈阳性(图2E),但IgG4呈阴性(图2F),Ki-67增殖指数为1%,CK(AE1/AE3)、HMB-45、Melan A、S-100、SMA、desmin、EMA均呈阴性。
2.4 随访本组5例患者随访7~35个月,均未见复发(表1)。
3 讨论
CFT属于罕见的良性肿瘤,好发于儿童及青少年。该肿瘤首次由Rosenthal和Abdul Karim于1988年报道,曾被称为伴砂砾体的儿童纤维性肿瘤或钙化性纤维性假瘤。近年有学者发现CFT患病年龄范围更广,WHO(2016)将其命名为CFT[2]。
文献报道,CFT可发生于胃、肠系膜、心脏[3]、胸膜、大网膜[4]、腹膜后、睾丸等部位[1,5-6],其中好发部位是胃[2,5,7]。本组复习文献报道的122例CFT,结果显示CFT发病年龄多为40~60岁女性[2],常表现为无症状缓慢生长的肿物,或者于影像学检查中偶然发现,有些患者因肿瘤的压迫出现症状。122例CFT患者中, 62例(50.8%)出现胃部肿块,其中发生于中国的患者60例(96.8%),这可能是中国与其他国家之间的饮食差异造成的[5-6]。肿瘤平均最大径为3.02 cm,患者的年龄与肿物大小无显著相关性。肿瘤形状常与发生部位有关,CFT常为单发,发生于胸腔和腹腔的CFT可见多发[2]。
目前,CFT的发病机制尚不清楚。部分病例被认为与创伤及术后炎症反应过度有关[2,6-7]。也有学者认为CFT可能与IgG4相关性疾病相关[8]。Mehrad等[9]发现CFT中存在8号染色体拷贝数异常及ZN717、FRG1和CDC27基因突变。CFT可能存在遗传倾向,有1例CFT发生于5个月婴儿,其家族中有母女、姐妹均发生腹膜CFT的报道。
影像学检查对于CFT的初诊非常重要,CT检查常显示为等密度肿块,中心伴高密度的钙化影,钙化模式不一[6];MRI对诊断也有一定帮助。此外,超声检查是CFT初筛的重要检查方法。胃肠道CFT可直接使用钡肠胃造影和胃肠道内窥镜进行检查[2]。
CFT的大体检查常为类圆形、球性或不规则结节状,周界清晰,切面呈灰白色,无明显包膜或包膜不完整。质稍韧,可见散在钙化。CFT具有特征性的形态学改变:致密的胶原纤维,间杂少量梭形细胞及血管,间质多少不等的淋巴细胞、浆细胞浸润,可形成淋巴小结或淋巴滤泡,可见砂砾体或钙化。CFT中vimentin呈弥漫阳性,SMA、CD34和desmin可呈局部阳性;XIIIa因子可呈强阳性[2],CD117、S-100、ALK均呈阴性。部分CFT中浆细胞IgG4散在阳性[5],本组中CFT浆细胞未见IgG4染色阳性浆细胞。目前,尚未发现CFT特异性的免疫组化标志物。超微结构示CFT中梭形细胞含中间丝和胶原纤维,呈纤维母细胞分化[10]。
CFT需与多种疾病进行鉴别,如胃肠间质瘤(gastrointestinal stromal tumor, GIST)、炎性肌纤维母细胞瘤(inflammatory myofibroblastic tumor, IMT)[2]、IgG4相关性疾病[8]、孤立性纤维性肿瘤(solitary fibrous tumor, SFT)[2]及硬化性脂肪肉瘤等。GIST的免疫组化标记CD117、CD34和DOG1均呈阳性,存在c-KIT和PDGFRa基因突变。CFT与IgG4相关性疾病有相似的组织学形态。Hu等[8]报道CFT也可伴大量IgG4阳性浆细胞,这些病例多发生在伴炎症或自身免疫性疾病的患者中,经长期随访未见IgG4相关性疾病的证据,因此CFT不应归类为IgG4相关性疾病。IMT与CFT 的组织学形态有一定的重叠性,但是IMT的间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)免疫组化染色呈阳性,并有染色体2p23的重排[2,5,7,9]。SFT可含有粗细不等、形态不一的胶原纤维,组织学形态类似CFT,但SFT具有交替分布的细胞稀少区和丰富区,梭形细胞核呈空泡状,免疫组化标记CD34、STAT6均呈弥漫阳性[10],且有NAB2-STAT6基因融合[9]。CFT可与Castleman病、IMT等伴发[5]。此外,CFT还需与硬化性脂肪肉瘤鉴别,可联合使用MDM2、CDK4、p16及S-100检测进行鉴别,后者行FISH可检测到 MDM2基因扩增[1]。发生于不同部位的CFT需与其部位好发的肿瘤鉴别,本组有1例发生于肾的CFT,其在术前无法排除肾细胞癌,在鉴别诊断上具有一定的挑战性。
目前,CFT的首选治疗方法是局部手术切除,发生于胃肠道的CFT多数经内镜下切除,其预后佳,较少出现复发或转移。超过88%的CFT患者通过局部手术切除可以治愈,未见致死病例[2,3,5]。
