胆囊癌低分化肿瘤细胞簇与预后的相关性
2021-04-01李世君张亚男刘其娴李彦旭
童 玲,李世君,张亚男,刘其娴,李彦旭
胆囊癌是最常见的胆道系统恶性肿瘤,在我国的发病率较高[1]。胆囊癌患者早期症状不明显,仅10%的患者可进行手术治疗,根治性手术切除率低,预后较差[2]。目前,局限性胆囊癌是否需要辅助化疗尚有争议。T2期及以上或切缘阳性的胆囊癌患者推荐术后辅助放、化疗,但其疗效亦存在争议。因此,对可切除的胆囊癌进行预后分组,对后续辅助治疗的选择尤为重要。低分化肿瘤细胞簇(poorly differentiated cluster, PDC)在消化系统肿瘤(尤其是结直肠癌)中的预后分层中有重要意义[3-7],但其在胆囊癌中的预后意义尚未见报道。本文收集51例手术切除的胆囊癌标本,探讨PDC与临床病理特征及预后的相关性,为可切除胆囊癌患者的预后分层提供新依据,使患者得到更精准的治疗。
1 材料与方法
1.1 材料收集2009年1月~2019年3月内蒙古医科大学赤峰临床学院/赤峰市医院肝胆外科手术切除的胆囊癌标本51例。纳入标准:患者术前均未行放、化疗,术后经病理证实为胆囊原发性腺癌。标本均经10%中性福尔马林固定,常规石蜡包埋,4 μm厚连续切片,行HE染色。所有病例依据美国癌症分期联合委员会(American Joint Committee on Cancer Staging, AJCC)第8版进行肿瘤分期[8]。51例患者中,男性23例,女性28例,年龄36~77岁,平均62.5岁。随访截至2019年8月,有2例患者失访,随访时间3~80个月。本实验经我院医学伦理委员会审查批准,患者均签署知情同意书。
1.2 PDC的计数PDC的定义:HE染色的切片中,缺乏腺样结构且细胞数目≥5个癌细胞的实体癌细胞巢[5]。低倍镜下观察癌组织浸润前端中PDC最密集的区域,20倍物镜下(显微镜视野最大径为1 mm)行PDC计数,取PDC最大值。依据其数目将其分为3级:G1:<5个PDC;G2:5~9个PDC;G3:≥10个PDC。所有病例由本院两名高年资病理医师独立阅片计数。
1.3 统计学分析采用SPSS 25.0软件进行统计学分析。应用χ2检验比较胆囊癌PDC分级与临床病理特征的相关性。运用Cox回归模型进行多因素分析。生存率组间比较采用Kaplan-Meier法及Log-rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 胆囊癌中PDC分级与临床病理特征的关系在胆囊癌侵袭的前缘,可见散在分布的PDC(图1)。PDC分级与胆囊癌患者性别、年龄、肿瘤大小、肿瘤部位、肿瘤类型及是否合并胆结石均无关(P>0.05,表1);与肿瘤分化、淋巴血管侵犯、pT分期、pN分期、远处转移及pTNM分期相关(P<0.05,表1)。
2.2 胆囊癌预后的单因素分析本组实验结果显示:肿瘤分化、淋巴血管侵犯、神经纤维侵犯、pT分期、pN分期、远处转移、pTNM分期及PDC高级别,与胆囊癌患者的预后有显著相关性(P<0.05,表2)。

图1 在胆囊癌侵袭的前缘,可见散在分布的PDC(黄色箭头标注为PDC):A.PDC-G1;B.PDC-G2;C.PDC-G3;D.PDC-G3
2.3 胆囊癌预后的多因素分析将单因素分析中有显著相关性的危险因素纳入Cox回归模型进行多因素分析,结果显示:PDC分级、pTNM分期及神经纤维侵犯是影响患者预后的独立危险因素(P<0.05,表3)。
2.4 胆囊癌患者PDC分级与预后的关系51例胆囊癌患者有随访资料者49例,2例失访;平均生存时间为(25.08±4.22)个月,中位生存时间为13个月。PDC分级与预后的Kaplan-Meier生存分析显示,PDC-G1组患者的平均生存时间为(64.57±12.44)个月,中位生存时间为30个月;PDC-G2组患者的平均生存时间为(19.67±2.20)个月,中位生存时间为16个月;PDC-G3组患者的平均生存时间为(8.705±0.69)个月,中位生存时间为8个月。胆囊癌患者的生存时间随PDC分级的升高而显著下降(P<0.001,图2)。
3 讨论
胆囊癌是最常见的胆道系统恶性肿瘤[1],其恶性度高、侵袭性强且病死率高,放、化疗等传统治疗手段在晚期胆囊癌中优势有限[2]。
PDC在消化系统肿瘤中,尤其是结直肠癌中的预后分层有重要意义。Ueno等[5]提出新的结直肠癌部位特异性的组织学分级系统 —— PDC分级系统,该系统主要是评估癌组织浸润前端缺乏腺样结构且细胞个数≥5个的细胞簇。PDC的定义:在HE染色的切片中,缺乏腺样结构且细胞数目≥5个癌细胞的实体癌细胞巢。低倍镜下观察癌组织浸润前端中PDC最密集的区域,20倍物镜下(显微镜视野最大径为1 mm)行PDC计数,取PDC最大值。依据其数目将其分为3级:G1为<5个PDC;G2:5~9个PDC;G3:≥10个PDC。多项研究结果提示PDC是结直肠癌的独立预后因子[3-4]。PDC级别为G2或G3的结直肠癌患者无进展生存时间及疾病特异性生存时间均缩短,且其预测独立于pTNM分期及其他不良组织学特征,包括WHO组织学分级、血管或淋巴管侵犯、肿瘤浸润深度及淋巴结转移[9]。PDC分级系统在组织学观察中易操作,且观察者间有良好的重复性[5]。本组实验结果同样显示,PDC-G2及PDC-G3组的胆囊癌患者其平均生存时间及中位生存时间均显著低于PDC-G1组,且随着PDC分级的升高而显著下降(P<0.001)。同时,Cox单因素分析及多因素分析显示,PDC分级是胆囊癌患者的独立预后因子,高级别PDC与预后不良密切相关。
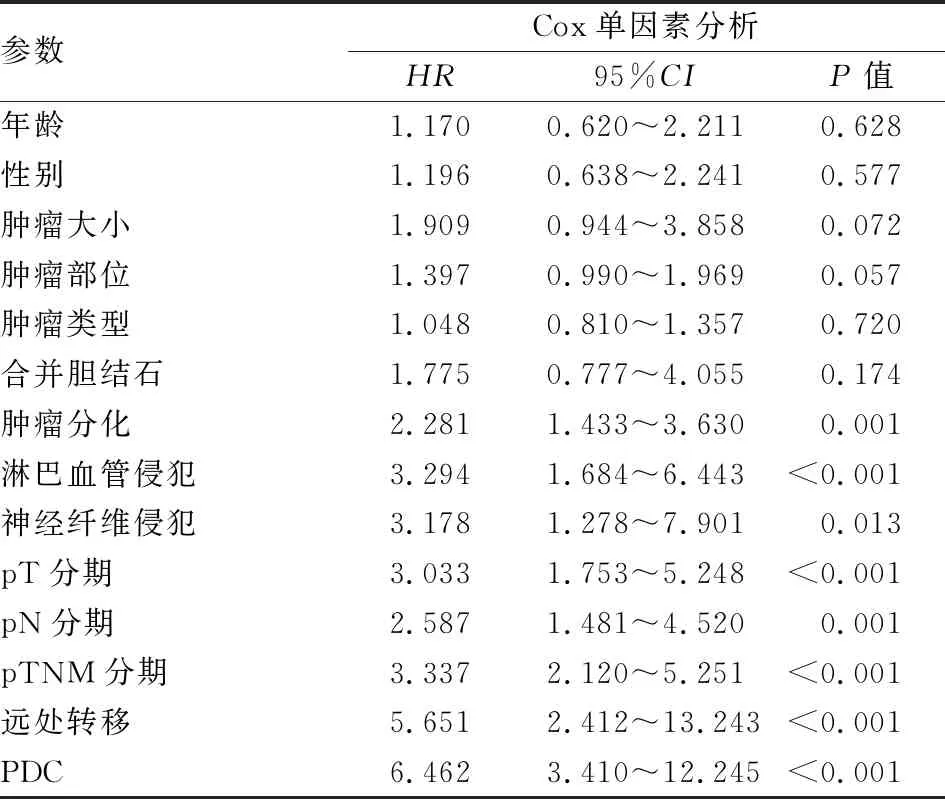
表2 胆囊癌预后的单因素分析
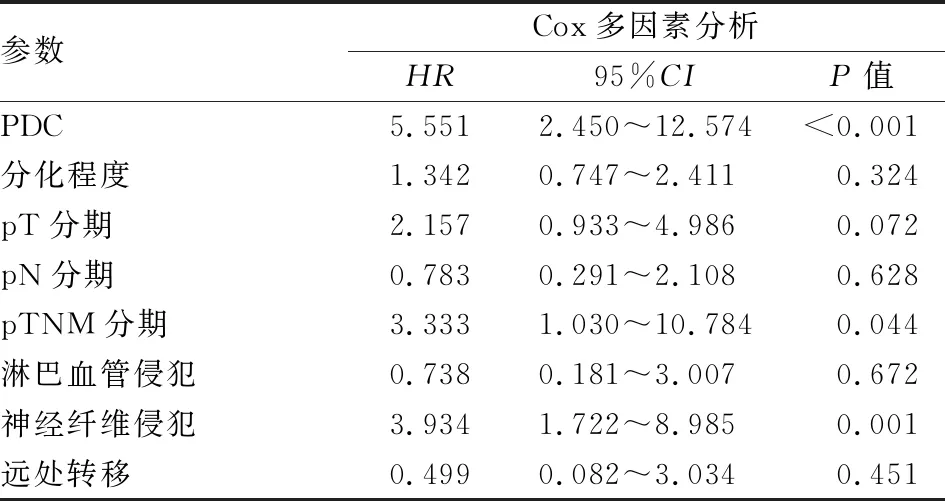
表3 胆囊癌预后的多因素分析
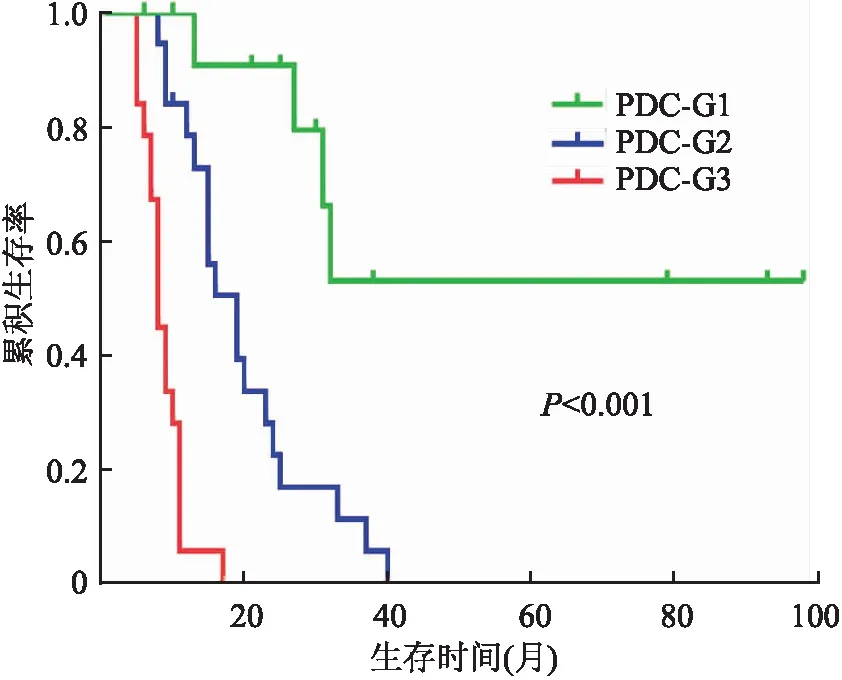
图2 胆囊癌患者PDC分级与预后的关系
AJCC(第8版)胆囊癌分期指南中,将T2期的胆囊癌分为T2a和T2b。其中T2a为侵及腹膜面的肌周结缔组织,但未穿透浆膜;T2b为侵及肝脏面的肌周结缔组织,但未进入肝脏[10]。对于T2期的胆囊癌,其手术范围、二次根治性手术的时机及术后辅助化疗的实施,均存在较大的争议。文献报道T2a期的胆囊癌若发现有淋巴结转移,行淋巴结广泛切除能否提高预后尚无定论;若侵犯肝脏4b和5段,行肝脏切除能否提高预后尚存争议。T2b期的胆囊癌,行部分肝脏切除及广泛淋巴结清扫能否提高预后尚存争议[11]。本组以T2a和T2b的胆囊癌患者为分析对象,结果显示:PDC分级与肿瘤分化、淋巴血管侵犯、pT分期、淋巴结转移、远处转移及pTNM分期相关。因此,对于T2期的患者,高级别的PDC分级提示肿瘤的侵袭性更强,行更广泛的淋巴结切除及肝脏切除能使患者获得更好的预后。胆囊癌术后的辅助治疗被认为价值有限,目前尚无被广泛接受或有效的辅助治疗方案。但有研究显示,对有高危因素的胆囊癌,行胆囊切除联合术后辅助治疗,其短期获益高于行广泛切除的患者。因此,对于具有PDC高分级的高危因素的胆囊癌患者,采用胆囊切除联合术后辅助治疗患者的短期收益应更高,但尚需进一步的临床试验进行验证。
胆囊癌患者进行PDC评估,可以帮助临床与病理医师更好的识别具有高危因素的患者,使其得到个体化治疗,有望成为胆囊癌患者术后是否进行辅助治疗的重要参考因素。
