膀胱尿路上皮癌中PD-L1和PD-L2的表达及临床意义
2021-04-01吴雅珣张邢松郑桂华
吴雅珣,张邢松,郑桂华
膀胱癌是常见的泌尿系统恶性肿瘤,其中约90%为膀胱尿路上皮癌(urothelial bladder cancer, UBC),非尿路上皮癌罕见[1-2]。目前,UBC的治疗主要包括经尿道肿瘤电切、膀胱部分切除、膀胱根治性切除等手术治疗以及灌注化疗、全身化疗、放疗等,但复发率仍较高[3]。近年以程序性死亡受体-1(programmed death-1, PD-1)/程序性死亡配体-1(programmed death-ligand 1, PD-L1)信号通路为靶点的免疫治疗取得突破性进展,给UBC患者带来新希望[4]。PD-1是一种表达于T细胞表面的受体,可调节T细胞活化。现已证实,PD-L1表达与肿瘤的免疫逃逸有关,可在多种肿瘤中表达,且PD-L1高表达患者预后不良。近年有文献报道PD-1的另一配体——程序性死亡配体-2(programmed death-ligand 2, PD-L2),在肿瘤发生和免疫逃避中同样发挥重要作用。PD-L2又称B7-DC或CD273,是B7配体家族的一员,与PD-L1同源,两者在不同组织中的表达不尽相同[3]。本文着重探讨UBC组织的肿瘤细胞以及肿瘤浸润性免疫细胞(tumor-infiltrating immune cell, TIIC)中PD-L1、PD-L2的表达及临床意义,为临床与病理医师提供参考。
1 材料与方法
1.1 材料收集2013年3月~2018年3月江苏省南通市肿瘤医院病理科确诊的UBC石蜡标本58例,制作成组织芯片;其中男性48例,女性10例;患者年龄32~87岁,中位年龄66.5岁;组织学分级:高级别UBC和低级别UBC各29例。pT分期:pTa-pT1者43例,pT2-pT4者15例。N分期:N0者54例,N1-N3者4例。M分期:M0者57例,M1者1例。
1.2 免疫组化采用免疫组化EnVision法染色,一抗PD-L1(22C3,稀释度1 ∶50)购自Dako公司,PD-L2(D7U8C,稀释度1 ∶200)购自Cell Signaling Technology公司,二抗及DAB购自Dako公司,具体操作步骤按试剂盒说明书进行。用已知阳性组织作为阳性对照,以PBS代替一抗作为阴性对照。
1.3 判断标准PD-L1阳性染色定位于细胞膜,按阳性细胞百分比进行判读:分别以1%、10%、50%为cut-off值,评估肿瘤细胞PD-L1的阳性程度;以5%、10%、50%为cut-off值,评估TIIC PD-L1的阳性程度。PD-L2阳性染色定位于细胞膜/细胞质,肿瘤细胞PD-L2按染色强度和阳性细胞百分比进行评分,参考Okadome等[5]的标准:将肿瘤细胞PD-L2按染色强度评分:无着色为0分、黄色为1分、棕黄色为2分、棕色为3分;按阳性细胞百分比评分:阳性细胞<10%为0分,10%~29%为1分,30%~49%为2分,≥50%为3分;将两者得分相乘,总分≥3分为PD-L2阳性。TIIC PD-L2按阳性细胞百分比进行判读:分别以5%、10%、50%为cut-off值,评估TIIC PD-L2的阳性程度。
1.4 统计学分析采用Pearson χ2、Fisher精确概率法分析肿瘤细胞及TIIC PD-L1、PD-L2表达与UBC临床病理特征的关系;利用Kaplan-Meier法绘制生存曲线,Log-rank检验进行差异性比较。以P<0.05为差异有统计学意义。
2 结果
2.1 UBC中PD-L1、PD-L2表达与临床病理特征的关系本组UBC组织中PD-L1可评估57例,1例因点阵脱落无法评估;PD-L2可评估56例,2例因点阵脱落无法评估。cut-off值为1%、10%、50%时,肿瘤细胞PD-L1在高级别UBC(图1)、pT2-pT4 UBC中的表达高于低级别UBC(图2)、pTa-pT1 UBC(P均<0.05)。在cut-off值为5%时,TIIC PD-L1在高级别UBC(图3)、pT2-pT4 UBC中的表达高于低级别UBC(图4)、pTa-pT1 UBC(P均<0.05);在cut-off值为10%时,TIIC PD-L1在pT2-pT4 UBC中表达高于pTa-pT1 UBC(P=0.014,表1、2)。肿瘤细胞PD-L2表达与UBC组织学分级、pT分期等均无关(P均>0.05)。在cut-off值为50%时,TIIC PD-L2在pTa-pT1 UBC中表达低于pT2-pT4 UBC(P=0.044,表3,图5、6)。
2.2 UBC中PD-L1、PD-L2表达与预后的关系在cut-off值为1%、10%、50%时,肿瘤细胞PD-L1表达状态与UBC患者的总生存期(overall survival, OS)无关(P均>0.05)。在cut-off值为5%时,TIIC PD-L1高表达患者比低表达患者OS短(P=0.011,图7);在cut-off值为10%、50%时,TIIC PD-L1表达状态与患者OS均无相关性(P均>0.05)。肿瘤细胞及TIIC的PD-L2表达与患者OS均无相关性(P均>0.05)。
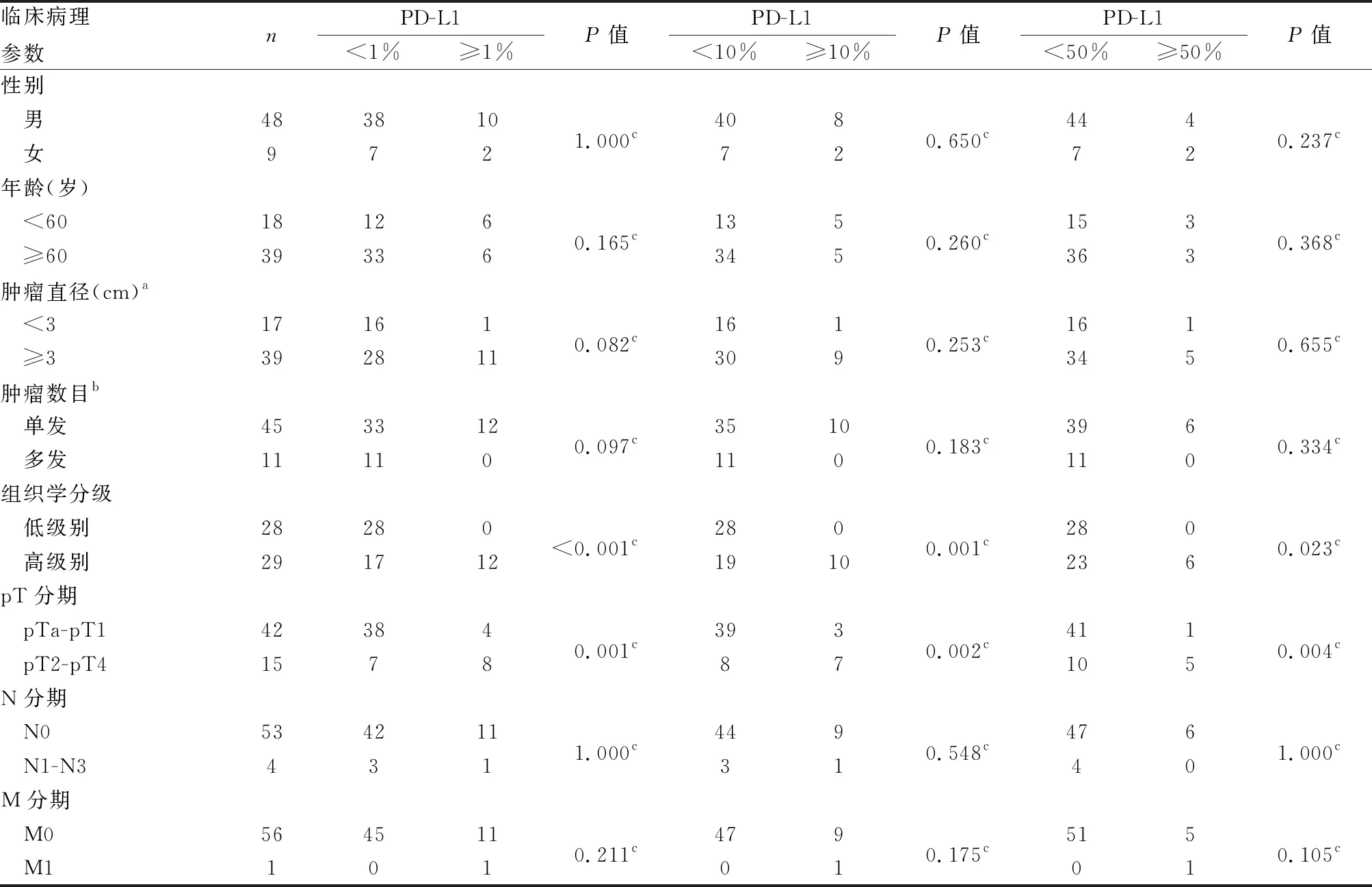
表1 膀胱尿路上皮癌中肿瘤细胞PD-L1表达与临床病理特征的关系(cut-off)
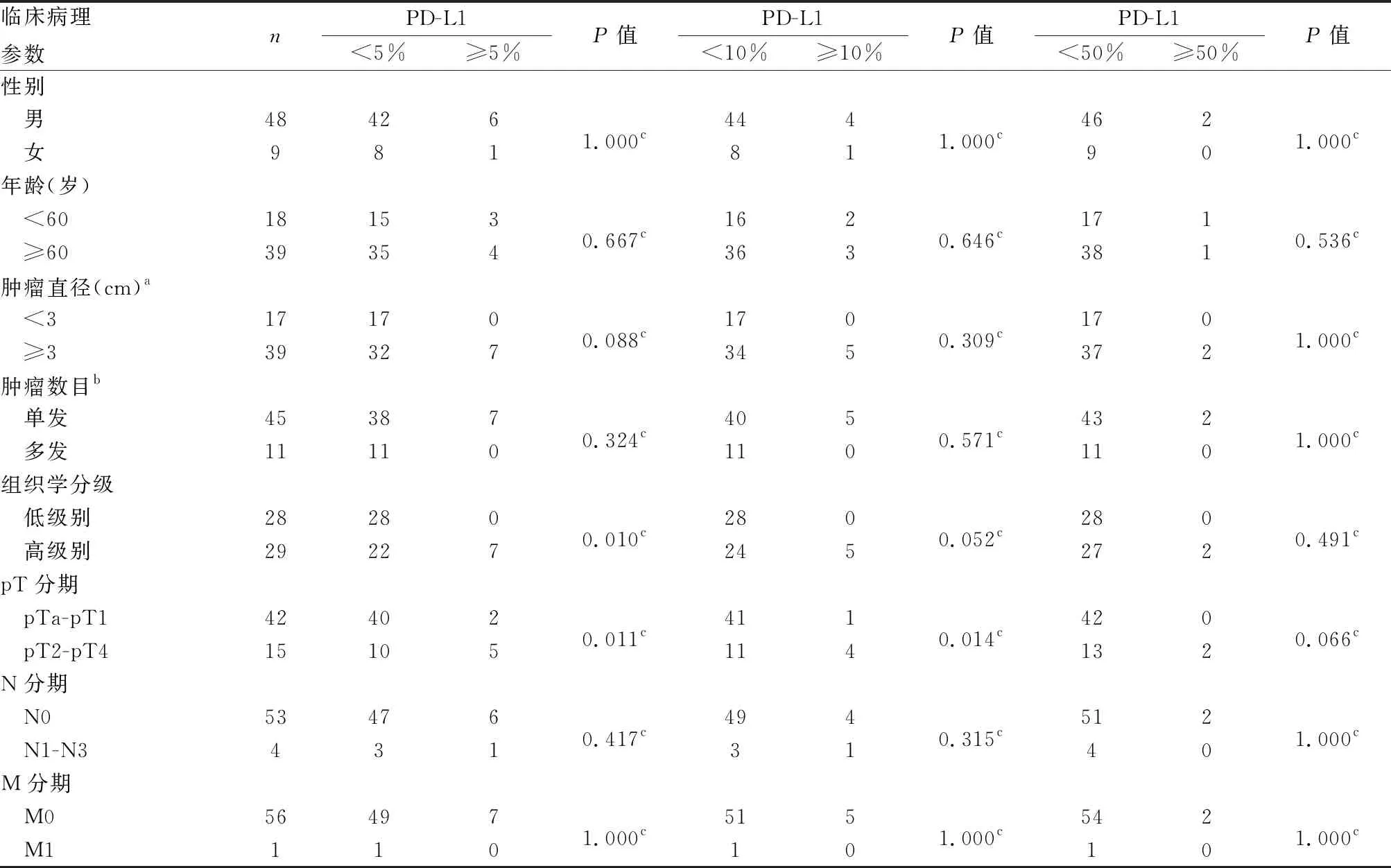
表2 膀胱尿路上皮癌中肿瘤浸润性免疫细胞PD-L1表达与临床病理特征的关系(cut-off)
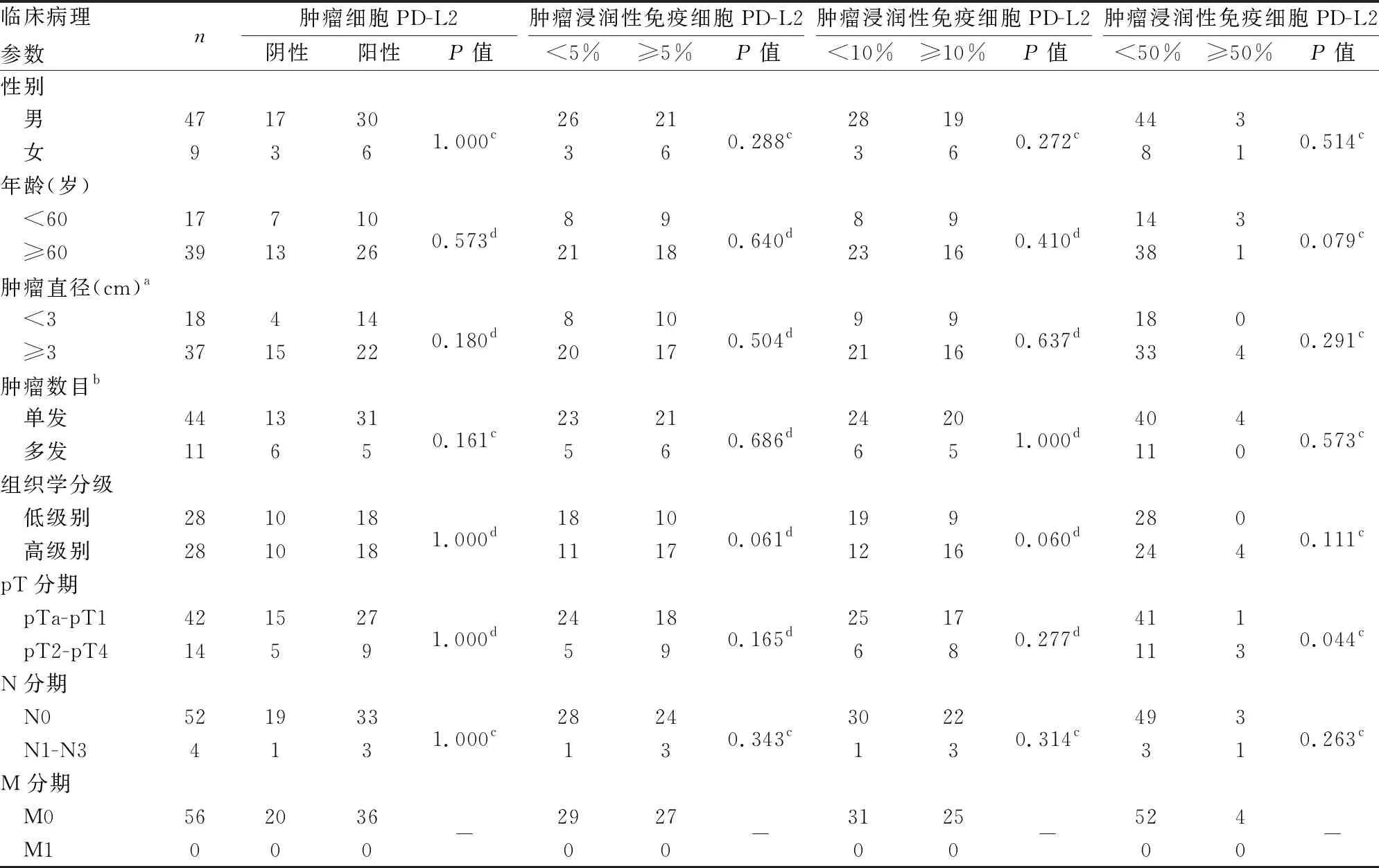
表3 膀胱尿路上皮癌肿瘤细胞及肿瘤浸润性免疫细胞的PD-L2表达与临床病理特征的关系(cut-off)

图1 高级别膀胱尿路上皮癌中肿瘤细胞的PD-L1表达,EnVision法 图2 低级别膀胱尿路上皮癌中肿瘤细胞的PD-L1表达,EnVision法 图3 高级别膀胱尿路上皮癌中肿瘤浸润性免疫细胞PD-L1的表达,EnVision法 图4 低级别膀胱尿路上皮癌中肿瘤浸润性免疫细胞PD-L1的表达,EnVision法 图5 pT1期膀胱尿路上皮癌中肿瘤细胞、肿瘤浸润性免疫细胞PD-L2的表达,EnVision法 图6 pT3期膀胱尿路上皮癌中肿瘤细胞、肿瘤浸润性免疫细胞PD-L2的表达,EnVision法
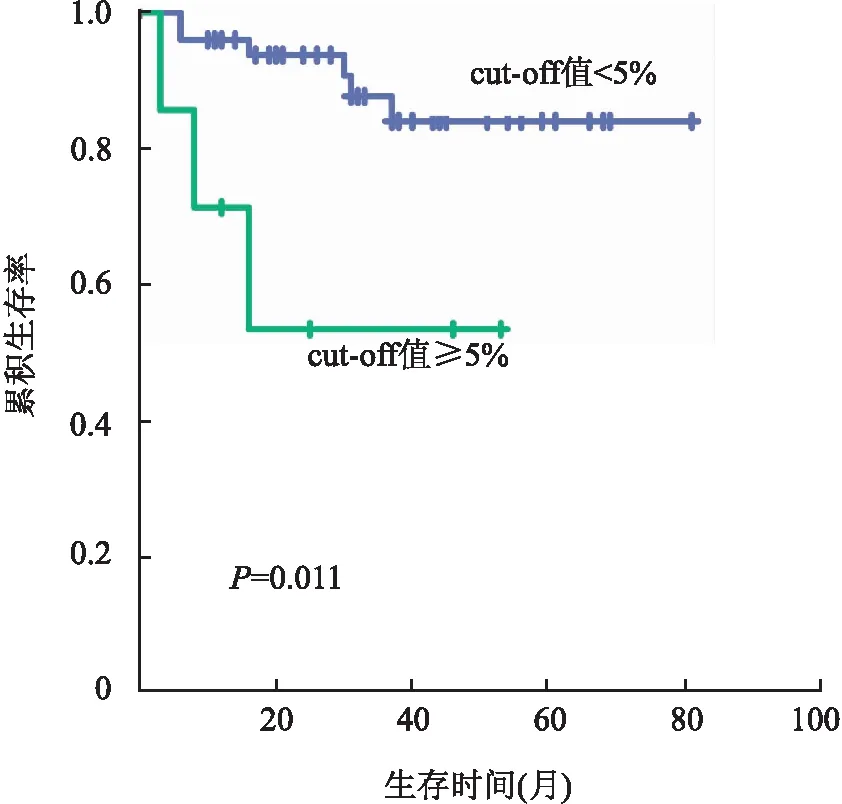
图7 肿瘤浸润性免疫细胞PD-L1表达的Kaplan-Meier生存曲线
3 讨论
PD-1又称为PDCD1、CD279,是一种重要的免疫抑制分子,属于共刺激分子B7-CD28家族,广泛表达于各种免疫细胞和非免疫细胞。PD-L1(又称为CD274、B7-H1)和PD-L2(又称为CD273、B7-DC)是PD-1的2个配体,具有不同的表达谱[6-7]。PD-L1可表达于多种不同类型的细胞,在造血细胞(如T细胞、B细胞、树突状细胞、巨噬细胞)以及非造血细胞(如血管内皮细胞、胰岛细胞、胎盘合体滋养细胞)中均有表达。现已证实,促炎症信号可诱导PD-L1的表达。PD-L2的表达相对局限,主要表达于树突状细胞、巨噬细胞和B细胞。在正常状态下,PD-L2的表达相对较低,但与PD-L1相似,亦可由炎症刺激诱导。PD-1的胞质结构域含有2个酪氨酸基序。当PD-1与其配体结合后,PD-1的酪氨酸残基发生磷酸化,并与蛋白酪氨酸磷酸酶(如SHP2)结合。蛋白酪氨酸磷酸酶可引起激酶去磷酸化并拮抗T细胞受体(T cell receptor, TCR)和CD28信号,影响下游信号通路,如PI3K-AKT、RAS、ERK、PLCγ等,继而抑制T 细胞活化、增殖、存活、细胞因子产生,并影响代谢[8]。此外,PD-L1和PD-L2亦可表达于肿瘤细胞。
据文献报道,在多种肿瘤中PD-L1高表达常与预后不良有关。肿瘤浸润性淋巴细胞PD-1表达也常与预后不良有关[9]。经PD-1/PD-L1信号途径,肿瘤细胞通过向表达PD-1的T细胞传递抑制信号,减弱免疫反应。抗PD-1和PD-L1抗体可阻断该通路,增强抗肿瘤免疫反应,抑制肿瘤生长[10]。刘维辉等[11]报道PD-L1在UBC中表达上调,且与UBC临床分期、组织学分级、非肌层浸润型UBC危险度分级以及肿瘤复发密切相关。本组结果显示:肿瘤细胞及TIIC的PD-L1表达与UBC患者性别、年龄、肿瘤直径、数目、N分期以及M分期均无关(P均>0.05)。
近期研究发现,阻断PD-L2可能对恢复免疫细胞的功能和减少肿瘤细胞的免疫逃逸也至关重要。有研究报道在肺鳞状细胞癌中PD-L1和PD-L2的表达,与CD8阳性肿瘤浸润性淋巴细胞数目增加以及MET表达增加有关[12]。在食管癌中PD-L2阳性患者比PD-L2阴性患者的OS短[5]。耿卫朴等[13]报道正常人乳腺腺上皮细胞中PD-L1和PD-L2均阴性;乳腺导管内癌中PD-L1和PD-L2均弱阳性;在乳腺浸润性导管癌中D-L1和PD-L2均强阳性;PD-L1和PD-L2的表达与ER、PR相关,但与乳腺癌其它临床病理特征无相关性。Yang等[3]研究发现,膀胱癌中PD-L2高表达患者OS和无瘤生存期短。本组结果发现:肿瘤细胞PD-L2表达与UBC组织学分级以及pT分期等临床病理特征均无关(P均>0.05)。TIIC PD-L2表达与患者性别、年龄、肿瘤直径、数目、N分期以及M分期均无关(P均>0.05)。肿瘤细胞及TIIC的PD-L2表达状态与患者OS无相关性(P均>0.05)。本组结果未显示PD-L2阳性组与阴性组OS的差异,可能与样本量较小有关,在后续的研究中可扩大样本量进一步明确两者之间是否有关。
目前,PD-L1、PD-L2在UBC中的最佳cut-off值尚无统一定论,参考Davick等[14]的报道,本实验选取多个cut-off值分析PD-L1、PD-L2在UBC中的表达及临床病理意义。结果显示:cut-off值1%、10%、50%时,肿瘤细胞PD-L1在高级别UBC、pT2-pT4 UBC中的表达高于低级别UBC、pTa-pT1 UBC中的表达(P均<0.05)。在cut-off值为5%时,TIIC PD-L1在高级别UBC、pT2-pT4 UBC中的表达高于低级别UBC以及pTa-pT1 UBC(P均<0.05);在cut-off值为10%时,TIIC PD-L1在pT2-pT4 UBC中的表达高于pTa-pT1 UBC(P=0.014),但在高级别UBC以及低级别UBC中的表达差异无统计学意义(P=0.052);而在cut-off值为50%时,TIIC PD-L1表达与组织学分级及pT分期均无相关性(P均>0.05)。与PD-L1不同,肿瘤细胞PD-L2表达与UBC组织学分级以及pT分期等均无关(P均>0.05)。仅在cut-off值为50%时,TIIC PD-L2在pT2-pT4 UBC中的表达高于pTa-pT1 UBC(P=0.044)。
综上所述,UBC的肿瘤细胞、TIIC均可表达PD-L1、PD-L2,评估两者的表达状态,可为后续临床开展免疫治疗提供参考。
