抑制线粒体动力相关蛋白1通过PI3K/AKT通路对糖尿病大鼠七氟醚后处理心肌细胞凋亡的影响*
2021-04-01程虎陈婷婷亚力亚森吴建江
程虎 陈婷婷 亚力·亚森 吴建江
(新疆医科大学第一附属医院麻醉科,新疆 乌鲁木齐830054)
七氟醚(sevoflurane,Sev)具有快速诱导麻醉,对肝、肾功能影响小及稳定的血液动力学等特点,在麻醉中广泛使用;Sev后处理对心肌细胞具有保护作用,其对糖尿病(diabetic mellitus,DM)患者心肌细胞的保护作用显著减弱[1-2]。线粒体动力相关蛋白1(dynamin-related protein 1,Drp1)被激活后募集在线粒体表面,并促进线粒体分裂。研究[3]发现,抑制Drp1可以减轻DM小鼠心肌缺血/再灌注(ischemia/reperfusion,I/R)损伤。磷脂酰肌醇激酶3(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)相关通路在I/R中发挥重要作用。研究[4]显示促进PI3K/AKT通路可以保护DM大鼠的心肌细胞。本文主要分析Drp1通过PI3K/AKT通路对DM大鼠Sev后处理心肌细胞凋亡的影响,并探究其机制。
1 材料与方法
1.1 主要材料和仪器 健康雄性Sprague-Dawley(SD)大鼠(12周,220~250 g,上海斯莱克实验动物中心,中国)。链脲佐菌素(streptozotocin,STZ)(Sigma公司,美国)。Drp1 抑制剂 Mdivi-1 (Med Chem Expres公司,美国)。生化试剂盒、酶联免疫吸附(ELISA)试剂盒和TDT介导的dUTP-生物素缺口末端标记(TUNEL)试剂盒(碧云天公司,中国)。小动物呼吸机(Inspira ASV,哈佛仪器公司,美国)。BL-420F小动物生物功能实验系统(成都泰盟科技有限公司,中国)。Mayer's苏木精和0.5%曙红水溶液(H8070,DH0050,北京Solarbio公司,中国)。RIPA裂解缓冲液(中国,北京,Beyotime)、二喹啉甲酸(bicinchoninic acid,BCA)试剂盒(武汉博斯特生物技术有限公司,中国)、抗体购自美国Abcam公司、聚偏氟乙烯(PVDF)膜(Bio-Rad公司,美国)、显微镜(Olympus 公司,日本)。
1.2 大鼠分组、建模和干预方法 将60只大鼠随机分为假手术(Sham)、I/R、I/R+DM、I/R+DM+Sev、I/R+DM+Sev+Mdivi-1、I/R+DM+Mdivi-1组6组。其中I/R+DM、I/R+DM+Sev、I/R+DM+Sev+Mdivi-1、I/R+DM+Mdivi-1组通过腹腔注射STZ(60 mg·kg-1,pH=4.5)建立糖尿病模型,Sham组仅接受等量柠檬酸盐缓冲液(0.1 mol·L-1)腹腔注射。在STZ注射后第72 h后用生化试剂盒测量血糖,72 h时尾静脉空腹血糖(FBG)水平高于16.7 mmol·L-1证明DM模型建立成功。I/R、I/R+DM、I/R+DM+Sev、I/R+DM+Sev+Mdivi-1、I/R+DM+Mdivi-1组在DM建模后(或注射柠檬酸盐缓冲液)后进行结扎建立心肌I/R模型[5]:①腹腔注射1%戊巴比妥(3 mL/kg)麻醉大鼠,通过心电图四肢导联进行监测。在第三和第四肋间隙做切口并将大鼠插管连接呼吸机(潮气量:3 mL/kg,呼吸频率:60~70 次/min)。②打开心包,然后使用6/0线结扎左前降支冠状动脉,此时心脏表面立即变为白色,并且心电图ST段抬高。保持结扎15 min,然后取出丝线进行再灌注,缝合胸腔。③手术后肌肉注射80万单位的青霉素预防感染。Sham组的大鼠在进行相同的操作但不结扎。建模24 h后,I/R+DM+Sev+Mdivi-1、I/R+DM+Mdivi-1组在结扎15 min后腹膜内注射Drp1 抑制剂 Mdivi-1共0.1 mL,总剂量为1.2 mg/kg,其余组注射等量的溶剂[6]。I/R+DM+Sev、I/R+DM+Sev+Mdivi-1组大鼠根据参考文献[7]在建立在结扎15 min后吸入Sev,Sev浓度为1%。
1.3 观察指标和检测方法
1.3.1 HE染色以及检测心肌梗死面积 大鼠断头处死,取出心脏,沿结扎线分为两半,以保留结扎线和心尖之间的区域。将组织用4%的多聚甲醛固定并用梯度醇脱水,然后包埋在石蜡中,切成厚度为4 μm的组织做成玻片标本。用Mayer’s苏木精在室温下染色10 min,然后用0.5%曙红水溶液室温下染色3 min。根据HE染色结果,使用Image Pro Plus 6.0软件计算心肌梗死面积。梗死面积 =(内膜的弧长+外膜的弧长)/(疤痕的内周+疤痕的外周)×100%。
1.3.2 ELISA检测cTnI和CK-MB水平 通过ELISA检测心肌指标肌钙蛋白I(cTnI)、肌酸激酶同工酶(CK-MB),大鼠处死后采集血液样本,离心(2000 rpm,20 min)收集上层血清。然后使用ELISA试剂盒检测cTnI和CK-MB根据制造商说明书加入抗体,然后通过酶标仪检测450 nm处的吸光度,然后根据标准曲线计算浓度。
1.3.3 TUNEL染色检测心肌细胞凋亡 利用1.3.1中固定的大鼠心脏乳头肌的石蜡切片进行实验,经过常规脱蜡、抗原修复处理,并用密封液封闭并修复,然后加入50 μL 的TUNEL溶液在37 ℃下孵育1 h,洗涤后加入100 μL的二氨基联苯胺在37 ℃下孵育30 min,在显微镜下观察样品。随机选择每个组织的四个视野进行计算,并收集平均值。凋亡指数=凋亡核数/(凋亡核数+正常细胞核数)×100%。
1.3.4 Western blot检测PI3K、AKT蛋白水平 在梗塞区获得心肌组织样本,将组织匀浆、研磨获得总蛋白,蛋白浓度通过BCA试剂盒测量。使用10%的聚丙烯酰胺凝胶进行电泳(PAGE)(80~120 V,90 min)分离40μg的总蛋白。在100 mV的恒定电压下与PVDF膜进行湿转移。在5%牛血清白蛋白中于室温孵育1 h,然后将1∶500稀释的anti-Drp1、anti-PI3K和anti-AKT添加到PVDF膜中,并在4 ℃下孵育过夜。洗涤后在室温下添加二抗孵育1 h。然后加入化学发光试剂进行显影。 GAPDH用作内部参考。用Image J软件分析目标条带的灰度值。

2 结果
2.1 抑制Drp1对DM大鼠I/R心肌梗死的影响 Sham组无心肌梗死,I/R+DM组梗死面积和心肌组织损伤程度显著大于I/R组(P<0.05),I/R+DM+Sev组和I/R+DM+Mdivi-1组梗死面积和心肌组织损伤程度显著小于I/R+DM组(P<0.05),I/R+DM+Sev+Mdivi-1组梗死面积和心肌组织损伤程度显著小于I/R+DM+Sev组和I/R+DM+Mdivi-1组(P<0.05),见表1和图1。
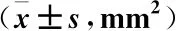
表1 各组心肌梗死面积比较

图1 HE染色检测心肌损伤和梗死面积
2.2 抑制Drp1对DM大鼠I/R心肌损伤标志因子的影响 I/R组cTnI和CK-MB水平显著高于Sham组(P<0.05),I/R+DM组cTnI和CK-MB水平显著高于I/R组(P<0.05),I/R+DM+Sev组和I/R+DM+Mdivi-1组的cTnI和CK-MB水平显著低于I/R+DM组(P<0.05),I/R+DM+Sev+Mdivi-1组的cTnI和CK-MB水平显著低于I/R+DM+Sev组和I/R+DM+Mdivi-1组(P<0.05),见表2。
2.3 抑制Drp1对DM大鼠I/R心肌细胞凋亡的影响 I/R组凋亡指数显著高于Sham组(P<0.05),I/R+DM组凋亡指数显著高于I/R组(P<0.05),I/R+DM+Sev组和I/R+DM+Mdivi-1组凋亡指数显著低于I/R+DM组(P<0.05),I/R+DM+Sev+Mdivi-1组凋亡指数显著低于I/R+DM+Sev组和I/R+DM+Mdivi-1组(P<0.05),见表3、图2。

表2 各组cTnI和CK-MB水平比较
2.4 抑制Drp1对DM大鼠I/R心肌细胞中PI3K/AKT的影响 I/R组PI3K和AKT蛋白水平低于Sham组(P<0.05),I/R+DM组PI3K和AKT蛋白水平低于I/R组(P<0.05),I/R+DM+Sev组和I/R+DM+Mdivi-1组PI3K和AKT蛋白水平显著高于I/R+DM组(P<0.05),I/R+DM+Sev+Mdivi-1组PI3K和AKT蛋白水平显著高于I/R+DM+Sev组和I/R+DM+Mdivi-1组(P<0.05),见图3和表4。

表3 各组凋亡指数比较
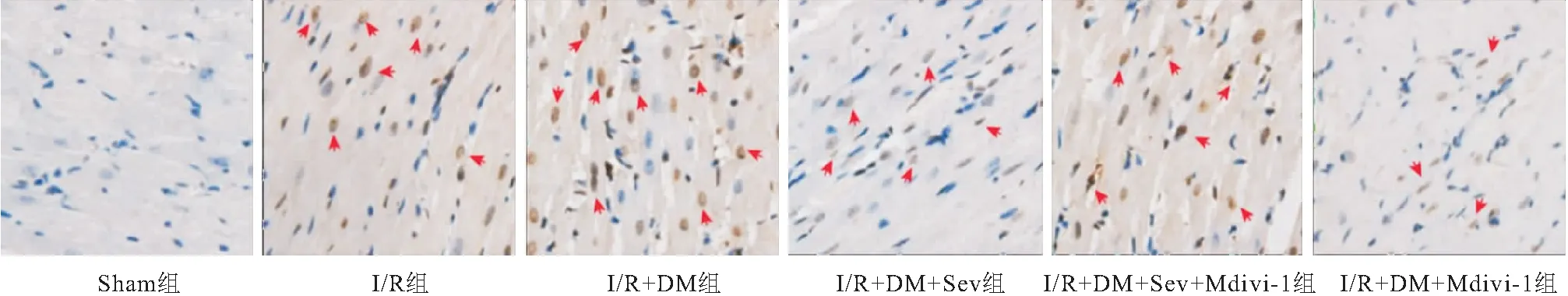
图2 TUNEL染色检测各组心肌细胞凋亡情况

图3 TUNEL染色检测抑制Drp1对DM大鼠I/R心肌细胞中PI3K/AKT的影响

表4 各组PI3K/AKT通路蛋白水平比较
3 讨论
心脏在缺血时会损伤心肌细胞,在再灌注阶段,心肌细胞会在血流恢复时再次受到损伤,此过程被称为I/R损伤。挥发性麻醉药Sev在再灌注开始时给药能改善缺血后的心脏功能并减少损伤,这被称为麻醉后处理,Sev可以缓解心肌细胞的I/R损伤[8]。七氟醚等药物进行麻醉后处理是减轻心肌损伤的有效策略,但其确切机制尚未完全阐明。近年研究[9]发现,Sev对DM患者心肌I/R的保护作用有显著的影响。
Drp1具有促进线粒体裂变促进活性氧物质表达的作用[10]。在心肌I/R模型中,Drp1易位至线粒体,导致线粒体裂变和功能障碍,并且抑制线粒体裂变可减少I/R后的心肌损伤并改善心脏功能[11]。DM对线粒体动力学有直接影响,高血糖情况下线粒体变短且变小,并由Drp1介导线粒体快速分裂,在DM小鼠的冠状内皮细胞或心肌细胞中观察到与激活的Drp1相关的线粒体裂变增加[12]。据此,我们推测Drp1可能是将DM与I/R损伤联系起来的一种关键分子。本研究结果显示DM会加剧大鼠I/R心肌损伤诱导凋亡,而Sev后处理和Drp1抑制剂Mdivi-1均可缓解I/R心肌损伤并抑制凋亡,并且Sev联合Mdivi-1可进一步的缓解I/R心肌损伤并抑制凋亡,抑制Drp1可以进一步提高Sev后处理对DM大鼠I/R的保护作用。Zheng等[13]的研究显示抑制Drp1可以缓解I/R引起的心肌损伤,而Sev也具有一定的抑制Drp1的功能抑制凋亡。体外研究[14]显示抑制Drp1可以通过促进线粒体形态恢复,促进Sev对缺氧/复氧心肌细胞的保护作用。这提示DM大鼠I/R心肌组织中Drp1的升高可阻碍Sev对心肌保护作用,抑制Drp1可促进Sev对DM大鼠I/R心肌损伤的保护作用。
研究[15]显示DM可导致PI3K/AKT通路受损,会阻碍后处理对心肌细胞的保护作用。而Drp1可通过调节PI3K/AKT通路改变细胞中葡萄糖代谢过程[16]。本研究结果显示I/R 组的PI3K和AKT蛋白水平显著低于Sham组,I/R+DM组的PI3K和AKT蛋白水平显著低于I/R组,这与上述研究结果一致,提示PI3K/AKT通路受到抑制会加重DM大鼠的心肌I/R损伤。Drp1可以通过抑制AKT相关通路诱导细胞凋亡[17]。也有研究[18]显示七氟醚可以通过促进AKT通路缓解I/R损伤;Sev可以通过Drp1缓解抑制氧化应激并调节自噬,缓解心脏I/R并保护心肌细胞[19]。I/R+DM+Sev组和I/R+DM+Mdivi-1组PI3K和AKT蛋白水平显著高于I/R+DM组,并且I/R+DM+Sev+Mdivi-1组PI3K和AKT蛋白水平显著高于I/R+DM+Sev组和I/R+DM+Mdivi-1组,提示Sev和抑制Drp1均可以通过促进PI3K/AKT通路抑制心肌细胞凋亡,保护心肌I/R损伤。但是关于Sev、Drp1以及PI3K/AKT通路之间的作用机制仍需要进一步研究。
4 结论
抑制Drp1可以通过促进PI3K/AKT通路抑制DM大鼠心肌I/R模型的心肌细胞凋亡,从而促进Sev对DM大鼠心肌I/R损伤的保护作用。
