基于高通量测序技术的脾虚腹泻型肠易激综合征小鼠与健康小鼠肠道菌群的差异研究*
2021-03-31丁姮月朱惠萍梁国强连秋华孙宏文
丁姮月,朱惠萍,梁国强,张 川,连秋华,孙宏文△
(1. 南京中医药大学, 南京 210023; 2.南京中医药大学附属苏州市中医医院,江苏 苏州 215009)
肠易激综合征(irritable bowel syndrome,IBS)是一种以腹痛、排便频率与大便性状改变为特征的临床常见的功能性胃肠道疾病,腹泻为主的肠易激综合征(IBS-D)是其主要亚型,其主要表现是腹痛和腹泻[1]。IBS-D属于中医学“泄泻”“鹜溏”“飧泄”“濡泄”“洞泄”“注下”“后泄”等范畴,其病因有外感、内伤之分,外感中湿邪最为重要,内伤中脾虚最为关键,因此脾虚湿盛是导致本病发生的关键因素。泄泻的病位在脾、胃、肠,脾胃为泄泻之本,脾主运化水湿,脾失健运、清气不升、清浊不分自可成泻,其他诸如寒、热、湿、食等内外之邪以及肝肾等脏腑所致的泄泻都只有在伤脾的基础上,导致脾失健运时才能引起泄泻[2]。正如《景岳全书·泄泻》曰:“泄泻之本,无不由于脾胃。”西医方面,IBS-D的病因尚不完全明确,但大量的实验研究提示,可能与胃肠道动力紊乱、内脏感觉异常、中枢感觉异常、“脑-肠-菌”轴失调、肠道感染与炎症反应、精神心理因素等相关[3]。随着研究的不断深入,发现肠道菌群与IBS-D的关系密切。近年来,16S rDNA基因高通量测序方法的发展,使学者们能够对肠道细菌进行较详细的分析。本研究采用此技术,旨在观察脾虚型IBS-D小鼠肠道菌群的变化情况。
1 材料
1.1 实验动物
清洁级幼龄ICR雄性小鼠20只,40~50 d龄,体质量(20±2) g,购自江苏省苏州市新区昭衍新药研究中心有限公司,动物合格证号scxk(苏)2013-0003。光暗每日各半,室温控制在(23±2 )℃,相对湿度45%~70%。小鼠无菌标准饲料喂养,购自苏州市双狮实验动物饲料科技有限公司,自由饲食、水,适应性喂养1周后备用。本研究已通过南京中医药大学附属苏州市中医医院实验动物伦理委员会审查(批件号2017伦研批009)。
1.2 实验药物
戊巴比妥钠(上海化学试剂采购供应站分装厂提供,sigma公司生产,批号20089104);番泻叶:苏州市春辉堂药业有限公司,批号170909。
1.3 实验试剂
SYBR Green PCR试剂盒(货号K0223)Thermo;逆转录试剂盒(货号,K1622)Fermentas;Trizol,(货号1596-026)invitrogen;无水乙醇(货号100092680)国药集团产品;氯仿(货号10023419)国药集团;异丙醇(货号80109218)国药集团。
1.4 实验仪器
352型酶标仪(芬兰Labsystems Multiskan MS);TG16 W离心机(国产)微量高速离心机);GNP-9080型培养箱(国产)隔水式恒温培养箱;Sigma 1-13微量离心机(美国Sigma公司);AX-26DR万分之一分析天平(瑞士梅特勒-托利多公司);ABI9700智能梯度PCR仪(ABI 美国);Axygen 凝胶回收试剂盒(Axygen 美国);FTC-3000TM real-time PCR(枫岭 上海);Miseq测序仪(Illumina 美国)等。
2 方法
2.1 实验分组
随机将20只清洁级幼龄ICR小鼠分为空白组(CK)与模型组(IBS-D),CK组5只,IBS-D组15只。
2.2 动物造模
造模前每日定时记录观察小鼠的大便性状,测量其饮食、体质量并记录一般情况。采用100%番泻叶浸液(1 g生药/ml)以10 ml/kg小鼠体积灌胃,每日2次,连续10 d,期间喂食不定时,饮食无常,制定脾虚型IBS-D模型[4-5]。
2.3 脾虚型IBS-D动物模型标准
主症:泄泻严重甚至脱肛;食少纳呆;次症:消瘦、体质量减轻;神态萎靡,四肢不收,毛色枯槁;蜷缩聚堆;易疲劳。其中具备2项主症、2项次症即可确认脾虚型IBS-D造模成功[6]。
2.4 观察及检测指标
2.4.1 一般情况观察 每天定时记录造模前后小鼠的大便性状、饮食及体质量。
6) 外输结束。当外输油量达到既定值时,外输结束,关闭外输泵,常规油船将之前接收的水通过CTV打回到FPSO以冲洗油管,增压泵旁通阀打开,外泄阀关闭,CTV软管与常规油船断开,并将油管中残余的水排至CTV的污液舱,由拖船协助软管回收到CTV的卷筒上。常规油船系泊解脱,CTV回收系泊缆索,断开侧装载接头,由拖船协助软管回收到FPSO的软管收放滚筒上。
2.4.2 小鼠肠道菌群的检测 造模成功后,提取CK、IBS-D组小鼠肠道内粪便,无菌操作收集于冻存管中。随后称取样本质量,采用组织匀浆器冰浴上匀浆并离心取上清液。最后对所有样本进行基因组DNA抽提进行双向测序,并采用两步PCR扩增方法(表1),将全部PCR产物采用AxyPrepDNA 凝胶回收试剂盒进行回收,将样本按照等摩尔比混匀后完成文库制备,而后进行illumina miseq 2×300 bp高通量测序及生物信息学分析。
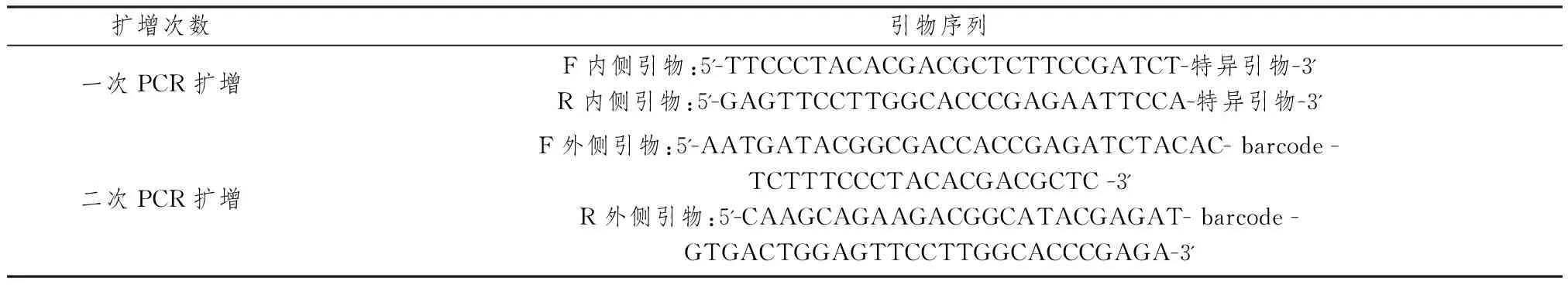
表1 PCR扩增引物序列
2.5 统计学方法
采用R 3.4.1语言作图软件剖析肠道菌群,采用SPSS 22软件进行统计分析, wilcox、Ttest分析比较各组之间差异,P<0.05为差异有统计学意义。
3 结果
3.1 脾虚型IBS-D小鼠一般情况比较
表2、3示,模型组在造模过程中,均出现了主症2项及次症中至少2项。参照Bristol分型积分标准对造模前后小鼠的大便进行评分,结果表明模型组小鼠的Bristol积分值明显高于空白组(P<0.05),主要表现为水样便;另对造模前后小鼠的进食量与体质量进行统计比较,发现模型组小鼠的进食量与体质量明显低于空白组(P<0.05)。以上信息初步确认脾虚型IBS-D小鼠造模成功(表3)。

表2 Bristol分型积分标准

表3 小鼠造模前后数据结果比较
3.2 小鼠样本的基因DNA质控及PCR扩增
首先采用QIAamp DNA Stool Mini Ki方法对样本进行基因组DNA提取,然后进行PCR扩增,文库构建主要采用两步PCR扩增方法。(1)一次扩增(图1A):电泳检测条带单一,片段长度与预期片段大小一致,且浓度适中,负对照无污染;(2)二次扩增(图1B):二次PCR扩增后条带单一,亮度适中,每个条带的分子量均在750~500 bp之间,符合预期结果,可进行后续凝胶回收实验。
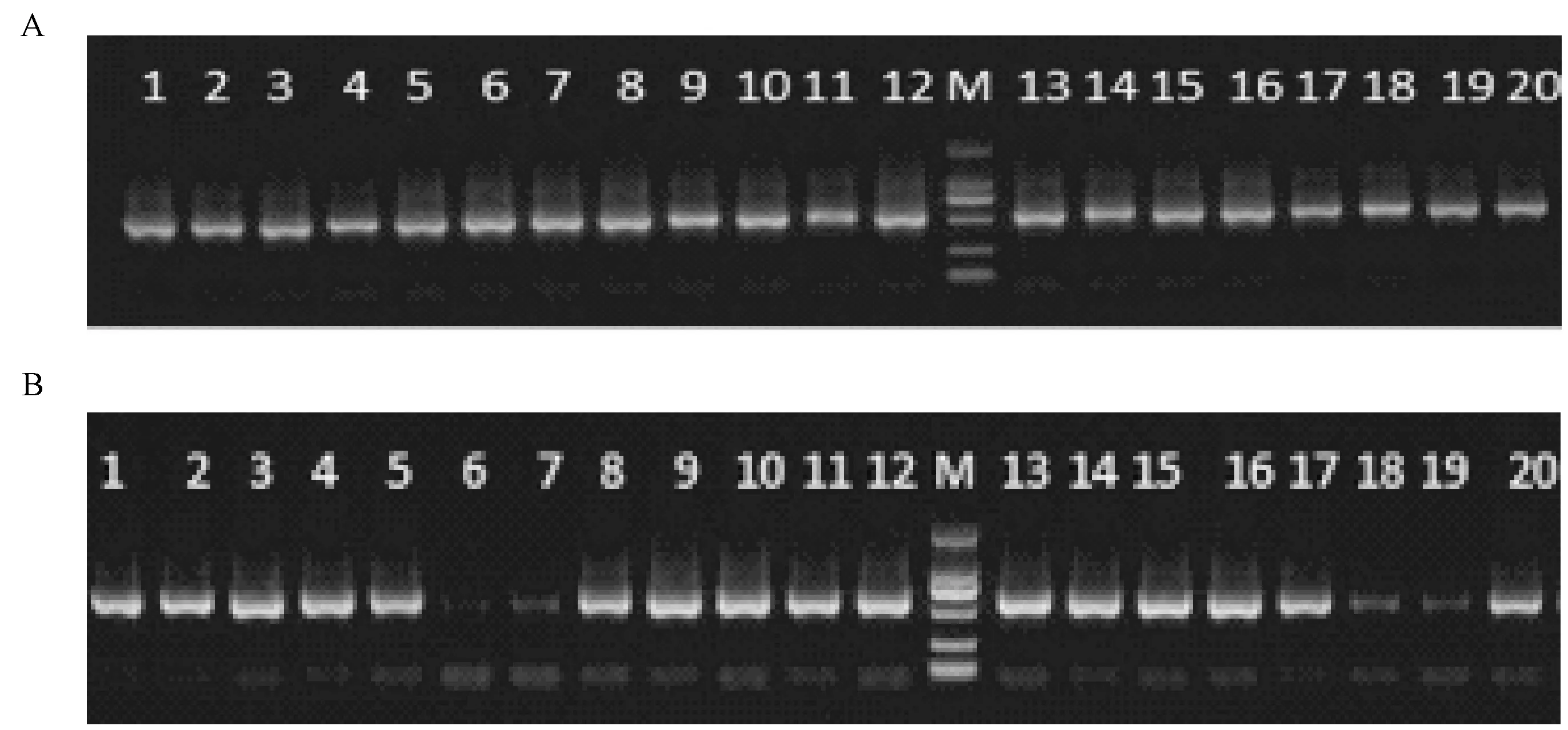
注:图中每一条带代表一个分子量,Marker为DL2000,从上至下条带依次为2000 bp、1000 bp、750 bp、500 bp、250 bp、100 bp,上样量为3 μL,亮带为30ng/μL,其余条带均为10ng/μL
3.3 脾虚型IBS-D小鼠和健康小鼠细菌多样性分析
3.3.1 脾虚型IBS-D小鼠和健康小鼠细菌的测序深度分析 本实验将相似性等于或大于97%的序列归为同一单元OTU,并基于物种分类学信息,在门、界、纲、目、科、属、种分类水平上分别进行群落结构的统计分析。为得出样本的测序深度情况,使用mothur软件进行稀释性曲线(Rarefaction curve)的绘制。图2示,所有样本在测序量1000左右出现明显的转折点,随后即进入平缓期,说明本次测序深度充分,测序数据量大且合理,能反映出标本中的绝大部分生物信息。
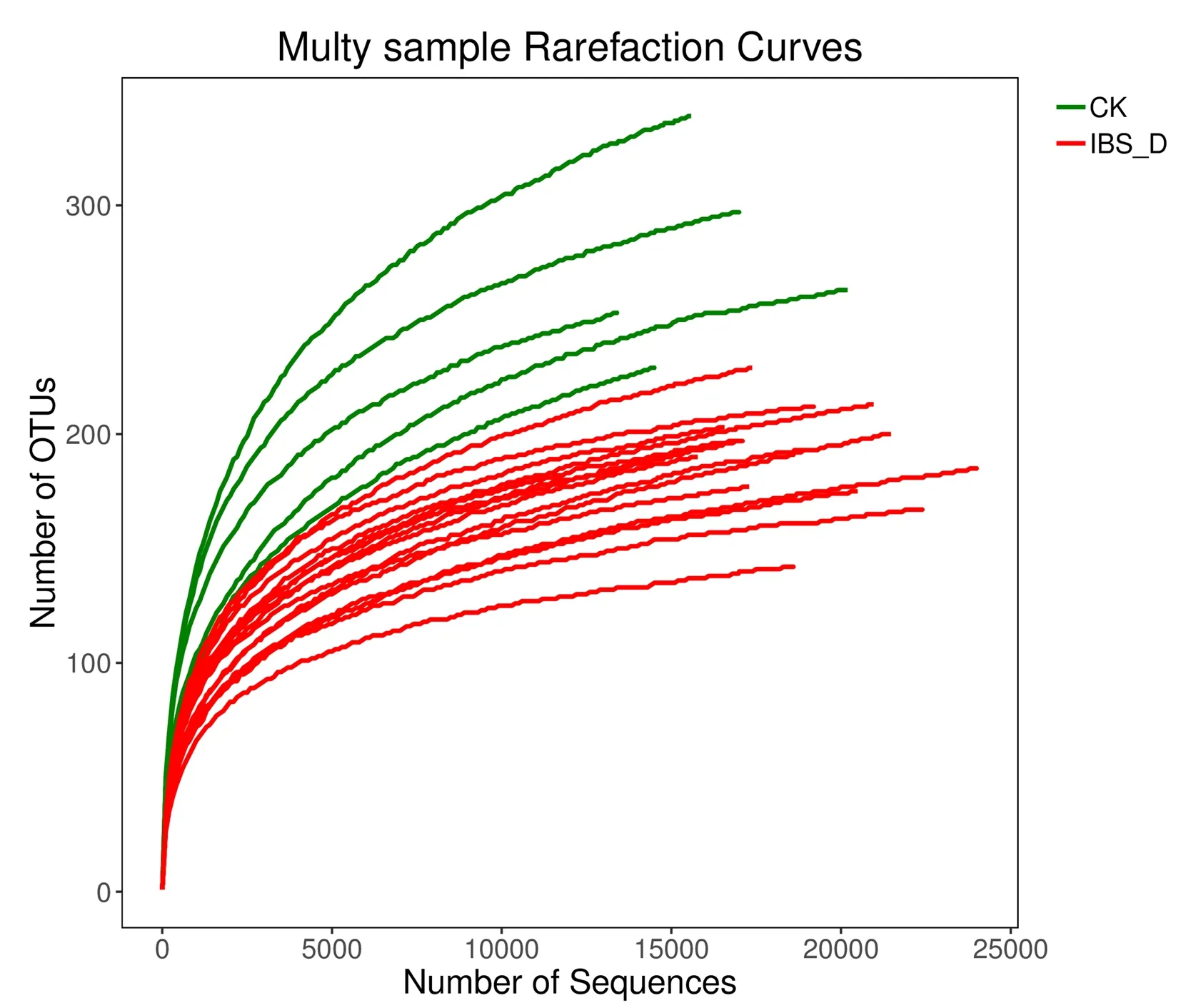
注:横坐标表示随机抽取的测序量,纵坐标表示OUT数值
3.3.2 脾虚型IBS-D小鼠和健康小鼠细菌的丰度、均匀度分析 为证明本次样品细菌的多样性达到实验要求,进行了丰度等级图(Rank-abundance)绘制。图3示,大部分样品曲线在水平方向较宽,下降趋势较平缓,可见20例样本中细菌丰度和均匀度皆较为合理。
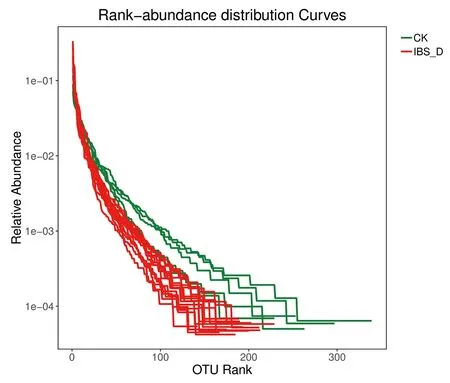
注:横坐标代表OTU数值,纵坐标表示OTU中序列数的相对百分含量
3.4 脾虚型IBS-D小鼠和健康小鼠之间细菌多样性比较
细菌多样性主要采用基于OTU聚类结果进行Alpha多样性(Alpha diversity)分析的方法,包括chao指数、ace指数、shannon指数以及simpson指数等。图4示,这20例样本中细菌的丰富度与多样性均较高,且曲线都进入平台期。
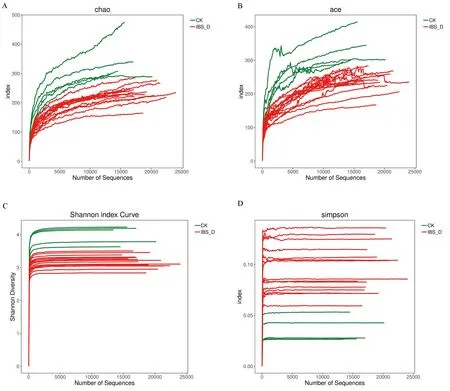
图4 20例样本肠道细菌的Alpha多样性分析
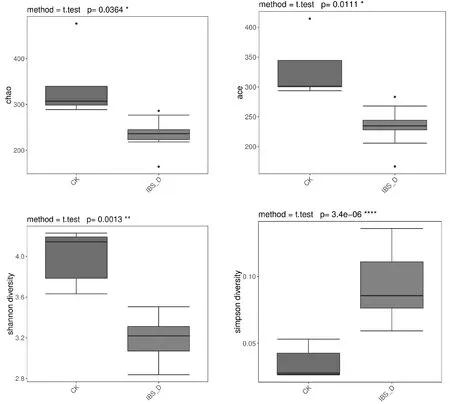
图5 20例样本肠道细菌Alpha多样性的差异性分析
3.5 脾虚型IBS-D小鼠与健康小鼠样本间肠道菌群的物种信息及差异分析
3.5.1 脾虚型IBS-D小鼠和健康小鼠肠道菌群在门水平上的分布及差异 表4示,对CK、IBS-D组的20个样本进行菌群结构与差异分析,发现2组小鼠肠道菌群的构成存在差异,且各菌门的构成比不同;与健康小鼠比较,脾虚型IBS-D小鼠拟杆菌门、Saccharibacteria、蓝藻门减少,变形菌门、疣微菌门增多(P均<0.05)。
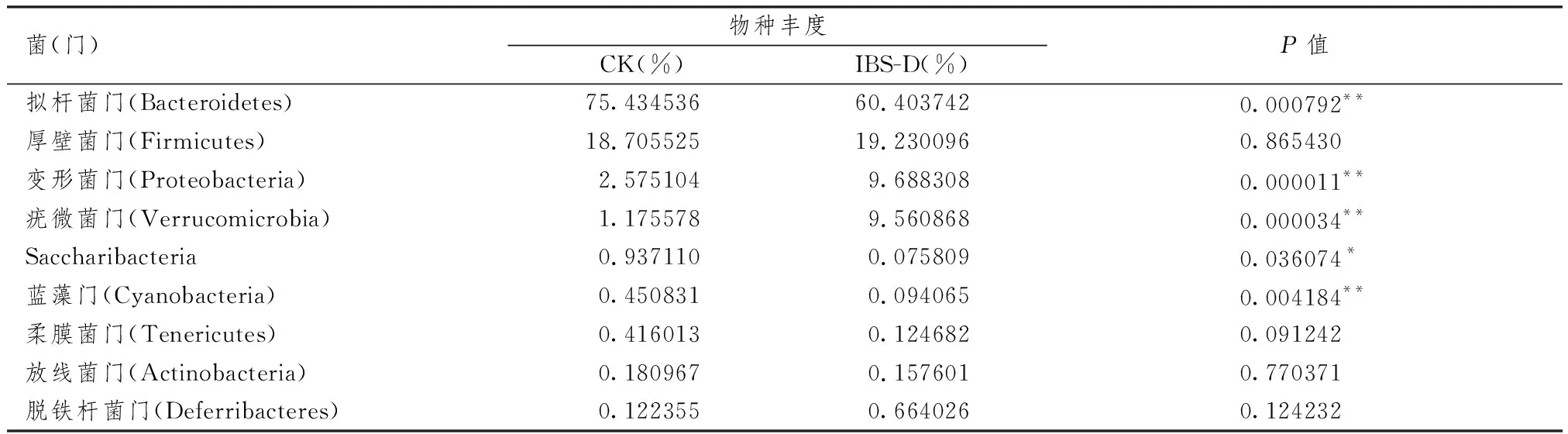
表4 脾虚型IBS-D小鼠与健康小鼠样本在门水平上物种相对丰度及差异分析
3.5.2 脾虚型IBS-D小鼠和健康小鼠肠道菌群在属水平上的分布及差异 表5示,本次实验共在小鼠粪便中检测出58种菌属,选取CK、IBS-D组样本中前27种优势菌群,分别统计其占比并绘制表格。结果发现,2组小鼠肠道菌群的构成存在差异,且各菌属的构成比不同。进一步进行物种差异分析可以发现,与健康小鼠比较,脾虚型IBS-D小鼠另枝菌属、乳酸菌属、理研菌属、Candidatus Saccharimonas、分节丝状菌属、瘤胃球菌属、脱硫弧菌属、Gelria减少,拟杆菌属、阿克曼菌属、Parasutterella、Lachnoclostridium、厌氧棍状菌属、Blautia、埃希氏菌属、Erysipelatoclostridium、Parabacteroides、克雷伯氏菌属、厌氧原体属、Flavonifractor、Candidatus Stoquefichus、Anaerostipes、Epulopiscium、沙雷氏菌属增多(P均<0.05)。
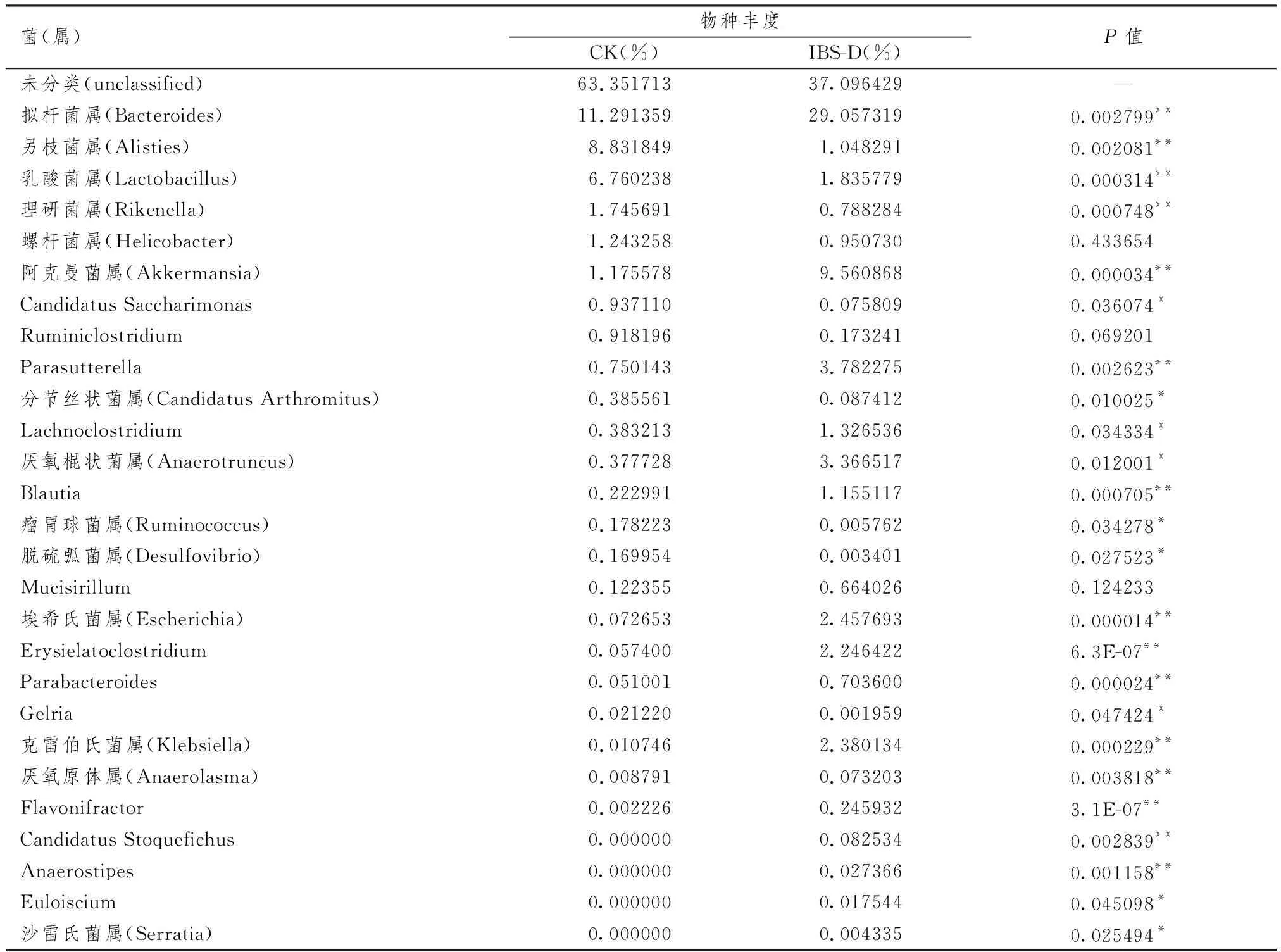
表5 脾虚型IBS-D小鼠和健康小鼠样本在属水平上物种的相对丰度及差异分析
3.5.3 脾虚型IBS-D小鼠和健康小鼠肠道菌群各分类差异性分析 表6图6示,为对脾虚型IBS-D小鼠和健康小鼠肠道菌群进行门、纲、目、科、属、种6个分类汇总分析,采用组间群落差异分析方法(LDA Effect Size)。
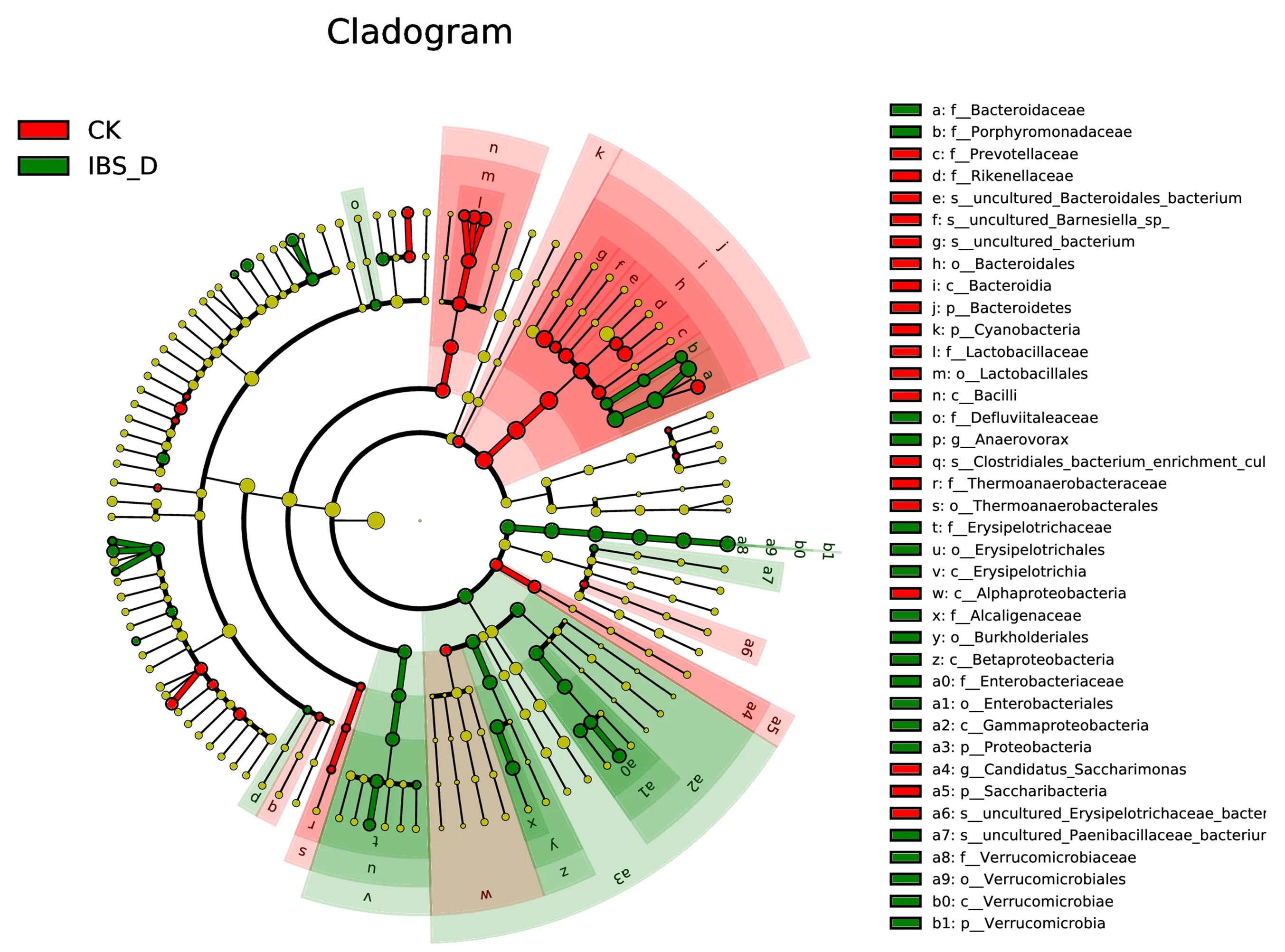
注:这个由内至外辐射的圆圈图为聚类树,依次代表由门、纲、目、科、属、种的分类级别。在不同圆圈层上的每一个小圆圈代表该水平下的一个分类,小圆圈的直径与该分类的相对丰度大小呈正比。该图中,红色区域表示CK组,绿色区域表示IBS-D组;树枝中红色、绿色节点分别表示在该组别中起到重要作用的微生物类群。图中英文字母表示物种名称在右侧图例中进行展示
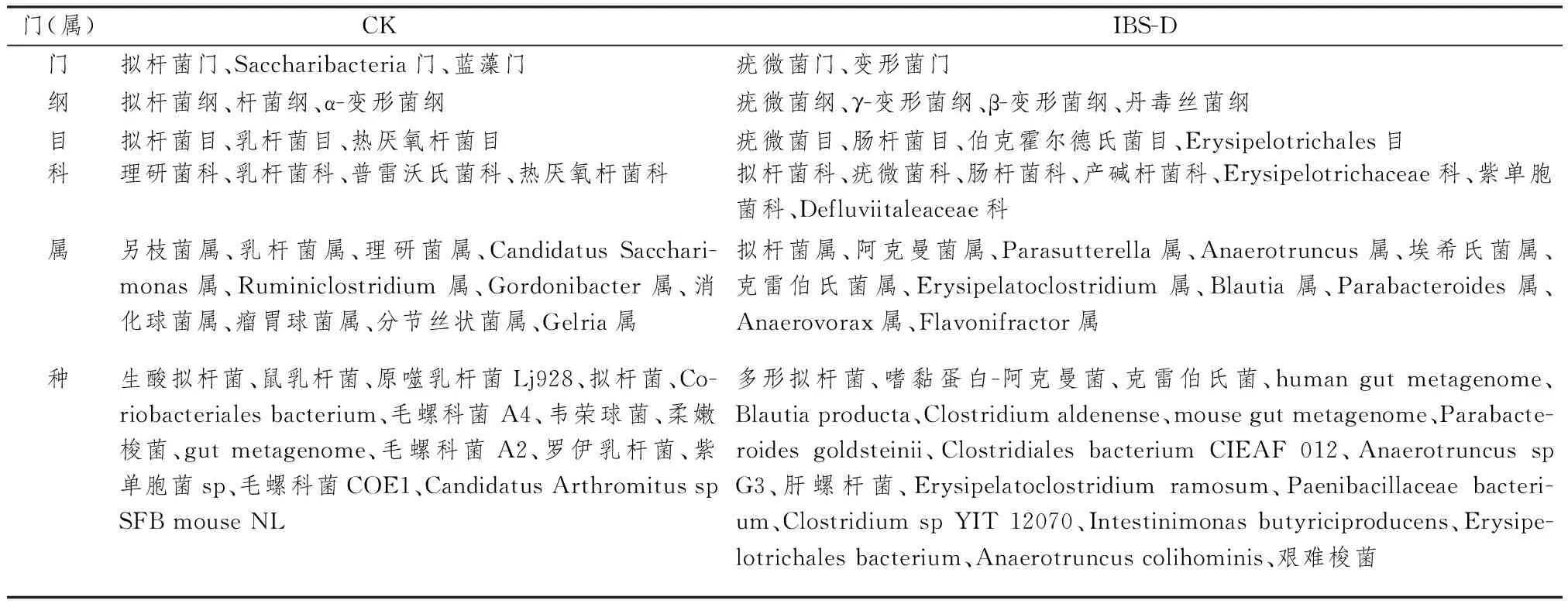
表6 脾虚型IBS-D小鼠与健康小鼠样本组间结构差异性分析
4 讨论
IBS-D 属于中医“泄泻”等范畴,古代医家早已认识到泄泻乃脾之功能失常所致。正如《素问·藏气法时论篇》曰:“脾病者,虚则腹满,肠鸣,飨泄,食不化。”现代医家亦对该疾病进行了中医证候探究,黄绍刚等[7]经聚类分析得知,IBS-D的主要证型为脾胃气虚证、肝郁脾虚证、脾肾阳虚证、脾胃湿热证;李梅等[8]认为, IBS 可分为脾胃虚弱、肝郁脾虚、肝脾不和、肝气郁结、脾胃湿热5型,可见脾胃虚弱及肝郁脾虚为IBS-D的常见证型,而此2型又以脾虚为基础。脾失健运,升降失调,水谷不化,清浊不分,混杂而下,形成泄泻。
IBS是一种常见的功能性胃肠道疾病,临床根据大便性状将其分为腹泻型、便秘型、混合型与未定型4种类型,其中腹泻型在我国发病率最高,是IBS最常见的类型[9]。近年来,越来越多的实验致力于肠道微生物群的研究,发现肠道菌群与IBS-D的关系密切。相关报道指出,一旦肠道菌群的动态平衡被打破,导致菌群失调,可能会引起肠道功能紊乱,从而导致IBS-D的发生[10]。
目前,学者们对脾虚型IBS-D肠道菌群的研究较为粗略,仅停留于较常见的数种细菌。江月斐等[11]发现,脾虚型IBS-D患者肠杆菌、肠球菌、酵母菌增多,双歧杆菌、乳杆菌、拟杆菌、消化球菌减少。张卫平等[12]指出,脾虚型泄泻小鼠类杆菌、肠球菌增多,肠杆菌、乳酸杆菌、双歧杆菌减少。
因此,为进一步观察脾虚型IBS-D小鼠肠道菌群的变化情况,此次研究对2组小鼠粪便进行了16S rDNA基因测序。结果发现与健康小鼠比较,脾虚型IBS-D小鼠的肠道菌群表现为大量有益菌的下降和有害菌的增加。
在门水平上发现,健康小鼠的拟杆菌门与厚壁菌门共占94.14%,而脾虚型IBS-D小鼠则占79.63%,较健康小鼠有所减少。报道指出,拟杆菌门与厚壁菌门不仅能够促进碳水化合物的代谢与能量的吸收[13],还能够生成肠道自由基清除剂及炎症调节因子,抑制肠道的氧化应激与炎症反应,有效阻止胃肠疾病的发生与发展[14]。Bennet SMP等[15]表明,厚壁菌门与拟杆菌门比值的升高会引起肠道免疫活性的改变,从而导致IBS-D的发生。本次研究发现该比值升高了7.03%,与文献报道相一致。变形菌门是细菌中最大的一门,包括大肠杆菌、沙门氏菌、霍乱弧菌等致病菌。报道指出,健康人肠道中变形菌门丰度较低,而在一些致病因素的作用下会诱发其大量增殖,产生促炎因子引起肠道炎症[16]。Durbán A等[17]通过研究IBS-D患者肠道菌群的不稳定性发现,急性腹泻的发生可能与变形菌门相关。本次研究发现,脾虚型IBS-D小鼠变形菌门增多,提示该菌门的增多与脾虚型IBS-D有一定的相关性。
在属水平上发现,另枝菌属隶属于理研菌科、拟杆菌目、拟杆菌纲、拟杆菌门。漆靖等[18]指出,另枝菌属的减少能够使肠道通透性增加,导致肠道的炎症。本实验发现,脾虚型IBS-D小鼠另枝菌属减少,提示该菌属丰度的下降或与本疾病的发生发展相关。乳酸菌属隶属于乳酸菌科、乳酸菌目、芽孢杆菌纲、厚壁菌门,是益生菌的重要组成部分,对宿主具有促进消化、提升免疫力和抑制病原菌生长的益生特性[19]。本次实验发现,脾虚型IBS-D小鼠乳酸菌属减少,与以往研究结论相一致。理研菌属隶属于理研菌科、拟杆菌目、拟杆菌纲、拟杆菌门,徐航宇等[20]研究表明,溃疡性结肠炎大鼠肠道菌群中理研菌属丰度较高,其在该疾病的活动期发挥重要作用;而本次研究发现,脾虚型IBS-D小鼠理研菌属减少,两者结论不相符,尚待进一步探究。阿克曼菌属隶属于疣微菌科、疣微菌目、疣微菌纲、疣微菌门,Derrien M等[21]发现,其具有降低黏蛋白的作用,能够破坏黏液层的完整性,从而破坏肠道黏膜屏障,导致IBS-D的发生。本次实验发现,脾虚型IBS-D小鼠肠道中该菌属增多,表明阿克曼菌属可能与该疾病存在关联。Chen YJ等[22]研究表明,IBS-D患者肠道菌群中Parasutterella显著增加,指出该菌属与慢性肠道炎症相关,并认为其与IBS-D的发生发展有关。本实验结果与之相符。
在种水平上发现,柔嫩梭菌隶属于梭菌属、梭菌科、梭菌目、梭菌纲、厚壁菌门,是肠道内重要的有益菌,可促进肠系膜的修复,增强机体的免疫力,抑制炎症因子的形成[23]。Lopez-Siles M等[24]指出,IBS患者体内的柔嫩梭菌低于健康人。本研究亦发现,脾虚型IBS-D小鼠柔嫩梭菌减少,其为健康小鼠肠道中的优势菌群,与文献报道相一致。艰难梭菌隶属于梭菌属、梭菌科、梭菌目、梭菌纲、厚壁菌门,其主要通过产生毒素A、毒素B、二元毒素致病,从而导致腹泻或伪膜性结肠炎[25]。本次实验亦发现,脾虚型IBS-D小鼠肠道中艰难梭菌增多,表明艰难梭菌或与脾虚型IBS-D的发生发展相关。
本研究提示,16S rDNA测序技术能够满足小鼠肠道微生态的研究需求。尽管本次实验样本数量较少,但已基本阐明脾虚型IBS-D小鼠与健康小鼠的肠道菌群比较已发生明显的偏移。与健康小鼠比较,脾虚型IBS-D小鼠肠道菌群的丰富度与多样性均降低。在门、纲、目、科、属、种6个分类水平上,2组小鼠的菌群构成及构成比皆存在差异,脾虚型IBS-D小鼠表现为大量有益菌的下降、有害菌的增加。由于本研究受客观条件的限制,并未对脾虚型IBS-D小鼠菌群改变的具体因果关系进行研究,未来可加大样本数量进一步分析探讨。
