1 株宽宿主谱的阪崎肠杆菌噬菌体生物特性分析及其在乳制品中的应用
2021-03-31李虹娇黄梓聪吴希阳唐书泽
李虹娇,黄梓聪,吴希阳,丁 郁,唐书泽
(暨南大学理工学院,广东 广州 510632)
阪崎肠杆菌(Cronobacter sakazakii)是一种食源性致病菌,其主要感染源为婴幼儿配方乳粉。近年来,世界各地多次发现婴幼儿配方乳粉中阪崎肠杆菌的污染事件。2014年,国家食品药品监督管理总局对国内100 家乳粉生产企业的全部婴幼儿配方乳粉产品和部分进口产品进行抽样检验,不合格的批次占到了3.07%,涉及国内生产婴幼儿配方乳粉企业和4 家进口乳粉经销商[1]。2018年,欧盟食品饲料类快速预警系统通报,荷兰一婴儿配方乳粉生产企业在自检中发现使用了一批疑似受到阪崎肠杆菌污染的乳清粉,导致3 个品牌、5 个批次的婴儿配方乳粉存在阪崎肠杆菌污染风险[3]。由于其感染婴儿后有极高的病死率[2],引起广泛关注。阪崎肠杆菌对温度、酸碱都有较高耐受性,有研究表明其在pH 1.18及72 ℃均有较高的存活率[3-4],并且阪崎肠杆菌容易获得抗生素耐药性[5],使其在乳粉加工过程中增加了污染的可能性和控制的难度。因此,寻求有效方法控制阪崎肠杆菌在食品加工过程中的污染非常必要。
噬菌体是专门感染细菌的一类病毒,具有严格的宿主特异性[6-7],其抑菌作用安全可靠,因此其可作为一种安全控制细菌污染的有效方式。近年来,国内外关于噬菌体在食品中对不同食源性致病菌控制的有关研究多有报道[8-9],其中包括杀灭食品中的沙门氏菌[10-11]、单核细胞性李斯特菌[12]以及金黄色葡萄球菌[13]的噬菌体。相比之下,对阪崎肠杆菌噬菌体的研究较少,尤其在食品应用领域。Kim等[14]最早分离出2 株阪崎肠杆菌噬菌体,在此之后,有研究将阪崎肠杆菌噬菌体应用于婴幼儿配方乳粉中抑制宿主菌生长[15-17]。噬菌体在乳制品中的应用仅仅表现为对宿主菌杀灭效果的评估,鲜见其可以裂解除宿主以外的阪崎肠杆菌。在国内,目前仅有赵贵明等[18]分离出多株阪崎肠杆菌噬菌体,但没有在食品中对其杀菌效力的评估的报道。本研究通过从河涌水中分离和筛选出能裂解多株阪崎肠杆菌的烈性噬菌体,观察分析其生物学特性并将其应用于乳制品中抑制2 种不同的菌,旨在为阪崎肠杆菌的生物防控提供理论依据。
1 材料与方法
1.1 材料与试剂
样本取自广东广州天河区河涌污水,阪崎肠杆菌菌株及来源:ATCC25944、ATCC12868来自广东海关;ATCC29004、ATCCBAA894、12-2、18-7、18-13、18-8、14-15来自西北农林科技大学。
LB肉汤培养基、LB琼脂培养基 广东环凯微生物科技有限公司;DNaseI、RNaseA 上海碧云天生物技术有限公司;EcoRII酶 美国Thermo Fisher Scientific公司;蛋白酶K 德国Merck公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS) 天津大茂化学试剂厂;乙酸钠(3 mol/L,pH 5.0,无菌) 北京冬歌博业生物科技有限公司。
营养琼脂半固体培养基为LB肉汤培养基中添加0.5%琼脂配制而成;SM缓冲液由10 mol/L Tris-HCl(pH 7.5)、100 mol/L NaCl、10 mol/L MgSO4组成,使用时,121 ℃高温灭菌20 min,4 ℃保存备用。
1.2 仪器与设备
ST16R大型冷冻高速离心机 美国Thermo公司;5417R小型冷冻高速离心机 德国Eppendorf公司;M200PRQ酶标仪 瑞士Tecan公司;7000FA100 KV透射电子显微镜 日本日立高新技术公司。
1.3 方法
1.3.1 阪崎肠杆菌噬菌体分离与纯化
参照赵贵明等[18]的方法,取广州市天河区河涌污水样品100 mL,进行过滤去除污水中的杂质,加入阪崎肠杆菌ATCC25944过夜培养物6 mL,37 ℃培养过夜。培养液经过0.45 μm的无菌滤膜过滤除菌。取滤液20 μL滴加到双层平板上,于37 ℃培养3~4 h后观察空斑。取双层平板上透亮、宽直径的琼脂块加入5 mL SM缓冲液中,放入4 ℃过夜,次日7 012×g、4 ℃离心10 min。将上清液用0.45 μm无菌滤膜过滤除菌。取滤液100 μL加入10 mL LB肉汤中,再加入500 μL宿主菌液混匀,37 ℃培养4~5 h,之后将培养液7 012×g、4 ℃离心10 min,将其依次用0.45 μm与0.22 μm滤膜过滤,滤液分装4 ℃备用。之后取上述滤液100 μL适当稀释,与宿主菌做双层平板,得到单个噬菌斑。重复3~5 次直至获得大小形态一样的噬菌斑。
1.3.2 噬菌体浓缩
将噬菌体原液加入到超滤管(15 mL 100 kDa Millipore)中,4 ℃、5 000×g离心20 min,用SM缓冲液少量反复冲洗滤膜,将洗脱液置于4 ℃,用于DNA提取与电镜观察。
1.3.3 噬菌体基因组提取及酶切
参照Higuera等[19]的核酸提取方法,取浓缩噬菌体样品1 mL于2 mL离心管中,加入40 μL DNaseI(10 mg/mL)和20 μL RNaseA(10 mg/mL),振荡混匀,于37 ℃水浴加热30 min,之后加入3 μL蛋白酶K(25 g/L),振荡混匀,65 ℃水浴加热15 min,加入20% SDS至终质量分数为5%,振荡混匀,65 ℃水浴加热45 min,用苯酚-氯仿(1∶1)溶液抽提上述溶液,抽提直至中间没有明显白色蛋白层之后,加入-20 ℃预冷的2 倍体积无水乙醇以及1/10体积的乙酸钠溶液(3 mol/L,pH 5.0),在-20 ℃沉淀30 min,9 600×g、4 ℃离心5 min,去掉上清液,用70%乙醇溶液洗涤沉淀,轻轻倒去上清液并用干净的吸水纸吸去水分,空气中晾干,将其溶于TE溶液中。提取的核酸用EcoRI限制性核酸内切酶进行酶切,对酶切产物以1%的琼脂糖凝胶做电泳分析。可根据酶切结果计算噬菌体基因组大小。
1.3.4 噬菌体最佳感染复数(multiplicity of infection,MOI)测定
分别按照MOI为1 000、100、10、1、0.1、0.01、0.001、0.000 1将噬菌体与对数期早期的相应宿主菌分别加入到LB肉汤培养基中,37 ℃、130 r/min培养3.5 h,10 956×g离心10 min,取上清液作噬菌体效价测定[20-21]。实验重复3 次,每次设2 个平行。
1.3.5 噬菌体一步生长曲线测定
将噬菌体与宿主菌按照最佳MOI(MOI=0.001)加入到LB肉汤中,37 ℃吸附培养20 min之后, 18 516×g离心10 min,用LB肉汤洗涤沉淀2 次之后,将其倒入37 ℃预热的LB肉汤培养基中,充分混匀重悬沉淀,迅速置于37 ℃、130 r/min的摇床上,每隔10 min取样,18 516×g离心2 min,取上清液测定效价[22-23]。实验重复3 次,每次设2 个平行。
1.3.6 电镜观察
采用磷钨酸染色法[24],轻取铜网,先浸没于高效价噬菌体原液中10 min,之后用滤纸吸去多余液体。再将铜网置于2%的磷钨酸染料中染色10 min,吸去多余液体,自然晾干至完全干燥。在透射电镜100 kV下观察噬菌体形态。
1.3.7 宿主谱测定
取噬菌体原液20 μL直接滴到已经铺好宿主的双层平板上,待其晾干后,置于37 ℃培养箱培养3~4 h,之后观察是否有透亮噬菌斑产生。
1.3.8 噬菌体温度稳定性测定
将100 µL噬菌体原液109PFU/mL置于无菌EP管中,在40、50、60、70、80 ℃的水浴中,分别作用15、30、45、60 min,处理时间结束后,迅速取出样品置于4 ℃冰箱,冷却后测效价。实验重复3 次,每次设2 个平行。
1.3.9 噬菌体pH值稳定性测定
取100 μL噬菌体原液108PFU/mL于1.5 mL离心管中,分别加入900 μL不同pH值(2、3、4、5、6、7、8、9、10、11)的SM缓冲液中,40 ℃水浴2 h,处理时间结束后测定噬菌体效价。实验重复3 次,每次设2 个平行。
1.3.10 噬菌体对宿主裂解效力的测定
噬菌体与宿主按照不同的MOI(10、100、1 000)各取100 μL加入96 孔板中。另设空白为200 μL的LB肉汤培养基;对照组为100 μL的宿主菌液与100 μL的LB肉汤。将其置于37 ℃、130 r/min温育,每隔1 h测定其在600 nm波长处的吸光度,总共测定6 h。
1.3.11 噬菌体在牛乳与乳粉中对不同宿主杀菌效力测定
从超市购买脱脂乳粉和脱脂牛乳,按照包装上的说明用无菌水溶解脱脂乳粉。参照Kim等[14]方法,在乳粉与牛乳样品中加入对数增长期的2 种菌至终浓度为102CFU/mL,按照MOI为106加入噬菌体,同时在对照组中加入等量的无菌水。将样品置于25 ℃与37 ℃、130 r/min温育。每隔3 h取出等分试样进行细菌计数(CFU/mL)。实验重复2 次,每次设2 个平行。
1.3.12 噬菌体全基因组测序和分析
采用Illumina MiSeq测序平台进行噬菌体全基因组测序。应用软件SPAdes v3.9.0对原始测序数据进行从头拼装,构建scaffold和conting。使用GeneMarkS(http://exon.gatech.edu/GeneMark/)对全基因组序列进行基因预测。使用在线BLASTp工具进行蛋白编码基因的功能注释,并采用Easyfig软件进行比对分析和绘图。
1.4 数据统计及图表绘制
数据采用SPSS显著性差异分析方法(P<0.05,差异显著),运用Origin软件进行绘图与分析。
2 结果与分析
2.1 噬菌体分离与宿主范围测定结果

表 1 噬菌体宿主范围Table 1 Host ranges of phages isolated in this study
从河涌污水中利用阪崎肠杆菌为宿主分离出3 株噬菌体,分别命名为TBC-1、TBC-2、TBC-3。将3 种噬菌体进行宿主范围测定,结果显示TBC-1可以裂解所有9 株阪崎肠杆菌宿主菌(表1),TBC-3可以裂解其中7 株,TBC-2只能裂解其中5 株,证明TBC-1的宿主谱较为宽泛。因此选择其进行深入研究。
2.2 TBC-1分离与纯化
TBC-1经过3 次分离纯化后,在双层平板上形成了规则透明、直径约2~3 mm的透亮噬菌斑,如图1A所示;其头部呈二十面体,有一条可收缩性尾(图1B)。根据国际病毒分类委员会(International Committee on Taxonomy of Viruses,ICTV)对噬菌体的分类判断,此噬菌体属于肌病毒科(Myoviridae),尾状病毒属。表2为噬菌体头部及尾部尺寸。
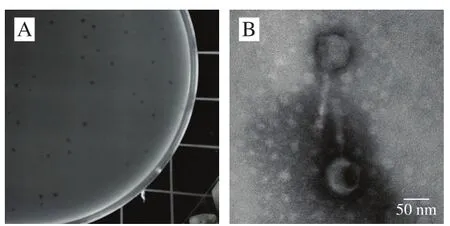
图 1 噬菌体噬菌斑(A)及电镜形态(B)Fig. 1 Plaques (A) and transmission electron microscopic image (B) of phage TBC-1

表 2 噬菌体各部分尺寸及所属病毒科Table 2 Morphology and dimensions of phage TBC-1 and its family
2.3 噬菌体基因组
将所提取的基因组用限制性核酸内切酶EcoRI酶进行酶切,见图2。基因组可被该限制性核酸内切酶切成8 条带,可推断该噬菌体核酸组成为dsDNA。根据酶切条带与DNA Marker的关系,初步估算该噬菌体基因组分子长度为50 kb。其确切的分子长度通过后续全基因组测序实现。

图 2 DNA酶切图谱Fig. 2 Restriction enzyme digestion patterns of phage DNA
2.4 噬菌体最佳MOI及一步生长曲线分析
由图3A可知,当MOI为0.001时,噬菌体感染宿主后产生的子代噬菌体滴度为6.48×109PFU/mL,是所测的8 个MOI中滴度最高的,因此可将0.001确定为最佳MOI。
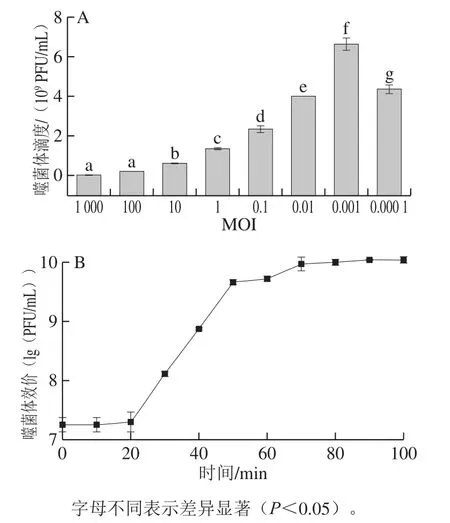
图 3 最佳MOI(A)及一步生长曲线(B)Fig. 3 Optimal MOI (A) and one-step growth curve (B)
由图3B可知,在0~20 min,曲线保持平稳,可判断噬菌体潜伏期为20 min,在之后的20~70 min噬菌体效价急速增加,在70 min后,噬菌体效价逐步趋于稳定,可判断噬菌体爆发期为50 min。效价稳定在1010PFU/mL左右,爆发量为100 PFU/cell。
2.5 噬菌体的温度及pH值稳定性分析
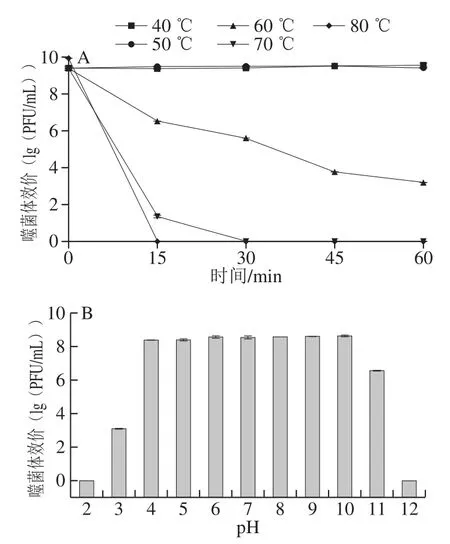
图 4 噬菌体的温度(A)及pH值(B)稳定性Fig. 4 Thermal stability (A) and pH stability (B) of TBC-1
如图4A所示,噬菌体在40、50 ℃温育1 h效价基本维持稳定状态且仍然保持原有的活性。在60 ℃作用1 h内,效价持续下降但未完全失活。在70 ℃作用15 min后,噬菌体效价下降到20 PFU/mL;30 min之后,噬菌体完全失活。在80 ℃作用15 min后,噬菌体已经完全失活。说明高温处理会严重影响噬菌体活性。如图4B所示,噬菌体在pH值在4~10之间时,效价较稳定,基本能保持原活性。当pH值高于10或低于4时,噬菌体效价下降,并且在pH值高于11且低于2时,噬菌体会完全失活。以上说明过酸过碱都会导致噬菌体活性降低,甚至失活。
2.6 不同MOI噬菌体对宿主裂解效力的影响
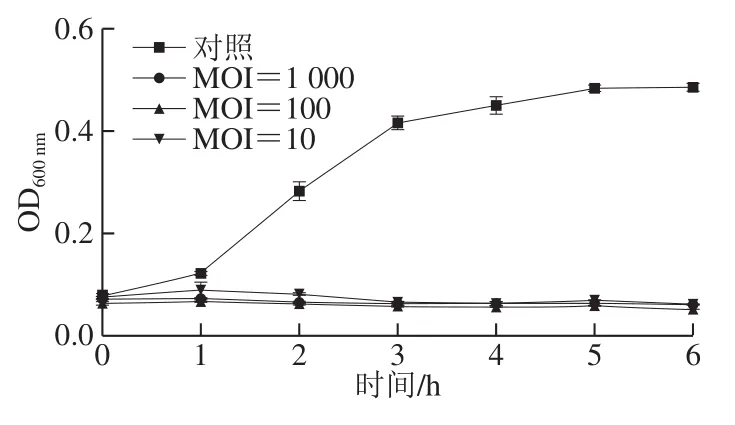
图 5 不同MOI噬菌体裂解曲线Fig. 5 Lysis curves of TBC-1 at different MOIs
如图5所示,与未加噬菌体的对照组相比,TBC-1在6 h内不同的MOI值下均可以抑制阪崎肠杆菌的生长,MOI为1 000相比MOI为100、10的宿主生长较慢,因此抑制效果更好,表明噬菌体滴度的增加会使得其对宿主的抑制作用更强。
2.7 全基因组测序结果分析
噬菌体TBC-1的全基因组长度为85 313 bp,基因组为双链DNA。GeneMarks基因预测结果显示共有118 个开放阅读框(open reading frame,ORF),全部ORF共含有74 532 bp碱基,平均GC含量为40.65%;采用tRNAscan-SE预测显示有24 个tRNA。BLASTn分析结果可知TBC-1与Enterobacterphage phi 63 307(MG 589384.1)的基因同源性为98.06%。用Easyfig软件将这2 种噬菌体进行比对,结果见图6。
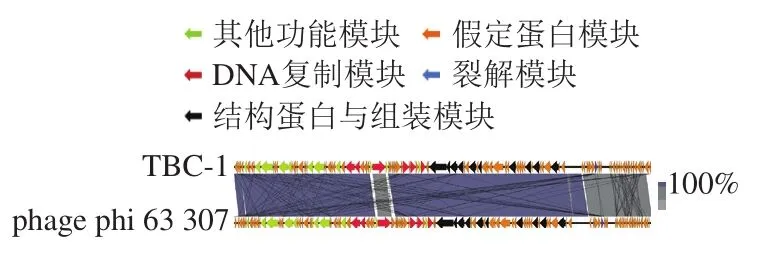
图 6 TBC-1与phage phi 63 307全基因序列的比对Fig. 6 Comparison between the complete genome sequences of TBC-1 and phage phi 63 307
2.8 噬菌体TBC-1在牛乳与乳粉中对两种阪崎肠杆菌的杀菌应用
噬菌体TBC-1抑制阪崎肠杆菌ATCC25944实验中,脱脂液态牛乳环境下(图7A),25 ℃时,对照组的阪崎肠杆菌在12 h内呈现稳步增殖。实验组在培育3 h后菌量下降2(lg(CFU/mL))(检出限以下),之后的9 h内一直在检出限以下,抑菌效果较好;37 ℃时,实验组培育3 h后,菌量下降到检出限以下,但在此之后宿主菌再生长,第12小时菌量增加到(4.42±0.02)(lg(CFU/mL)),相比于菌量持续增加的对照组降低了约4(lg(CFU/mL))。图7B显示,在脱脂乳粉样品的杀灭宿主实验中,25 ℃时,与对照组相比,实验组的菌量在3 h之后一直处于检出限以下,抑菌效果好。37 ℃时,对照组最终菌量达到(8.74±0.06)(lg(CFU/mL)),而实验组的菌量持续缓慢增加,第12小时的菌量为(5.39±0.12)(lg(CFU/mL)),相比较对照组降低了约3(lg(CFU/mL))。

图 7 噬菌体在不同乳制品、不同宿主及不同温度下的裂解曲线Fig. 7 Lysis curves of the bacteriophage in different dairy products at different temperatures
TBC-1对ATCCBAA894的抑制实验中,脱脂液态牛乳中(图7C),在25 ℃与37 ℃时,对照组的阪崎肠杆菌在12 h内持续增长。实验组培育3 h后菌量下降到检出限以下并在之后9 h内保持在检出限以下,抑菌效果好;在脱脂乳粉的抑菌实验中,25 ℃时,实验组培育3~12 h内,菌量一直处于检出限以下,有较好的抑制效果。37 ℃时,实验组菌量持续缓慢增加,12 h的菌量为(5.65±0.07)(lg(CFU/mL)),比对照组降低约3(lg(CFU/mL))。
3 讨论与结论
噬菌体作为一种裂解细菌病毒,具有较多优势:噬菌体可以在宿主所在地方进行繁殖[25],并且具有高度特异性,只可以裂解特定菌株,因此它们对环境中的其他微生物群无害[26],此外,噬菌体只有在宿主存在时才能存活,当所有宿主都被裂解后,噬菌体在体内会自动被免疫系统清除[27]。噬菌体可以通过和其他噬菌体混合使用,借此扩大其裂解的宿主范围[28]。并且,噬菌体可以随细菌的进化而对自身进行修饰,使其具有裂解耐药菌的能力[29]。本研究以ATCC25944阪崎肠杆菌菌株为指示菌,从污水中分离出1 株噬菌体。通过对噬菌斑形态、噬菌谱测定、热稳定性、pH值稳定性、最佳MOI及一步生长曲线等对阪崎肠杆菌噬菌体TBC-1的生物学特性进行了研究,结果表明,分离的噬菌体TBC-1能形成2~3 mm的圆形透亮噬菌斑。该噬菌体头部呈二十面体,具有可收缩尾部,符合肌尾病毒科的特征[30]。此外,该噬菌体的最佳MOI为0.001,在Kim等[14]研究中,分离的阪崎肠杆菌噬菌体的最佳MOI为1,证明本研究分离的噬菌体TBC-1具有更高的裂解效率。TBC-1在50 ℃作用1 h依旧保持高滴度,并且在pH 4~10之间保持原始滴度不变,因此该噬菌体具有较宽的温度和酸碱度适用范围,其耐酸碱能力和耐热性可为其实际应用提供参考[31]。噬菌体的一步生长曲线可以反映其裂解能力,本研究中噬菌体潜伏期较短(20 min),爆发期适中(50 min),爆发量较高(100 PFU/cell),在短时间内完成裂解过程,在实际中可用于快速地生产应用。该噬菌体对实验室已有的不同株阪崎肠杆菌均有强裂解效果,是1 株宽宿主谱的噬菌体。在不同MOI下对宿主裂解效力的测定实验中,无论是高MOI还是低MOI,TBC-1对宿主菌均显示出有效的抑制作用,并且高MOI条件下的抑制效果更好。Goode等[32]研究不同MOI对杀灭鸡皮中的沙门氏菌与弯曲肠杆菌的效果,结果发现高MOI会更快速地杀灭沙门氏菌。因此,在之后的应用实验中可选用高MOI对宿主进行侵染。此外,由全基因序列比对图可知,TBC-1与Enterobacterphage phi 63 307(MG 589384.1)的基因同源性较高,这两株噬菌体可能为同种噬菌体。
本研究采用MOI为106的噬菌体在乳制品中杀菌效果进行评估。噬菌体应用于乳制品杀灭ATCC25944的实验中,TBC-1在25 ℃时的杀灭宿主效果更好,这可能是因为37 ℃为阪崎肠杆菌的最适生长温度,细菌增长快于25 ℃的生长速度,导致细菌生长速度快于噬菌体对宿主的裂解速度。由此可见,温度是影响噬菌体杀菌效果的重要因素之一。Kim等[14]选用了噬菌体ESP732-1的MOI为107、108以及109进行阪崎肠杆菌污染的乳粉的杀菌实验,分别在24 ℃与37 ℃进行温育,在37 ℃也出现了宿主再生长的情况。在脱脂乳粉中,实验组在25 ℃培育3 h以后已经检测不到宿主菌,然而与脱脂牛乳样品中不同的是,在37 ℃条件下,实验组阪崎肠杆菌在12 h之内一直呈现增长趋势,但是相比于对照组的宿主菌增长缓慢,最终实验组的菌量比对照组少约3 个数量级。这可能是因为在乳粉中有影响噬菌体的杀菌效果的因素存在,由此可见,不同的食品基质对噬菌体的杀菌效果也有影响。ATCCBAA894抑菌实验中,与指示菌不同的是,在脱脂牛乳中,TBC-1在25 ℃与37 ℃抑菌效果相当,实验组菌量在3 h以后均已经在检出限以下,由此可见,尽管ATCCBAA894不是指示菌,但TBC-1对其杀菌效果更好。此外,报道显示通常阪崎肠杆菌在乳粉中的污染量均小于1 CFU/100 g[33]。本实验中加入乳粉中的宿主菌终浓度为102CFU/mL,相当于113 636 CFU/g的污染量,其远高于实际生产中的阪崎肠杆菌的污染量。
本研究显示TBC-1作为一种天然抗菌剂,表现出较强的温度稳定性和酸碱稳定性,不仅在阪崎肠杆菌的高污染量下表现出较好的抑制作用,而且对非指示菌抑制效果也较好。因此可以用来控制乳制品中阪崎肠杆菌的污染,为该噬菌体作为抗菌剂的应用奠定实验基础。
