桉叶多酚提取物体内外抗氧化活性评价
2021-03-31叶嘉宜陈运娇
李 伟,叶嘉宜,陈运娇,曹 庸
(华南农业大学食品学院,广东省功能食品活性物重点实验室,广东省天然活性物工程技术研究中心,广东 广州 510642)
正常情况下,细胞内抗氧化物质和氧化物质呈动态平衡;当机体受到氧化应激后,细胞在新陈代谢的过程中会产生过量自由基,引起机体损伤。自由基与炎症、衰老等多种疾病模型密切相关[1]。多酚作为植物体内重要的次生代谢产物,能有效清除自由基[2];此外,植物多酚被证实能有效预防高血脂、心脑血管等疾病[3],还能降低癌症等患病风险[4],因而逐渐受到人们的重视。
桉树是桃金娘科桉属植物的统称,原产于澳大利亚,现广泛分布于热带和亚热带地区[5];我国桉树人工种植林主要分布在广东、广西、云南、四川、海南等省。作为桉树副产物,桉叶年产量大但利用率低,除了部分用于提取精油,大部分被废弃或焚烧。有研究指出桉叶中含有酰基酚类及其衍生物、黄酮类化合物、鞣质、三萜类及其苷类以及部分未知高活性化合物[6],具有抗氧化、抗炎、抗菌等多种生物活性[7-8]。基于桉叶多酚提取物资源广泛且活性显著,日本已将其应用于食品添加剂和化妆品中[9]。本实验室前期已鉴定出桉叶多酚提取物中重要的抗氧化活性物质,包括月见草素B、1,2,3,4,6-五没食子酰基葡萄糖及特里马素等[10];桉叶多酚提取物在体外具有良好清除自由基能力[11],体内实验也表明其能有效提高血清中抗氧化酶[12]。桉叶多酚提取物中多酚类物质和月见草素B含量对抗氧化能力至关重要,这一推测与Amakura等[13]研究一致。因此,对桉叶多酚提取物进行分离纯化,提高粗提物中多酚类物质及月见草素B含量对改善其抗氧化活性具有重要意义。然而,现有报道多是采用单一方法对桉叶多酚提取物进行功效评价,评价方法不系统且没有纯化后桉叶多酚的活性研究。为了系统准确地评价桉叶多酚提取物抗氧化活性,本实验采用传统的化学评价方法,并建立氧化损伤RAW264.7巨噬细胞模型,结合秀丽隐杆线虫(以下简称线虫)模型,全面评价纯化后桉叶多酚抗氧化能力,为桉叶多酚提取物开发成功能性食品或食品抗氧化剂提供理论依据。
1 材料与方法
1.1 动物、材料与试剂
野生型秀丽隐杆线虫品系(基因型N2)购于美国明尼苏达大学线虫种质中心。
桉叶采集于广东省茂名市宝圩镇;RAW264.7巨噬细胞购于中国科学院典型培养物保藏委员会昆明细胞库。
DMEM 高糖培养基美国Hyclone 公司;胎牛血清、双抗(青霉素和链霉素)、磷酸盐缓冲液(phosphate buffered saline,PBS)美国Gibco公司;噻唑蓝(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT)、抗坏血酸及H2O2美国Sigma公司;丙二醛(malondialdehyde,MDA)、还原型谷胱甘肽(glutathione,GSH)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、总超氧化物歧化酶(total superoxide dismutase,T-SOD)及过氧化氢酶(catalase,CAT)试剂盒 南京建成生物工程研究所;其余试剂均为分析纯。
1.2 仪器与设备
AL401电子天平瑞士Mettler Toledo公司;FD-1型冷冻干燥机北京博医康技术公司;LC-15C高效液相色谱仪日本岛津公司;SMZ-T4连续变倍体视显微镜重庆奥特光学仪器有限公司;SWCJ-A超净工作台上海浦东荣丰科学仪器有限公司;EnSpire酶标仪美国PerkinElmer公司。
1.3 方法
1.3.1 桉叶多酚提取物制备及纯化
准确称取100 g桉叶粉末,以体积分数70%乙醇溶液为提取溶剂,按料液比1∶7(m/V)在50 ℃条件下搅拌提取2 h,提取2 次。将两次提取液合并后浓缩,真空冷冻干燥成粉,得桉叶多酚提取物。再将得到的桉叶提取物配制成200 mg/mL,4 ℃下冷藏8 h,除去下层沉淀;再以乙醇-乙酸乙酯体系(2∶98,V/V)萃取5 次,保留下层液;再以乙醇-乙酸乙酯(30∶70,V/V)萃取5 次后,将上清液浓缩干燥后可得纯化后的桉叶多酚提取物(以福林-酚法测定总多酚含量,高效液相色谱法[7]检测多酚组成)。参照GB 5009.5—2016《食品中蛋白质的测定》、GB 5009.6—2016《食品中脂肪的测定》、GB 5009.4—2016《食品中灰分的测定》分别检测纯化后桉叶多酚提取物粗蛋白、粗脂肪及灰分质量分数。
1.3.2 桉叶多酚提取物体外抗氧化活性测定
1.3.2.1 DPPH自由基清除能力测定
参考Kumaran等[14]的方法,评价桉叶多酚提取物DPPH自由基清除率。将桉叶多酚提取物配成不同质量浓度(0.025~0.4 mg/mL)储备液。取0.2 mL不同质量浓度桉叶多酚提取物溶液和3.8 mL DPPH溶液(1×104mol/L)混匀,暗处反应30 min;以空白溶剂作参照,以抗坏血酸为阳性对照,在517 nm波长处测定吸光度,每个样品3 个平行。DPPH自由基清除率按公式(1)计算。

式中:A1为0.2 mL样品溶液+3.8 mL DPPH溶液的吸光度;A2为0.2 mL样品溶液+3.8 mL空白溶剂的吸光度;A0为0.2 mL空白溶剂+3.8 mL DPPH溶液的吸光度。
1.3.2.2 ABTS阳离子自由基清除能力测定
参照王俊亮等[11]方法,评价桉叶多酚提取物2,2’-联氮-双(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基清除率。准备ABTS储备液,再配成ABTS工作液,现配现用,734 nm波长处吸光度为0.70±0.02。取不同质量浓度桉叶多酚提取物10 μL到96 孔板,再加200 μL ABTS工作液,振荡混匀10 s,避光反应10 min;以空白溶剂作参照、抗坏血酸为阳性对照,在405 nm波长处测定吸光度,每个样品3 个平行。ABTS阳离子自由基清除率按公式(2)计算。
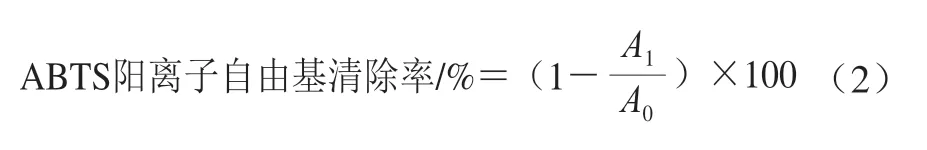
式中:A1为10 μL样品溶液+200 μL ABTS工作液的吸光度;A0为10 μL空白溶剂+200 μL ABTS工作液的吸光度。
1.3.2.3 超氧阴离子自由基清除能力测定
参考Giese等[15]方法,评价桉叶多酚提取物超氧阴离子自由基清除率。反应体系包括1 mL不同质量浓度(0.025~0.4 mg/mL)桉叶多酚提取物储备液、4.5 mL Tris-HCl(0.1 mol/L、25 ℃)及1 mL邻苯三酚(3 mmol/L、25 ℃),混匀后反应4 min;加入0.5 mL HCl(8 mol/L)终止反应,在320 nm波长处测定吸光度A1;以去离子水代替样品在320 nm波长处测定吸光度A3;以去离子水代替邻苯三酚在320 nm波长处测定吸光度A2;以抗坏血酸为阳性对照,每个样品3 个平行。超氧阴离子自由基清除率按公式(3)计算。
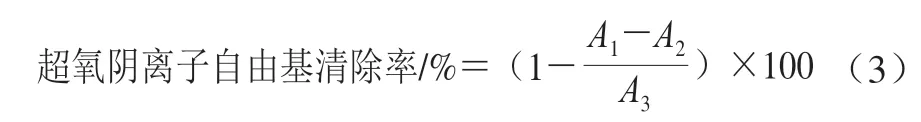
1.3.2.4 总还原能力测定
参考Shon等[16]方法,评价桉叶多酚提取物还原能力。反应体系包括2.5 mL不同质量浓度(0.025~0.4 mg/mL)桉叶多酚提取物溶液和2.5 mL铁氰化钾(质量分数1%),50 ℃下反应20 min,再加入2.5 mL三氯乙酸(10%)。混匀后离心(3 000 r/min、10 min),取5 mL上清液、5 mL蒸馏水及1 mL三氯化铁(质量分数0.1%),混匀后在700 nm波长处测定吸光度。吸光度越大表明还原能力越强。
1.3.3 桉叶多酚提取物对H2O2诱导RAW264.7巨噬细胞氧化损伤的保护作用
1.3.3.1 MTT法检测桉叶多酚提取物对RAW264.7巨噬细胞活性的影响
RAW264.7巨噬细胞培养在10%胎牛血清、5%双抗及DMEM基础培养基配成的完全培养基中,在37 ℃、5% CO2培养箱中培养。
将处于生长对数期RAW264.7巨噬细胞接种在96 孔板中,每孔200 μL(1×104个/孔),孵育24 h。去除上清液,以不同质量浓度桉叶多酚提取物处理细胞24 h。再将20 μL 5 mg/mL MTT溶液培养细胞4 h。去除上清液后以PBS洗3 次细胞,最后加入150 mL DMSO,振荡溶解10 min,在570 nm波长处测定吸光度。以DMSO为空白对照,以正常细胞为对照,细胞活性按公式(4)计算。

式中:A0为空白吸光度;A1为样品吸光度;A2为对照吸光度。
1.3.3.2 MTT法检测桉叶多酚提取物对H2O2诱导氧化损伤细胞活性的影响
将处于生长对数期RAW264.7巨噬细胞接种在96 孔板中,每孔200 μL(1×104个/孔),孵育24 h。将实验分成5 个处理组:对照组加入完全培养基,模型组加入终浓度为400 μmol/L H2O2,实验组细胞以不同质量浓度桉叶多酚提取物(低、中、高剂量组分别为12.5、25、50 μg/mL)预处理24 h后再加入H2O2(终浓度为400 μmol/L)诱导损伤。损伤24 h,再将20 μL 5 mg/mL MTT溶液培养细胞4 h。去除上清液后以PBS洗涤3 次细胞,最后加入150 mL DMSO,振荡溶解10 min,在570 nm波长处测定吸光度。细胞存活率计算公式同1.3.3.1节。
1.3.3.3 氧化损伤细胞中MDA和GSH含量、T-SOD和CAT活力的测定
将处于生长对数期的RAW264.7巨噬细胞接种在6 孔板中,每孔2 mL(20×104个/孔),孵育24 h。将实验分成6 个处理组:对照组加入完全培养基;模型组加入终浓度为400 μmol/L的H2O2;阳性对照组以25 μg/mL抗坏血酸预处理24 h后再加入H2O2(终浓度为400 μmol/L)诱导损伤;实验组细胞以不同浓度桉叶多酚提取物(低、中、高剂量组分别为12.5、25、50 μg/mL)预处理24 h后再加入H2O2(终浓度为400 μmol/L)诱导损伤。损伤处理24 h,去除上清液后以PBS清洗3 遍,收集细胞。按照试剂盒说明书测定细胞内MDA和GSH含量、T-SOD和CAT活力。
1.3.4 桉叶多酚提取物对线虫抗氧化能力的影响
1.3.4.1 线虫培养
以涂有大肠杆菌OP50(E. coliOP50)的标准培养基(nematome growth medium,NGM)培养线虫,培养温度20 ℃,根据线虫生长状况定期将线虫转移到新的涂有E. coliOP50NGM培养基中。
1.3.4.2 ROS水平测定
将同期化后的线虫在样品培养基中培养96 h,将线虫转移到NGM 3 次。挑取50 条线虫转移到含有50 μL PBS的96 孔板(不透光),再加入50 μL 100 μmol/L H2DCF-DA溶液,以不含线虫的H2DCF-DA溶液作对照。立即将96 孔板置于酶标仪中测定荧光强度:反应温度25 ℃、发射波长528 nm、激发波长485 nm,每隔15 min测一次,反应12 h,每组实验重复3 次。
1.3.4.3 线虫寿命实验
将同期化后的虫卵孵育在样品培养基上,20 ℃恒温生化培养箱中培养48 h至L4期幼虫。挑取L4期幼虫到新的各组平板上(每组3 个平板,每个平板30 条)继续培养。线虫生殖期每天将线虫转移到新的各组平板中,其他时期每2 d转移到新的平板中,记录线虫生存、死亡及剔除情况,直到实验结束(线虫存活天数从卵孵化第1天算起)。线虫死亡判断标准:用铂丝轻触虫体无反应,即视为死亡。线虫剔除标准:逃出培养基而干死的线虫、虫卵在体内孵化而成袋样虫、钻入琼脂中线虫。
1.3.4.4 线虫体内抗氧化能力测定
按照1.3.4.3节所述,培养96 h后,将各组线虫转移到NGM培养基上,再用1 mL PBS(pH 7.2~7.4)洗涤培养皿并分别收集成虫。在4 000 r/min条件下离心1 min,重复3 次,保留虫液用于匀浆。再用组织破碎仪(60 Hz、30 s)在冰浴条件下将虫体破碎两次,匀浆液在10 000×g、4 ℃离心10 min,上清液备用待测。参照试剂盒说明书测定抗氧化能力(MDA含量和GSH-Px、T-SOD、CAT活力)。
1.4 数据统计与分析
数据结果以平均值±标准差表示,采用SPSS 18.0软件进行单因素方差分析并用最小显著性差异法进行多重比较,显著水平设置为P<0.05和P<0.01。
2 结果与分析
2.1 桉叶多酚提取物制备与纯化结果

图 1 桉叶多酚提取物纯化前后高效液相色谱图Fig. 1 High performance liquid chromatograms of PEPE before and after purification
由图1 可知,相对于纯化前桉叶多酚提取物,纯化后桉叶多酚提取物中月见草素B峰面积明显增大,纯化方法起到有效分离作用。经计算,纯化前桉叶多酚提取物总多酚含量为(294.36±27.32)mg/g,月见草素B 含量为(94.53±11.0 7)mg/g;纯化后,桉叶多酚提取物总多酚含量为(51 3.4 9±41.25)mg/g,其中月见草素B含量为(384.90±34.73)m g/g。纯化后桉叶多酚提取物中总多酚和月见草素B含量分别提高74.45%和307.17%。进一步对纯化后桉叶多酚进行营养成分检测,可得粗蛋白质、粗脂肪、灰分质量分数分别为(2.25±0.46)%、(1.37±0.24)%、(0.97±0.39)%,以纯化后桉叶多酚开展后续实验。
2.2 桉叶多酚提取物体外抗氧化活性

图 2 桉叶多酚提取物体外抗氧化能力Fig. 2 Antioxidant activity in vitro of PEPE
由图2A可知,桉叶多酚提取物和抗坏血酸的DPPH自由基清除率随着质量浓度增大呈剂量依赖性增大;桉叶多酚提取物和抗坏血酸半抑制质量浓度(50%inhibiting concentration,IC50)分别为0.06 mg/mL和0.021 mg/mL。当桉叶多酚提取物质量浓度为0.4 mg/mL时,最大清除率为(93.09±5.38)%,这也说明桉叶多酚提取物在一定质量浓度时具有良好的DPPH自由基清除能力,此时与抗坏血酸无明显差异。桉叶多酚提取物的清除机理可能是多酚中具有多种供氢体,能将DPPH自由基还原成黄色的DPPH—H;随着桉叶多酚提取物质量浓度增高,供氢能力增强,表现出高效的DPPH自由基清除率和更低的IC50。这种推测与范金波等[17]研究结论一致,该研究指出咖啡酸具有良好供氢能力,能有效清除DPPH自由基。
由图2B可知,随着样品质量浓度增大,桉叶多酚提取物和抗坏血酸ABTS阳离子自由基清除能力逐渐增强;其中抗坏血酸大于0.1 mg/mL时清除率达到平稳期,IC50为0.016 mg/mL,而桉叶多酚提取物IC50为0.052 mg/mL。清除ABTS阳离子自由基的原理与清除DPPH自由基不同,主要是电子转移的过程;ABTS也更容易反应,因为它既亲水也亲脂。本实验中桉叶多酚提取物表现出良好的ABTS阳离子自由基清除能力,与其供电子能力强有关;前期研究也表明不同月份桉叶多酚提取物能有效清除ABTS阳离子自由基[18]。
由图2C可知,本实验采用邻苯三酚自氧化法测定桉叶多酚提取物超氧阴离子自由基清除能力,清除效果呈量效关系,多酚含量越高,清除能力越强;桉叶多酚提取物IC50为0.056 mg/mL,而抗坏血酸为0.025 mg/mL。当桉叶多酚提取物质量浓度为0.4 mg/mL,清除超氧阴离子自由基能力与抗坏血酸无明显差异。超氧阴离子自由基是线粒体呼吸链过程中产生的,它能与金属离子发生Fenton反应,生成羟自由基,进而造成细胞损伤;中和过量的超氧阴离子自由基有利于提高线粒体抗氧化能力[19]。总之,桉叶多酚提取物达到一定质量浓度时,具有良好的清除超氧阴离子自由基能力。
多酚能使反应体系中Fe3+还原成Fe2+,溶液由黄色变成不同程度的蓝色[20];还原能力越强,吸光度越大。由图2D可知,随着样品质量浓度增大,桉叶多酚提取物和抗坏血酸吸光度逐渐增大,表现出良好还原能力。还原能力可延缓或终止自由基反应,实验结果提示桉叶多酚提取物的优异抗氧化活性,多酚质量浓度越高还原能力越强。
桉叶多酚是一种具有良好抗氧化活性的天然活性多酚,前期研究指出桉叶多酚提取物能有效清除DPPH自由基、ABTS阳离子自由基,提高铁离子还原能力和抗脂质过氧化能力[21]。王俊亮等[11]指出多酚类物质是桉叶提取物中主要抗氧化成分,桉叶多酚比相同质量浓度下茶叶粗提物具有更好的抗氧化活性。本实验通过溶剂萃取方法对桉叶多酚提取物进行分离纯化,得到多酚含量较高的桉叶多酚提取物。实验结果表明,纯化后的桉叶多酚提取物具有更高的DPPH自由基、ABTS阳离子自由基、超氧阴离子自由基清除能力及铁离子还原能力。然而仅仅采用体外抗氧化评价方法是不全面的,需要系统研究桉叶多酚提取物的抗氧化能力,因此进一步开展桉叶多酚提取物对细胞抗氧化能力的影响。
2.3 桉叶多酚提取物对H2O2诱导RAW264.7巨噬细胞氧化损伤的保护作用
2.3.1 桉叶多酚提取物对细胞活性的影响
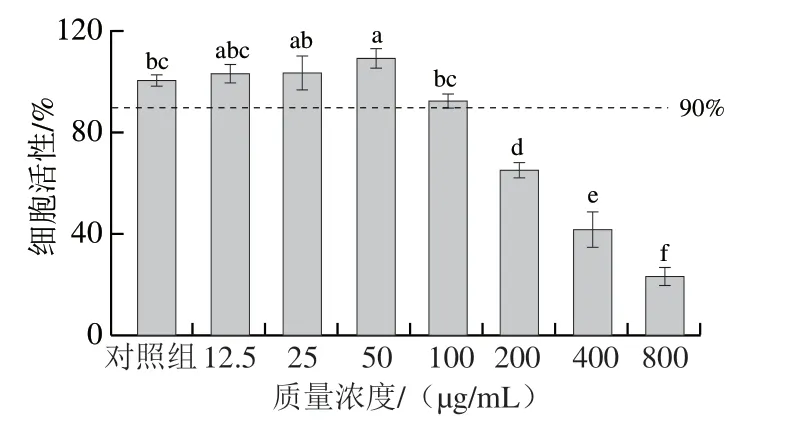
图 3 桉叶多酚提取物对RAW264.7巨噬细胞活性的影响Fig. 3 Effect of PEPE on the viability of RAW264.7 cells
采用MTT法分析桉叶多酚提取物对RAW264.7巨噬细胞的影响。由图3可见,相比于对照组,当桉叶多酚提取物质量浓度在12.5~100 μg/mL时,细胞活性均高于90%,且在12.5~50 μg/mL范围内具有一定促进细胞增殖的效果;当桉叶多酚提取物质量浓度在200~800 μg/mL时,细胞活性受到显著抑制(P<0.05)。因此选择12.5、25、50 μg/mL作为后续实验的桉叶多酚提取物质量浓度。
2.3.2 桉叶多酚提取物对H2O2诱导氧化损伤细胞活性的影响
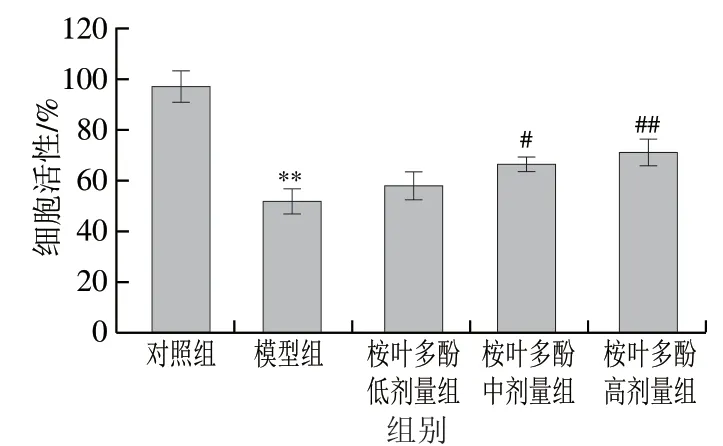
图 4 桉叶多酚提取物对氧化损伤RAW264.7巨噬细胞活性的影响Fig. 4 Effect of PEPE on the viability of RAW264.7 cells with H2O2-induced damage
基于本实验室前期研究,以400 μmol/L H2O2诱导RAW264.7巨噬细胞氧化损伤。由图4可见,模型组细胞存活率极显著低于对照组(P<0.01),此时细胞活性为(51.67±9.77)%,说明造模成功。此外,桉叶多酚提取物处理组细胞活性随质量浓度增大呈上升趋势,其中25 μg/mL和50 μg/mL桉叶多酚提取物组细胞活性分别显著高于模型组27.94%和37.66%(P<0.05,P<0.01);这说明桉叶多酚提取物具有良好的抗氧化效果,能减轻细胞氧化损伤,有效保护细胞。
2.3.3 桉叶多酚提取物对细胞抗氧化能力的影响
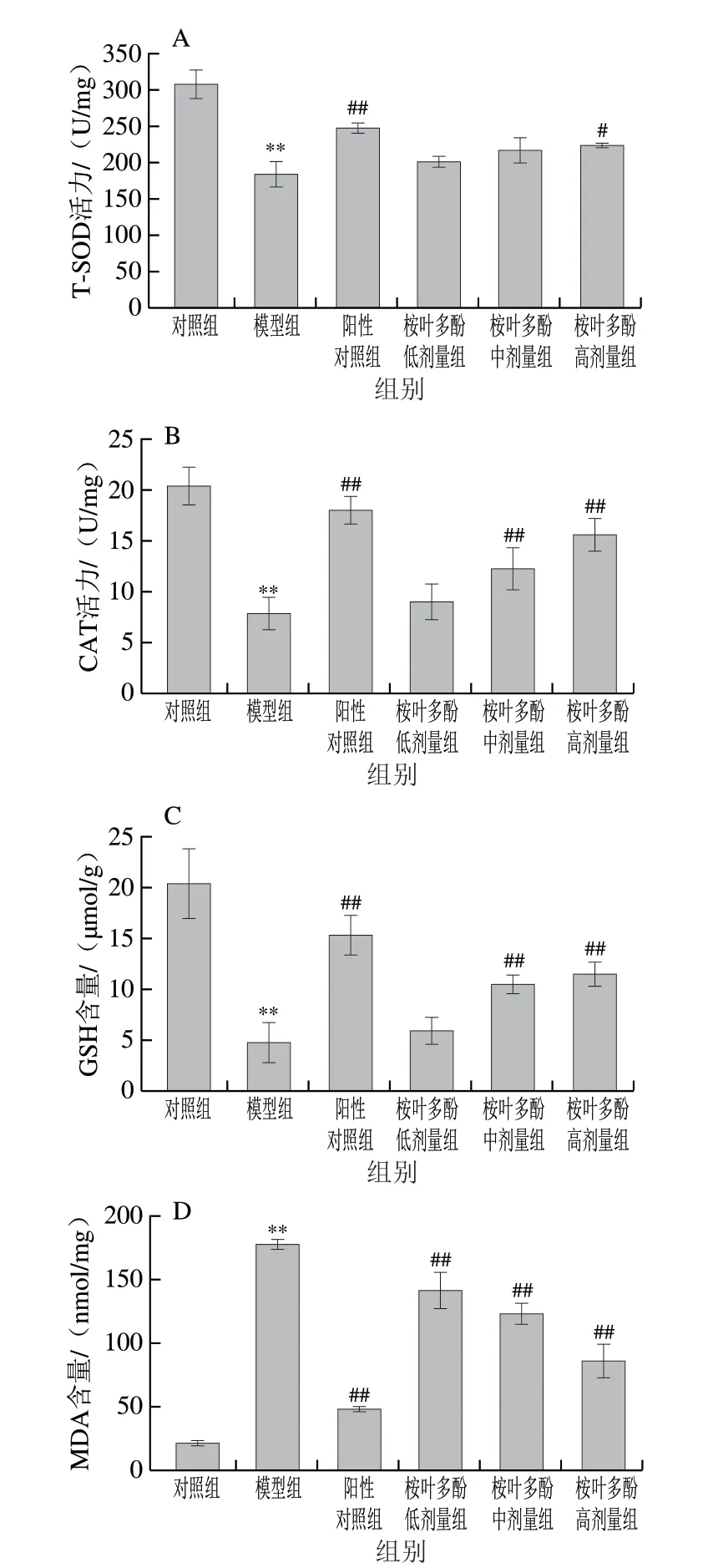
图 5 桉叶多酚提取物对氧化损伤细胞抗氧化能力的影响Fig. 5 Protective effect of PEPE on oxidative damage in cells
以T-SOD、CAT活力、GSH及MDA水平为评价指标,探究桉叶多酚提取物对氧化损伤细胞的保护作用。细胞抗氧化防御系统包括酶类(T-SOD、GSH-Px、CAT等)和非酶物质(GSH等),它们在细胞处于氧化应激状态时能有效清除过量的自由基,起到保护细胞的作用[22]。而MDA作为脂质氧化产物之一,直接反映细胞脂质过氧化损伤程度。由图5可知,相比于对照组,模型组细胞中T-SOD、CAT活力及GSH含量极显著降低(P<0.01),而MDA含量极显著升高(P<0.01)。这说明细胞在受到外源性H2O2刺激后,细胞通过Fenton反应等方式产生过量的高活性自由基(羟自由基、单线态氧等)造成细胞氧化损伤[23]。由图5A、B可知,相比于模型组,50 μg/mL桉叶多酚提取物能显著提高细胞内T-SOD活性(P<0.05);且桉叶多酚提取物中高剂量组均能极显著提高CAT活力(P<0.01),其中50 μg/mL桉叶多酚提取物组细胞CAT活力与抗坏血酸组接近,说明桉叶多酚提取物通过提高抗氧化酶活性,有效改善H2O2诱导RAW264.7巨噬细胞的氧化损伤。相似研究指出金银花黄酮能显著提高H2O2诱导细胞及上清液的T-SOD及CAT活力[24],这与其调节细胞氧化还原系统有关;金银花黄酮能清除过量自由基及有害物质,维持细胞膜稳定。此外,图5C也表明桉叶多酚提取物中、高剂量组极显著提高细胞内GSH含量(P<0.01),呈量效关系。GSH作为细胞内重要的非酶抗氧化物质,在细胞内能有效清除超氧阴离子、H2O2等。桉叶多酚提取物通过提高GSH含量的方式一定程度上清除产生的自由基和有害物质,缓解细胞的氧化损伤,这与宋家乐等[25]报道结果一致。MDA作为细胞内脂质过氧化的副产物,常用作评价细胞氧化损伤程度。本实验中也发现桉叶多酚提取物呈质量浓度依赖性降低氧化损伤细胞中MDA含量,最高降低51.84%。总体来说,桉叶多酚提取物能有效提高氧化损伤细胞中T-SOD、CAT活力及GSH含量,降低MDA含量,起到清除自由基以保护氧化损伤细胞的作用。
H2O2是诱导细胞氧化损伤常用的一种化学物质,能较好地模拟自由基诱导细胞凋亡。在本实验中,桉叶多酚提取物能有效改善H2O2诱导氧化损伤RAW264.7巨噬细胞的活性,这与其抗氧化能力有关,具体表现在桉叶多酚提取物能显著提高细胞内抗氧化酶活性和抗氧化物质含量,降低MDA含量。相似研究指出小叶薄荷黄酮提取物可降低MDA和乳酸脱氢酶水平,提高SOD、GSH-Px、CAT活性,减轻H2O2诱导的HUVEC细胞氧化损伤[26]。氧化应激常常与活性氧(reactive oxygen species,ROS)的产生有关,而ROS包括超氧阴离子自由基、H2O2及其下游过氧化物等,细胞内过量的ROS会加剧氧化损伤[27]。Wang Xu等[28]的报道支持这个理论,发现氧化损伤后的RAW264.7巨噬细胞内ROS水平显著提高,而虾青素能有效降低氧化损伤细胞内的ROS水平,通过提高SOD活性和降低MDA含量的方式提高细胞抗氧化状态,达到保护氧化损伤细胞的作用。桉叶多酚提取物作为一种富含多酚类物质的提取物,同样能起到有效减轻细胞氧化损伤的作用,这可能与其多种活性成分的综合药理效应有关[29]。虽然桉叶多酚在化学和细胞抗氧化中表现出良好的抗氧化能力,但其在生物体内是能否起到相当的抗氧化作用仍需要证实。多酚类物质在体内的吸收和代谢、聚合程度等都影响其在体内发挥生物学效应[30],因此,对桉叶多酚提取物体内抗氧化活性评价是必要的。
2.4 桉叶多酚提取物对线虫抗氧化能力的影响
2.4.1 桉叶多酚提取物质量浓度筛选

图 6 桉叶多酚提取物对线虫体内ROS水平的影响Fig. 6 Effect of PEPE treatment on reactive oxygen species accumulation in C. elegans
探究桉叶多酚提取物在常规培养及氧化损伤条件下对线虫体内ROS积累量的影响。ROS作为细胞新陈代谢过程中的产物,能引起细胞内蛋白质变性、脂质氧化等[31]。本实验首先以不同质量浓度(25~200 μg/mL)桉叶多酚提取物培养线虫96 h,通过荧光探针检测线虫体内ROS积累量。图6A表明,随着桉叶多酚提取物质量浓度增大,线虫体内ROS积累量逐渐降低;相比于对照组,当桉叶多酚提取物质量浓度为100 μg/mL和200 μg/mL时,ROS积累量分别下降24.61%和30.48%(P<0.05)。此时,两个质量浓度桉叶多酚提取物组间无显著差异(P>0.05),因此选用100 μg/mL开展后续实验。为了进一步研究桉叶多酚提取物在线虫氧化应激状态下是否起作用,实验将同期化后的线虫(100 μg/mL桉叶多酚提取物培养96 h)在1 mmol/L H2O2下刺激24 h,测定线虫体内ROS积累量。如图6B所示,H2O2处理组线虫ROS积累量极显著高于对照组(P<0.01),说明H2O2处理后线虫发生氧化损伤;而桉叶多酚提取物处理后的线虫体内ROS积累量极显著下降29.97%。综上,100 μg/mL桉叶多酚提取物能有效降低线虫体内ROS积累,起到保护线虫的作用。
2.4.2 桉叶多酚提取物对线虫寿命的影响
以100 μg/mL桉叶多酚提取物培养线虫,评价桉叶多酚提取物对线虫寿命的影响。由图7可知,相比于对照组,桉叶多酚提取物组线虫生存曲线发生高度显著右移(P<0.01),说明桉叶多酚提取物处理后线虫整体寿命高于对照组。表1显示桉叶多酚提取物组线虫最长寿命和中位寿命均显著高于对照组(P<0.05),分别提高14.12%和14.03%。推测桉叶多酚提取物良好的抗氧化活性间接起到延长线虫寿命的作用,这种推测与Luo Siyuan等[32]研究一致,其发现橄榄叶提取物能提高线虫寿命,线虫体内抗氧化酶及基因均显著提高。总之,桉叶多酚提取物能有效延长线虫寿命,这可能与其良好的抗氧化活性有关。
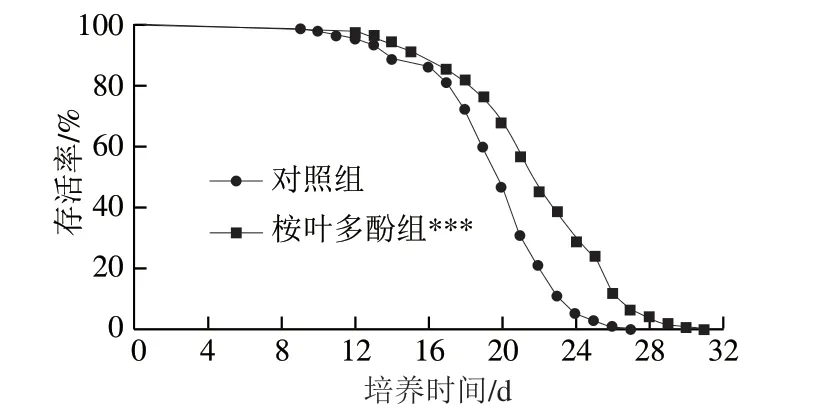
图 7 桉叶多酚提取物对线虫寿命的影响Fig. 7 Effect of PEPE on the lifespan of C. elegans

表 1 桉叶多酚提取物对线虫寿命的影响(n=60)Table 1 Effect of PEPE on the lifespan of C. elegans (n= 60)
2.4.3 桉叶多酚提取物对线虫抗氧化能力的影响

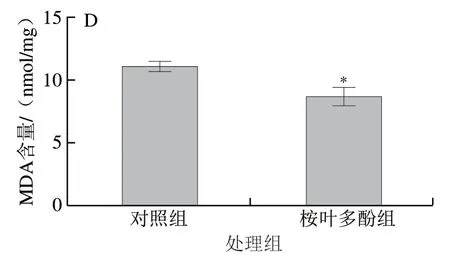
图 8 桉叶多酚提取物对线虫抗氧化能力的影响Fig. 8 Effect of PEPE on the antioxidant capacity of C. elegans
为了进一步验证桉叶多酚提取物抗氧化作用与延长线虫寿命有关,实验测定桉叶多酚提取物处理后线虫体内抗氧化指标。由图8可知,相比于对照组,桉叶多酚提取物组线虫体内T-SOD和GSH-Px活力分别显著提高28.64%和32.45%(P<0.05),MDA含量下降21.48%(P<0.05)。这说明桉叶多酚提取物能有效提高线虫抗氧化能力,降低新陈代谢过程中产生的自由基含量,起到延长线虫寿命的作用。相似研究也指出鼠尾草酚能显著提高线虫抗氧化能力,实现提高线虫寿命的作用[33]。综上,桉叶多酚提取物能显著提高线虫抗氧化能力。
本实验以秀丽隐杆线虫评价桉叶多酚提取物抗氧化活性评价,该模型具有稳定性好、周期短、费用低等特点。线虫60%~80%基因与人类相应基因具有同源性,特别地,线虫体内存在的抗氧化酶与人体相似(SOD和CAT),也含有谷胱甘肽S转移酶和过氧化物酶基因等[34-35]。在本实验中,桉叶多酚提取物能降低常规和应激条件下线虫体内的ROS积累量,表现出良好的抗氧化潜力。过量的ROS会引起线虫氧化损伤(蛋白质损伤、脂质氧化、DNA受损等),进而造成寿命缩短。这也说明桉叶多酚提取物可能提高了线虫的耐受能力而延长线虫寿命。有研究指出长寿型的突变体线虫往往具有较高抵抗应激的能力,从而延长线虫寿命[36]。寿命实验进一步证实桉叶多酚提取物能显著提高线虫最长寿命和中位寿命,这可能与其降低线虫生长过程中ROS的积累有关。此外,桉叶多酚提取物能显著提高线虫体内抗氧化酶(SOD、GSH-Px、CAT)活力,降低MDA含量,推测这是其降低线虫体内ROS水平及延长寿命的部分原因。相似研究也指出紫薯提取物显著提高线虫体内抗氧化酶活力(SOD、CAT)是延长线虫寿命的作用机制之一[37]。总体而言,桉叶多酚提取物体外抗氧化作用与线虫体内的结果一致,更能准确反映其在生物体内的抗氧化效用,为桉叶多酚提取物进一步开发成食品抗氧化剂或功能食品提供参考。
3 结 论
本研究表明桉叶多酚提取物能有效清除DPPH自由基、ABTS阳离子自由基及超氧阴离子自由基,具有良好还原能力。细胞实验指出桉叶多酚提取物提高细胞内T-SOD活力、CAT活力及GSH含量,降低MDA含量,清除细胞内过量自由基和有害物质,起到保护氧化损伤细胞的作用。此外,体内实验也发现桉叶多酚提取物能降低线虫体内ROS积累,提高抗氧化酶活力(T-SOD、GSH-Px),达到延长线虫寿命的效果。本研究仍存在不足之处,如桉叶多酚纯度不够、抗氧化作用机制研究不深等,还需要进一步实验探究桉叶多酚中活性成分与生理功能的关系。总之,本实验结果初步表明桉叶多酚提取物具有良好的体内外抗氧化效果,具有一定的研究价值。
