玉米肽的纳滤脱盐工艺及脱盐产物抗氧化活性
2021-03-31王晓杰刘晓兰
王晓杰,曲 悦,刘晓兰,马 瑞
(齐齐哈尔大学食品与生物工程学院,黑龙江省玉米深加工理论与技术重点实验室,黑龙江 齐齐哈尔 161006)
玉米醇溶蛋白以聚集体形式存在于玉米胚乳细胞内,分布于粒径为5~35 μm的淀粉粒之间[1]。玉米醇溶蛋白富含谷氨酸(21%~26%)、亮氨酸(20%)、脯氨酸(10%)和丙氨酸(10%),但缺乏碱性和酸性氨基酸,尤其是色氨酸与赖氨酸[2]。玉米醇溶蛋白的氨基酸组成特点决定其具有独特的溶解性:不溶于水,在碱性溶液(pH≥11)和体积分数为60%~95%的醇类溶液中溶解度较高[3]。在我国,玉米醇溶蛋白作为湿磨法玉米淀粉生产的下脚料,大部分作为饲料原料出售,经济效益较低。因此,需要依据不同的技术不断开发这种蛋白质原料的新用途,以增加玉米深加工企业的附加值。
玉米肽是玉米蛋白经蛋白酶水解或微生物发酵后获得的低分子质量产物。与玉米蛋白相比,玉米肽的溶解性显著增加,而且具有高浓度、低黏性、酸性环境下不易沉淀、容易吸收和食用安全等特点[4]。另外,玉米蛋白富含疏水性氨基酸的独特特点赋予玉米肽多重生物活性,包括抑制血管紧张素转换酶活性[5]、抗氧化[6]、护肝[7]、降血糖[8]等,这些活性主要受酶特异性和水解条件(pH值、温度、酶与底物之比和水解度)的控制。基于玉米肽的上述健康功能,其在食品、医药、保健食品等领域显现出良好的应用前景。目前,国内外市场上已经有两大类玉米肽产品,一类是基于动物实验和人体实验的醒酒保肝功效[9-10],将玉米肽作为主要原料生产醒酒护肝类饮品和片剂;一类是基于营养组成和功效互补的原则,将玉米肽作为辅助原料,与其他生物活性物质复配生产功能性食品或特殊医学配方食品[11]。但是,随着研究工作的逐步深入,发现经蛋白酶酶法水解制备玉米肽时,会因酶解过程中调节酸碱度引入的盐分而带来异味,而这种味道的产生严重影响了玉米肽的风味和理化性质[12],导致玉米生物活性肽成为高盐食品而使其在食品工业的应用受到限制。因此,为了满足人们对健康食品的需求,需要从玉米肽中去除部分盐分。目前,适合于生物活性物质的脱盐方法主要包括透析、超滤、纳滤、电渗析、大孔树脂法和离子交换树脂法等[13]。其中,纳滤膜对单价离子截留率低,又同时具有脱盐和浓缩于一体的效果[14],非常适用于因酶解过程而引入单价离子的生物活性肽的脱盐处理。在采用纳滤对不同来源生物活性肽进行脱盐时,脱盐率一般在42.56%~95.90%范围内,短肽回收率在73.82%~98.49%范围内[14-18]。
本实验以玉米抗氧化活性肽为原料,以膜通量、电导率、脱盐率以及抗氧化活性为指标,确定不影响玉米肽抗氧化活性的纳滤脱盐工艺,同时利用H2O2诱导的Caco-2细胞氧化性损伤模型对脱盐玉米肽的抗氧化活性进行了研究,为抗氧化活性玉米肽的工业化生产及其在食品工业的应用提供参考。
1 材料与方法
1.1 材料与试剂
碱性蛋白酶丹麦诺维信公司;邻苯二甲醛、菲洛嗪、硫代巴比妥酸、噻唑蓝(thiazole blue,MTT)上海生工生物有限公司;玉米醇溶蛋白、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2-脱氧-D-核糖美国Sigma公司;Caco-2细胞南京凯基生物技术有限公司;DMEM培养基(高糖)、0.25%胰蛋白酶美国Gibico公司;胎牛血清德国PAN公司;RIPA高效裂解液北京索莱宝公司;总蛋白定量(BCA法)测试盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、过氧化氢(catalase,CAT)试剂盒、谷胱甘肽还原酶(glutathione reductase,GR)试剂盒、γ-谷氨酰半胱氨酸合成酶(γ-glutamylcsteine synthetase,γ-GCS)试剂盒南京建成生物工程研究所;其他试剂均为国产分析纯。
1.2 仪器与设备
HYM-Multi-RN多功能实验分离机厦门昊源膜科技有限公司;截留分子质量150 Da纳滤膜美国GE公司;NDA701凯氏定氮仪意大利VELP公司;DDSJ-308A电导率仪上海雷磁仪器厂;ICE3000原子吸收光谱仪美国赛默飞世尔科技有限公司;DU800紫外-可见分光光度计贝克曼库尔特商贸(中国)有限公司;NV 4750E二氧化碳培养箱美国NUAIRE公司;EnSpire多功能酶标仪美国珀金埃尔默股份有限公司。
1.3 方法
1.3.1 玉米肽的制备
玉米肽的制备方法参照文献[19]。取40 g玉米醇溶蛋白于1 000 mL烧杯中,加入800 mL蒸馏水,搅拌均匀后将烧杯放入60 ℃水浴磁力搅拌器中央,调节pH值至8.5,加入1.2 g碱性蛋白酶开始酶解反应,酶解过程中通过不断滴加1 mol/L NaOH溶液使pH值维持在8.5,酶解2.0 h后取出放入沸水浴中灭酶15 min,3 000 r/min离心10 min,收集上清液即获得玉米肽。此时,玉米醇溶蛋白的水解度为(23.99±0.21)%(采用pH-stat法测定);玉米肽的蛋白质量分数为(81.86±0.50)%(采用凯氏定氮法测定),85.47%玉米肽的分子质量主要分布在300~6 500 Da范围内(采用凝胶层析法测定)。
1.3.2 玉米肽纳滤脱盐工艺的操作温度和压力的确定
取1.3.1节中制备的玉米肽,在一定温度和一定压力条件下,分别测定玉米肽通过截留分子质量150 Da纳滤膜的膜通量,以确定玉米肽纳滤脱盐工艺的操作温度和压力,膜通量具体按公式(1)计算。
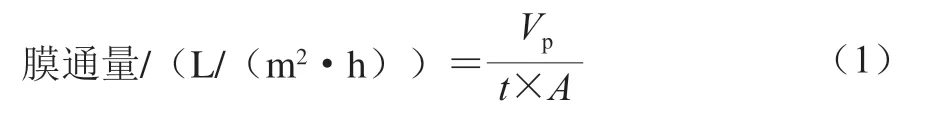
式中:Vp为透过液的体积/L;t为操作时间(0.5 h);A为膜有效面积(0.38 m2)。
1.3.3 玉米肽纳滤脱盐工艺
在1.3.2节部分确定的温度和压力条件下,将1.3.1节制备的玉米肽过截留分子质量150 Da纳滤膜进行脱盐处理。纳滤原液体积记为V0,经纳滤膜脱盐、浓缩至体积Vr(Vr=1/2V0),体积浓缩倍数为2,并测定透过液和截留液的电导率,此为第1次纳滤;向截留液中加入适量的蒸馏水至体积为V0,经纳滤膜脱盐、浓缩至体积浓缩倍数为2,此为第2次纳滤;如此重复纳滤5 次,每次固定纳滤频率50 Hz。取每次纳滤结束加完蒸馏水的截留液,进行冷冻干燥,将干燥好的玉米肽用于测定蛋白质含量、Na+质量分数及抗氧化活性。
1.3.4 电导率、Na+质量分数、脱盐率、短肽回收率的测定
电导率的测定参照文献[14],单位为mS/cm;Na+质量(mNa+)采用原子吸收光谱仪测定,采用公式(2)计算Na+质量分数;脱盐率和短肽回收率分别按公式(3)、(4)计算;原液、透过液和截留液中蛋白质量浓度采用福林-酚法测定[20]。

式中:ρ0、ρp和ρr分别为原液、透过液和截留液中的蛋白质量浓度/(mg/L);m肽为玉米肽中的蛋白质量/mg;V0、Vp和Vr分别为原液、透过液和截留液体积/L。
1.3.5 玉米肽抗氧化活性的测定
以未纳滤的玉米肽作为对照,测定玉米肽质量浓度为2 mg/mL(以蛋白质量计)时其羟自由基清除能力、DPPH自由基清除能力和亚铁离子螯合能力,测定方法参照文献[21]。
1.3.6 利用H2O2诱导的Caco-2细胞氧化性损伤模型研究脱盐玉米肽的抗氧化活性
1.3.6.1 脱盐玉米肽对Caco-2细胞毒性的测定
脱盐玉米肽对Caco-2细胞毒性的测定采用MTT法,具体参照文献[22]。Caco-2细胞在37 ℃、5% CO2的二氧化碳培养箱中培养,培养基为添加10%(体积分数,后同)胎牛血清和1%双抗的DMEM(高糖)培养基。待细胞生长融合度达到80%~90%时,以1∶3比例传代培养。实验选用20~30 代细胞。

1.3.6.2 H2O2氧化应激条件下Caco-2细胞存活率的测定
将对数期Caco-2细胞以密度为1×105个/mL接种至96 孔板,每孔加入100 μL细胞悬液,培养24 h后,对照组和H2O2组每孔加入100 μL DEME培养基,样品组每孔加入100 μL脱盐玉米肽溶液(蛋白终质量浓度分别为5、50、100、200、500 μg/mL和1 000 μg/mL),样品作用Caco-2细胞6 h后吸弃孔内液体,对照组每孔加入200 μL DEME培养基,H2O2组和样品组每孔加入200 μL 200 μmol/L H2O2溶液,继续培养4 h后,根据1.3.6.1节中的MTT法测定细胞存活率。
1.3.6.3 H2O2应激条件下抗氧化酶活力的测定
将对数期Caco-2细胞以1.5×105个/mL接于6 孔板中,每孔加入细胞悬液培养24 h后,对照组和H2O2组每孔加入200 μL DMEM培养基,样品组每孔加入蛋白终质量浓度分别为5、25、50 μg/mL和75 μg/mL的脱盐玉米肽,作用Caco-2细胞6 h后,弃掉上清液,对照组加入DMEM培养基,H2O2组和样品组每孔加入2 mL 200 μmol/L H2O2溶液培养4 h,吸弃孔内液体,加入适量胰蛋白酶消化细胞、适量培养基终止消化,1 000 r/min离心5 min收集细胞沉淀,用磷酸盐缓冲液洗涤细胞后加入高效RIPA裂解液,4 ℃裂解20~30 min,10 000 r/min离心5 min后,上清液分装于1.5 mL离心管中,-80 ℃保存备用。测定时,取适量细胞裂解液放置于冰浴中,按照SOD、CAT、GR、γ-GCS试剂盒说明书进行测定,结果以蛋白质量计,单位为U/mg。
1.4 数据处理分析
所有数据均以平均值±标准差表示,采用Origin软件绘图,采用SPSS 19.0软件进行统计学分析,通过Duncan检验进行差异显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 玉米肽纳滤脱盐工艺的操作温度和操作压力的确定
2.1.1 操作温度对纳滤膜通量的影响
在压力20 bar、频率50 Hz、时间0.5 h、玉米肽体积6.4 L的条件下,测定不同操作温度下纳滤膜的膜通量,实验结果如图1所示。随着操作温度的升高,纳滤膜的膜通量不断增大,这是因为温度直接影响纳滤膜的孔径、阻力以及浓缩液的黏度,升高操作温度可以降低纳滤膜对玉米肽的阻力,增加溶质扩散系数,降低浓差极化程度,进而使膜通量升高[15]。但是,当操作温度由20 ℃升高到23 ℃时,膜通量无显著性变化(P>0.05),并且较高的温度可能会影响玉米肽的生物活性,因此,选择纳滤的操作温度为20 ℃。
上述研究表明,数字学术的出现对英国高校图书馆的服务产生了一定的影响,英国高校图书馆界逐步意识到数字学术能力的重要性,以及开展数字学术支持的重要性,并通过设置相应职位、开展具体服务等方式支持数字学术。英国高校图书馆的数字学术服务实践,对我们多角度地了解数字学术环境及高校图书馆的数字学术服务发展方向具有积极的借鉴意义。本文对英国高校图书馆开展的数字学术服务实践进行调查分析,以期为我国高校图书馆的相关服务提供参考。

图 1 操作温度对玉米肽脱盐纳滤膜通量的影响Fig. 1 Effect of operating temperature on nanofiltration membrane flux
2.1.2 操作压力对纳滤膜通量的影响

图 2 操作压力对玉米肽脱盐纳滤膜通量的影响Fig. 2 Effect of operating pressure on nanofiltration membrane flux
压力是影响纳滤膜通量的重要因素[23]。在温度20 ℃、频率50 Hz、时间30 min、玉米肽体积6.4 L的条件下,测定不同操作压力下纳滤膜的膜通量,结果如图2所示。随着操作压力的增大,纳滤膜的渗透性增加,滤出液的体积逐渐上升,膜通量逐渐增大。这是由于操作压力的增大会加快膜面液体的流速,此时膜面的蛋白质层堆积得比较松弛,膜的污染速度减慢,提高了纳滤膜的分离性能[24]。但是,当压力由20 bar升高到25 bar时,膜通量无显著性变化(P>0.05),可能是由于压力过大使纳滤膜逐渐被压密,总阻力也随压力的增加而增大,导致纳滤膜损伤加重。所以,选择纳滤时的操作压力为20 bar。
2.2 玉米肽纳滤脱盐工艺的确定
2.2.1 纳滤脱盐对玉米肽溶液电导率和短肽回收率的影响
在温度20 ℃、频率50 Hz、压力20 bar的条件下,玉米肽连续纳滤5 次,每次体积浓缩倍数为2,测定5 次纳滤脱盐后电导率和短肽回收率的变化情况,实验结果如图3所示。由图3A可知,脱盐前玉米肽的电导率为6.38 mS/cm,随着纳滤次数的增加,玉米肽浓缩液和滤出液的电导率均不断下降,间接说明玉米肽溶液中的盐分含量不断下降。与未纳滤玉米肽相比,经5 次纳滤脱盐后,浓缩液的电导率下降了33.86%。当纳滤次数从3增加到5时,虽然滤出液的电导率下降幅度较小,彼此之间无显著性差异,但浓缩液的电导率继续显著下降,说明当纳滤次数为5时,可以有效去除玉米肽溶液中的盐分。
由图3B可以看出,随着纳滤次数的增加,玉米肽的短肽回收率逐渐下降,纳滤5 次时,短肽回收率达96.73%,比纳滤前降低了3.27%,说明纳滤去除盐分的同时也有一部分游离氨基酸或者二肽被损失掉。

图 3 纳滤脱盐对玉米肽溶液电导率(A)和短肽回收率(B)的影响Fig. 3 Effect of nanofiltration desalting on conductivity (A) and short peptide recovery (B)
2.2.2 纳滤脱盐对玉米肽溶液中Na+质量分数和脱盐率的影响

图 4 纳滤脱盐对玉米肽溶液中Na+质量分数和脱盐率的影响Fig. 4 Effect of nanofiltration desalting on Na+ concentration and desalting efficiency
在温度20 ℃、频率50 Hz、压力20 bar的条件下,玉米肽连续纳滤5 次,每次体积浓缩倍数为2,测定玉米肽溶液中的Na+质量分数及脱盐率随纳滤次数的变化情况,实验结果如图4所示。脱盐前玉米肽的Na+质量分数为11.00%,这部分盐分是玉米肽制备过程中为维持pH值稳定滴加NaOH溶液而形成的,这对玉米肽作为一种功能性食品是不利的。随着纳滤次数的增加,玉米肽溶液中Na+质量分数不断下降,在纳滤次数为5时,Na+质量分数比纳滤前降低63.09%;另一方面,随着纳滤次数的增加,玉米肽溶液的脱盐率逐渐增加,在纳滤次数为5时,玉米肽的脱盐率达70.73%。杜璟等采用截留分子质量160 Da的纳滤膜对玉米降血压肽进行脱盐处理时,在初始条件下(约pH 8.0),经90 min处理后,脱盐率为76.82%[15]。说明在纳滤脱盐过程中,有一部分Na+与玉米肽结合较紧密,即使持续加水也无法除去;随着纳滤的进行,纳滤膜表面肽浓度会逐渐增加,导致纳滤膜表面上形成了凝胶层,即使不断加水循环冲洗也不能完全消除,造成部分Na+与之结合而不能完全除尽。因此,经5 次纳滤操作才基本可以达到对玉米肽脱盐的目的。
2.2.3 纳滤对玉米肽抗氧化活性的影响

图 5 纳滤次数对玉米肽羟自由基和DPPH自由基清除率(A)以及亚铁离子螯合率(B)的影响Fig. 5 Effect of nanofiltration number on hydroxyl and DPPH radical scavenging capacities (A) and ferrous ion chelating capacity (B) of corn peptide
由图5A可知,随着纳滤次数的增加,玉米肽对DPPH自由基和羟自由基的清除能力逐渐增强。与未纳滤处理样品相比,在纳滤次数为4时,纳滤处理后玉米肽对DPPH自由基和羟自由基的清除能力显著增加(P<0.05),分别增加21.98%和45.87%,可能是由于纳滤4 次时,短肽回收率高达97.3%,没有导致具有抗氧化活性的玉米肽损失,在此基础上,盐分的除去使玉米肽的纯度增大,导致玉米肽的自由基清除能力增强。于国才等用截留分子质量160 Da的纳滤膜对玉米肽进行脱盐处理时,发现随着纳滤次数的增加,玉米肽清除羟自由基的能力不断增加[14]。Bourseau等也发现在酶解后采用压力驱动的纳滤膜进行脱盐,可以提高鱼蛋白水解产物的比活力[25]。与纳滤前相比,纳滤次数为5时玉米肽的DPPH自由基和羟自由基清除率分别提高21.55%和35.93%。
由图5B可知,与未纳滤玉米肽相比,纳滤次数增加到3时,样品的亚铁离子螯合能力无显著性差异,当纳滤次数为4时,样品的亚铁离子螯合能力显著增加,比对照组增加4.53%;继续增加纳滤次数时,玉米肽对亚铁离子螯合的能力显著降低,比对照组降低了7.38%,可能此时有部分具有螯合亚铁离子的玉米肽样品损失或活性位点被纳滤时的剪切力所破坏。
综合图3~5分析,确定玉米肽纳滤脱盐的工艺参数为温度20 ℃、频率50 Hz、压力20 bar、纳滤5 次,每次体积浓缩倍数为2。
2.3 脱盐玉米肽的细胞水平抗氧化活性
2.3.1 脱盐玉米肽对Caco-2细胞的毒性效应

图 6 不同质量浓度脱盐玉米肽对Caco-2细胞存活率的影响Fig. 6 Effect of desalted corn peptide at different concentrations on Caco-2 cell viability
基于结构和氨基酸组成的不同,肽类物质具有不同的细胞毒性作用[26]。将脱盐玉米肽作用Caco-2细胞24 h后测定细胞存活率,以表征脱盐玉米肽对Caco-2细胞的毒性效应,实验结果如图6所示。与对照组相比,在5~200 μg/mL范围内,随着脱盐玉米肽质量浓度的增加,Caco-2细胞存活率逐渐增加,但均没有统计学差异(P>0.05);当玉米肽质量浓度为500 μg/mL时,细胞存活率显著增加(P<0.05),比对照组高5.94%;脱盐玉米肽的质量浓度继续增加,Caco-2细胞的存活率略有下降,但与对照组之间也没有显著性差异,说明在实验质量浓度范围内,脱盐玉米肽对Caco-2细胞没有毒性,甚至有一定的增殖效果,这与Jiang Yuan等的实验结果[27]相一致。
2.3.2 H2O2诱导的氧化应激模型中脱盐玉米肽对Caco-2细胞存活率的影响

图 7 脱盐玉米肽对H2O2诱导的氧化应激条件下Caco-2细胞存活率的影响Fig. 7 Effect of desalted corn peptide on H2O2-induced Caco-2 cell viability
将Caco-2细胞用脱盐玉米肽预处理6 h,然后暴露于200 μmol/L氧化剂H2O2中以进一步评估其对氧化性损伤的保护作用,实验结果如图7所示。与对照组相比,用200 μmol/L H2O2刺激Caco-2细胞4 h,细胞存活率极显著降低,降低了15.21%,表明H2O2破坏了Caco-2内抗氧防御系统和氧自由基的动态平衡,Caco-2氧化应激模型构建成功。在H2O2诱导Caco-2细胞氧化应激之前,用脱盐玉米肽预处理Caco-2细胞6 h,均可以提高受损细胞的存活率,且提高效应随着玉米肽质量浓度的增加而增加。在质量浓度为5 μg/mL时,脱盐玉米肽处理使细胞存活率由H2O2氧化应激组的84.79%提高到92.94%,说明低质量浓度脱盐玉米肽具有很强的细胞保护作用,保护Caco-2细胞免受H2O2诱导的氧化损伤,分析可能的原因是脱盐玉米肽具有较低的分子质量和较高的疏水性,可有效进入细胞内并与参与氧化应激途径的物质相互作用[28-29],加速清除细胞内的活性氧自由基而提高了细胞存活率。
2.3.3 脱盐玉米肽对H2O2诱导的氧化性损伤Caco-2细胞内抗氧化酶活力的影响

表 1 脱盐玉米肽对H2O2诱导的氧化性损伤Caco-2细胞内抗氧化酶活力的影响Table 1 Effect of desalted corn peptide on antioxidant enzyme activities in H2O2-induced Caco-2 cells
为了进一步证明脱盐玉米肽的抗氧化能力,研究了其对氧化性损伤Caco-2细胞内抗氧化酶(包括CAT、SOD、γ-GCS和GR)活力的影响,实验结果如表1所示。与对照组相比,Caco-2细胞在200 μmol/L的H2O2中暴露4 h后,Caco-2细胞内CAT、SOD、γ-GCS和GR的活力分别降低了77.07%、31.70 %、67.38%和70.40%,说明在200 μmol/L的H2O2中暴露4 h,Caco-2细胞内发生了氧化应激。但是,用质量浓度为5~75 μg/mL的脱盐玉米肽预处理6 h后再暴露于H2O2中,脱盐玉米肽以浓度依赖的方式抑制了氧化应激细胞中抗氧化酶活力的降低。
SOD是超氧阴离子自由基清除因子,是生物体内清除自由基的重要物质[30]。与H2O2组相比,随着脱盐玉米肽质量浓度的增加,虽然SOD的活力逐渐增加,但仅75 μg/mL玉米肽可以使SOD活力显著增加,比H2O2组增加了60.50%,且与对照组间差异不显著(P>0.05)。由此说明,脱盐玉米肽可以缓解由超氧阴离子自由基诱导的Caco-2细胞的氧化性损伤。
γ-GCS是合成谷胱甘肽(glutathione,GSH)的限速酶,GR可以催化谷胱甘肽二硫化物还原为GSH,γ-GCS和GR活力的升高可以促进GSH的合成,进而增强细胞清除过氧化物的能力[31]。随着脱盐玉米肽质量浓度的增加,γ-GCS和GR的活力逐渐增加,与H2O2组相比,50 μg/mL玉米肽可以使γ-GCS和GR的活力显著增加,分别是H2O2组的2.57 倍和1.96 倍,说明脱盐玉米肽通过增强γ-GCS和GR活性而对细胞内GSH合成产生积极影响,可以缓解由过氧化物诱导的Caco-2细胞的氧化性损伤。
CAT是催化H2O2分解成氧和水的酶,是生物防御体系的关键酶之一[28]。随着脱盐玉米肽质量浓度的增加,CAT的活力逐渐增加,与H2O2组相比,50 μg/mL玉米肽可以使CAT的活性极显著增加(P<0.01),是H2O2组的2.70 倍。因此,脱盐玉米肽可以加速H2O2分解,降低由H2O2诱导的Caco-2细胞的氧化性损伤。
综上所述,脱盐玉米肽通过增加细胞内抗氧化酶的活力,加速细胞内H2O2、超氧阴离子等活性氧自由基的清除,进而拮抗了H2O2诱导的Caco-2的氧化性损伤。Wang Liying等报道了相似的结果,玉米肽可以上调HepG2细胞中的内源性抗氧化酶活力而抵抗氧化应激[28]。研究表明,抗氧化肽的这种功能与Kelch样环氧氯丙烷相关蛋白-1-核因子E2相关因子2/抗氧化反应元件(Keap1-Nrf2-ARE)信号通路、核转录因子信号通路和丝裂原活化蛋白激酶信号通路的调节有关[32-33]。因此,在本研究基础上,需要进一步从分子水平上研究脱盐玉米肽拮抗H2O2诱导的氧化性损伤的确切作用机理。
3 结 论
玉米肽制备过程中引入的盐分限制了其在食品工业中的应用。本实验采用截留分子质量150 Da的纳滤膜对玉米肽进行脱盐处理,以膜通量、电导率、Na+质量分数、脱盐率和产物抗氧化活性等为检测指标,确定了不影响玉米肽抗氧化活性的纳滤工艺参数。另外,质量浓度为5~1 000 μg/mL的脱盐玉米肽对Caco-2细胞没有毒性,质量浓度为75 μg/mL的脱盐玉米肽可通过提高细胞内的SOD、GR、CAT和γ-GCS抗氧化酶活力而显著提高由H2O2诱导的氧化性损伤的Caco-2细胞存活率。在此基础上,需要对脱盐玉米肽的抗氧化机制进一步进行研究。
