黄瓜贮藏中微生物信息三维荧光判别及其数量监控模型构建
2021-03-31刘雪茹于慧春袁云霞李孟丽
刘雪茹,李 欣,殷 勇,于慧春,袁云霞,李孟丽
(河南科技大学食品与生物工程学院,河南 洛阳 471023)
黄瓜是世界范围内普遍栽培的重要蔬菜作物,以其丰富的营养、独特的风味和多样的食用方式而深受人们喜爱,在人们的日常生活中占据重要的地位[1]。但其生长周期短,采摘后不易贮藏,常温下果皮会逐渐变黄,果肉发白变糠,迅速软烂腐败,呈现出不同性状的侵染性病害特征,造成食用品质大幅下降[2]。黄瓜腐败伴随的各种理化反应与微生物增殖密切相关,微生物量成为影响黄瓜品质的重要因素。因此,以微生物分析为基础,融合计算机信息技术及统计学分析[3],通过研究黄瓜表面微生物在不同贮藏条件下的特征信息,可实现对微生物含量的快速检测,以数据驱动实现应急响应,探寻建立黄瓜腐败变质的监控方法,有助于黄瓜后期的贮藏管理及后续的加工处理工作[4]。
荧光光谱技术是近年来发展起来的新型分析检测技术,可用于控制食品品质、鉴别食品真伪、分析食品种类、追溯食品来源、检测药物残留等,在食品安全领域有着广阔的运用前景[5]。前期研究结果表明,三维荧光光谱虽然可获取丰富的样本信息,但存在噪声、干扰变量等冗余信息,增加了检测模型建立的难度[6]。因此,如何对全谱数据进行分解、选择特征变量信息,成为荧光信息稳健分析的前提。
色氨酸、酪氨酸和苯丙氨酸是微生物体内的主要荧光物质,其含有的饱和共轭环状结构能发出天然荧光[7-10]。对细菌菌株的研究均表明色氨酸、酪氨酸和苯丙氨酸具有独特的双峰荧光特征[11-14],但是由于它们的发射光谱相互重叠而不能直接测定[15],且苯丙氨酸的荧光强度极弱[16]。因此,在贮藏过程中,拟采用三维荧光光谱仪对黄瓜表面微生物样本信息进行采集,根据核心一致诊断(core consistency diagnosis,CORCONDIA)法确定组件数,通过交替三线性分解(alternating trilinear decomposition,ATLD)算法将光谱分解为不同组件,以微生物主要内源荧光物质类色氨酸为基础选择其中有效组件,通过区域积分法获得相应区域积分值,并通过多元逐步回归构建微生物数量与各区域积分值的函数表达式,进而构建了微生物数量变化情况的监控模型,为实现黄瓜贮藏过程中品质变化的快速监控及腐败预判提供依据。
1 材料与方法
1.1 材料
于2019年12月2日从河南省洛阳市大张超市购买同一批次黄瓜500 kg,品种为‘博新201’,新鲜程度较一致。
1.2 仪器与设备
Cary Eclipse型荧光光谱仪美国安捷伦公司;H1650-W型医用离心机湖南湘仪实验室仪器开发有限公司;DNP-9022型电热恒温培养箱上海精宏实验设备有限公司;XW-80A型漩涡混合器海门市其林贝尔仪器制造有限公司。
1.3 方法
1.3.1 黄瓜的贮藏与处理
由于黄瓜在实际运输、贮藏和销售过程中多处于常温环境,同时考虑到贮藏时间仅影响腐败进程,因此为缩短贮藏实验时间,将黄瓜分层架藏于常温贮藏库中。温湿度记录仪显示贮藏室基本维持在温度(15±1)℃、相对湿度(65±1)%条件下,无较大波动。每天随机选取5 根黄瓜进行三维荧光信息检测和微生物平板培养计数。为确保实验覆盖整个黄瓜贮藏进程,共采集了15 d的贮藏数据以用于研究分析。
1.3.2 荧光信息采集
每天从贮藏库的不同货架层随机选取5 根黄瓜作为检测样本,将塑料模具固定于黄瓜头部,露出10 cm2表皮面积进行采样(黄瓜腐败多从头部开始)。用无菌离心管盛装3 mL质量分数0.9%的灭菌生理盐水,将无尘布棉签浸润生理盐水后,以45°倾斜于黄瓜表面,平稳缓慢地擦拭取样。收集取样后的棉签头置于离心管中,用振荡器混匀1 min后获得微生物原液。为避免菌液浓度过高导致检测器饱和[14],用生理盐水将原液稀释5 倍,制成处理组待测菌悬液,并重复上述步骤,用未采样棉签头制作空白对照。
将待测样品注入微量石英比色皿,放入荧光光谱仪样品池扫描获取三维荧光数据,激发波长为200~400 nm,发射波长为260~550 nm,采样波长间隔为5.00 nm,电压为800 V,扫描速率为1 200 nm/min。
1.3.3 样本表面微生物的培养和计数
为保持微生物培养与荧光信息采集的一致性,将用于荧光信息采集的待测菌悬液稀释到覆盖适合计数范围的浓度,平行涂布3 个平板。倒置于37 ℃恒温箱,培养24 h后进行菌落计数,并根据稀释倍数和采样面积换算出黄瓜表面单位面积微生物菌落数,参考GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》[17],结果用CFU/cm2表示,采用SPSS软件对数据进行单因素方差分析。
1.4 数据处理
1.4.1 样本荧光数据预处理
对初始三维荧光数据进行预处理,采用基于Delaunary的三次多项式插值方法,以邻近区域的数据为基准进行三维插值,以消除光谱中瑞利散射的影响。然后对三维光谱数据进行Savitzky-Golay(SG)多项式曲面平滑降噪处理[18]。
1.4.2 CORCONDIA法确定组件数
为分离复杂化合物中的光谱重叠、量化整个体系中主要物质的浓度,采用CORCONDIA法确定合适的因子数。CORCONDIA法由Bro等[19]提出,通过计算平行因子模型中的超对角矩阵与最小二乘拟合阵之间的相似程度(即核心一致值)来估计组件数。公式(1)为核心一致性函数表达式。

式中:i、j、k分别代表三维荧光矩阵对应的第i个激发波长、第j个发射波长和第k个混合物样本;gijk为用Tucker3模型得到的核心矩阵的元素;tijk为三维荧光矩阵的单位超对角矩阵元素;N是模型中组件的数量。
当N小于或等于正确组件数时,函数值接近于100%,模型符合三线性;当N大于正确组件数时,函数值接近于零甚至为负数,则该模型偏离三线性。按照CORCONDIA分析原理,当取某组件数时,若函数值小于60%,那么该组件数减一即为体系的最佳组件数[20]。
1.4.3 ATLD算法分解三维数据
ATLD算法[21]是一种具有迭代特点的二阶张量校正方法,具有快速收敛性和对估计组件数量不敏感的优点。利用交替最小二乘原理,借助基于奇异值分解的广义逆计算方法[22],通过交替最小化目标函数,实现三维数据分解。
1.4.3.1 三线性成分模型
假设伴随黄瓜贮藏进程的测试样本数为K,激发波长数为I,发射波长数为J,将其收集到三维响应矩阵XIJK中。若该立体矩阵XIJK满足式(2)中三线性成分模型,则可被唯一分解为3 个基础矩阵(相对激发强度光谱阵A、相对发射强度光谱阵B、样本相对浓度阵C)和三维残差矩阵E。

式中:ain是相对激发强度光谱阵A(I×N)的元素;bjn是相对发射强度光谱阵B(J×N)的元素;ckn是贮藏过程样本相对浓度阵C(K×N)的元素;eijk是三维残差数阵E(I×J×K)元素;xijk是三维响应数阵XIJK(I×J×K)中的元素;N为对体系做出贡献的总组件数,包括主要感兴趣物质、溶液背景(生理盐水和黄瓜表面杂质)和仪器噪声的干扰[23]。
1.4.3.2 ATLD算法
三线性成分模型可分别沿着激发光谱通道i,发射光谱通道j和样本数k分解为3 个切片矩阵Xi..、X.j.和X..k,因此三线性成分模型可以表示为以下3 个等价方程(式(3)~(5))[24]。

式中:a(i)、b(j)、c(k)分别是相对激发强度光谱阵A的第i行向量、相对发射强度光谱阵B的第j行向量、相对浓度阵C的第k行向量;diag(.)表示对括号中方阵取对角元素。
上述3 个向量可由交替最小化损失函数(即残差矩阵元素的平方总和)得出[25],其函数表达式如式(6)所示。

在迭代过程中不断更新矩阵A、B和C,当损失函数σ收敛到预设值ε时,最终分解完成。收敛准则为式(7)。

式中:ε取10-6;m为迭代次数。
1.4.4 荧光区域积分
由ATLD算法可获得与微生物内源荧光信息相关的组件,将其重新构成单独的三维荧光光谱矩阵。采用优化的自适应Simpson积分算法[26],根据不同的激发和发射波长,划分为内源荧光团形成的积分区间D,进行二重积分数值计算,求出荧光区域i的体积积分值Фi(式(8)),同时将各区域荧光积分进行标准化处理(式(9))[27],保证精度的同时提高计算效率。

式中:Фi为荧光区域i的积分体积/(au·nm2);Фi,n为标准化区域积分值;x为激发波长/nm;y为发射波长/nm;f(x,y)为激发-发射波长对应的荧光强度(au);D为内源荧光团积分区间,其中a≤x≤b为激发波长范围;c≤y≤d为发射波长范围;MFi为该区域所占面积与总区域面积比值的倒数。
1.4.5 逐步回归模型的构建
将各区域荧光标准积分值作为自变量X,黄瓜表面微生物计数结果作为因变量Y,进行逐步回归分析[28]。此外采用二元四次逐步回归,并考虑各因素之间的交叉项,逐个剔除了不显著因素,选出最佳回归方程,构建黄瓜表面微生物数量回归检测模型。评价方程的变量对Y解释能力的指标为决定系数R2,其范围为[0,1],越接近1,说明模型对数据的拟合越好。
2 结果与分析
2.1 样本表面微生物的计数结果
伴随贮藏时间不断调整黄瓜表面菌液的稀释倍数,表1为微生物平板培养的计数结果。图1A为贮藏过程中微生物的变化曲线,可以更加直观地反映其变化规律。

表 1 贮藏过程中微生物培养计数结果Table 1 Microbial counts on cucumber during storage

图 1 黄瓜贮藏过程中表面单位面积平均微生物菌落数(A)、表观状态(B)及对应微生物的培养状态(C)Fig. 1 Average microbial count (A), appearance (B) and colony morphology (C) on cucumber samples during storage
由图1可知,在贮藏期间黄瓜表面菌落数呈现“S”型曲线增长,但由于不能保证黄瓜随机取样的绝对均匀性,导致品质接近期间微生物菌落数略有波动,但整体呈现明显上升趋势。贮藏前6 d,黄瓜表面微生物数量增长缓慢,仅为初始菌落数的9.1 倍,黄瓜表皮色泽青翠,顶花带刺,切面新鲜;从第7天开始,微生物数量大幅度增加,达初始菌落数的77.52 倍,黄瓜表面色泽墨绿,瓜刺部分脱落,顶花萎蔫,切面较新鲜,个别黄瓜由于搬运过程中擦伤开始出现腐败;至第12天,微生物数量达初始的184.65 倍,瓜色褪绿,瓜刺完全脱落,切面变白,贮藏架各层均出现不同程度腐败。
根据黄瓜表面微生物培养计数结果和感官变化的综合评价,判断这批黄瓜在第7天开始腐败。结果表明,贮藏过程中黄瓜品质变化与微生物数量及其波动幅度具有一定关联,微生物增殖是造成黄瓜腐败的主要因素,微生物数量越多,黄瓜越接近腐败。因此,微生物数量预测是实现黄瓜贮藏过程中腐败进程监控和采取处理措施的重要依据。
2.2 荧光数据预处理结果

图 2 数据预处理前(A)、后(B)的三维荧光光谱图Fig. 2 Comparison of 3D fluorescence spectral data before (A) and after (B) preprocessing
图2A为黄瓜表面微生物悬液的原始三维荧光图谱,图2B为去除瑞利散射并经SG平滑处理后的三维荧光图谱。通过对比发现,原始三维荧光光谱存在一定噪声信号,且光谱中的特征峰受到二级瑞利散射的严重干扰。在去除了瑞利散射,且经过SG平滑处理后有效减少了原始光谱存在的噪声干扰,使微生物悬液的特征峰更加明显清晰,为后续进一步的分析工作奠定了良好基础。
2.3 组件数确定
在对黄瓜表面微生物菌悬液中主要荧光物质进行判别之前需要选择正确的组件数,因此,首先采用CORCONDIA法对预处理之后的三维荧光数据进行组件数估计。图3为取组件数为1~7时对应的核心一致值。由核心一致诊断可知,随组件数的增加,核心一致值逐渐降低。当组件数取1~2时,核心一致值较高,接近于100%;当组件数取3~4时,核心一致值略有下降,但始终大于80%;而当组件数取5时,核心一致值从较高水平骤降低至40%左右,远小于60%。因此,从图3结果可以判断出微生物菌悬液样品的最佳组件数为4。

图 3 CORCONDIA法确定组件数Fig. 3 Number of components determined by core consistency diagnosis
2.4 微生物信息判别

图 4 ATLD算法获得的各组件相对激发强度光谱图(A)、相对发射强度光谱图(B)和相对浓度图(C)Fig. 4 Relative excitation intensity spectra (A), relative emission intensity spectra (B), and relative concentration (C) of each component obtained by ATLD algorithm
采用ATLD算法按组件数4对三维荧光矩阵进行分解,得到各个组件的相对激发强度光谱图、相对发射强度光谱图和贮藏过程各组件的相对浓度。由图4A可知,组件1和组件3均在特定激发波长范围内具有明显双峰结构,且略有交叠;由图4B可知,组件1和组件3在特定发射波长范围处具有荧光单峰;比较图4C中各组件相对浓度,发现组件1所代表的物质具有较高荧光量子产率,且伴随贮藏进程有较大波动。

表 2 组件荧光峰范围及其对应种类Table 2 Wavelength ranges and types of component fluorescence peaks
分析光谱数据发现,如表2所示,组件1的两个荧光峰分别位于激发/发射波长即λEx/λEm=225 nm/342 nm和λEx/λEm=275 nm/342 nm附近,与类色氨酸的低激发荧光峰(λEx=220~230 nm/λEm=320~350 nm)和高激发荧光峰(λEx=270~280 nm/λEm=320~350 nm)的位置相符,且相对浓度较高,这表明该组件代表类色氨酸;组件2虽然没有明显的荧光峰,但富含一定的信息量,结构复杂,与黄瓜表面附带的土壤腐殖质、农药残留和可溶性微生物代谢产物等构成的复杂溶液背景荧光有关;组件3的两个荧光峰分别位于λEx/λEm=220 nm/290 nm和λEx/λEm=260 nm/290 nm附近,分别与类酪氨酸低激发类荧光峰(λEx=220~230 nm/λEm=300~310 nm)和高激发类荧光峰(λEx=270~280 nm/λEm=300~310 nm)的波长位置接近,表明组件3代表类酪氨酸;组件4无明显荧光峰,且含有负值,在贮藏过程中相对浓度无较大波动,信息含量低,视为仪器噪声。由于组件1与类色氨酸的指纹图谱对应精准,相对浓度高,信息含量大且受其他成分信号干扰影响小,后续着重对组件1的荧光光谱进行分析处理。
2.5 微生物信息表征
为进一步细化光谱信息,充分刻画各组件中特征峰的变化情况,采用荧光区域积分计算方法,参考表2中类色氨酸的荧光峰范围,对分离出的组件1(图5)中低激发类色氨酸区域I和高激发类色氨酸区域II进行积分计算,获得积分结果见图6。
由标准化区域积分值发现,用于表征微生物信息的类色氨酸的荧光总量伴随黄瓜贮藏进程不断增加,其中低激发类色氨酸的标准区域积分值远大于高激发类色氨酸,且两者具有相似的变化趋势。
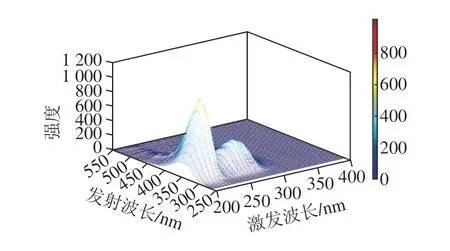
图 5 组件1的特征三维荧光光谱图Fig. 5 Characteristic 3D fluorescence spectra of component 1

图 6 类色氨酸的区域积分值Fig. 6 Regional integral values of tryptophan-like fluorescence
2.6 微生物数量监控模型构建结果
为建立微生物内源荧光信息与微生物数量之间的关系,从黄瓜贮藏过程采集的15 d测试样本(共18 个)中随机选取17 个样本,以微生物计数结果作为因变量Y(微生物数量范围为5 000~1 182 000 CFU/cm2),对应组件1特征光谱中的高激发类色氨酸标准区域积分值X1和低激发类色氨酸标准区域积分值X2作为自变量,采用二元四次逐步回归方法建立微生物数量监控模型( 为预测值),剩余1 个样本进行模型检验。式(10)为所构建的回归方程。

结果表明,在显著水平α=0.05下,R2=98.309 8%、F=58.166 1>F1-0.05=3.74、P=2.741 9×10-6<0.05、均方根误差=69 218.5,检测误差较小且决定系数较高。校验样本的预测结果为779 828 CFU/cm2,而该样本代表的实际微生物菌落数为788 000 CFU/cm2,相对误差为1.037 1%。因此,该结果可有效证明:根据构建的二元四次逐步回归模型可预测出黄瓜表面单位面积腐败微生物数量,实现复杂体系中微生物的定量分析。
结合黄瓜在不同贮藏阶段表面微生物数量的变化特点,发现在贮藏第7天黄瓜开始出现小批量腐败,至第12天黄瓜大规模腐败变质,均伴有以荧光信息为载体的微生物数量的激增。因此,根据三维荧光光谱分析技术,通过建立微生物数量变化的监控模型,对黄瓜贮藏过程微生物的数量和增值情况进行实时监控,可为贮藏过程中黄瓜品质变化的快速监控及腐败预判提供参考的依据。
3 结 论
本实验将三维荧光光谱检测技术应用于黄瓜表面微生物数量的快速检测,采集贮藏过程中黄瓜表面微生物悬液的荧光数据,在预处理的基础上,采用CORCONDIA法估计其组件数为4;运用ATLD算法提取4 个组件的特征光谱,判别其中与微生物信息相关的组件,并结合荧光区域积分法进一步对感兴趣区域进行定量分析;同时,运用二元四次逐步回归方法建立区域积分值与微生物数量的监控模型。结果表明,ATLD算法分离出的组件1和组件3具有明显双峰结构,其特征峰位置符合类色氨酸和类酪氨酸特定荧光峰范围,是微生物主要内源荧光团。因组件3所代表的类酪氨酸荧光强度低且变化不明显,故针对代表类色氨酸的组件1采用荧光区域积分法计算其高激发类色氨酸和低激发类色氨酸区域的标准荧光区域积分值,并构建有效的微生物数量监控模型。本研究结果表明,采用ATLD算法对复杂溶液中微生物相关目标物质进行定性和定量分析是十分有利的,能够有效利用三维荧光数据的丰富信息,避免了化学分离和微生物培养计数过程中耗时、耗材、操作繁琐的问题。有助于实现黄瓜贮藏过程中品质变化的快速监控,并为预判黄瓜腐败提供了依据。
