Stanford A型主动脉夹层术后肾脏功能损伤的危险因素
2021-03-31李赛兰周春玉林雁娟黄曲波
李赛兰 周春玉 林雁娟 黄曲波
A型主动脉夹层因累及升主动脉,极易并发主动脉破裂或心包填塞等,属于凶险异常的急危重症,往往需立即实施开放性手术治疗[1-2],据统计[3],国内67% 的主动脉夹层病变属于A 型,发生率接近3 例/ 10 万人/年。同其他心脏手术比较,Stanford A型主动脉夹层患者术后肾脏功能损伤(AKI)发生风险仍较高,发生率高达18%~67%[4],较常规心脏手术更为复杂。有研究指出[5-6],术后肾脏功能损伤有2%~8%要行肾脏代替治疗(RRT),A型主动脉夹层术后AKI患者预后相对较差, Stanford A型主动脉夹层术后肾脏功能损伤患者1年内病死率约为未并发AKI的2.55倍[7]。可能与肾源性水钠潴留、炎症因子和毒素蓄积,肺水多、缺氧,呼吸机带管时间长等相关[8]。因此,本研究调查分析Stanford A型主动脉夹层术后AKI的高危因素,进而为临床早期预测与管理提供有效证据支持,现报道如下。
1 对象与方法
1.1 研究对象
收集2017年 1月—2019年12月医院心血管外科确诊且顺利行A型主动脉夹层手术的179例患者为研究对象,均由同组外科医师和麻醉医师实施手术,术后进入ICU监测治疗。根据术后早期是否存在AKI,将发生AKI 60例作为病例组,未发生AKI 119例作为对照组。纳入条件:年龄18~75岁;首次在医院接受A型主动脉夹层术,且术后生存期超过1年;患者与家属自愿参与本次调查。排除条件:术前合并慢性肾功能不全、尿毒症者;围术期使用肾毒性相关药物;合并心力衰竭、脑血管意外、肝功能不全等重要脏器损伤疾病;妊娠患者;中途因各种因素退出调查者。
1.2 调查内容及方法
收集患者病历资料,线上填写所需基本资料,内容包括:性别、氧合指数 (mmHg)、APACHEⅡ评分(采用急性生理学及慢性健康状况评分系统测评)、大剂量血管活性药、年龄、BMI值、双侧肾脏灌注欠佳、体外循环(CPB)时间、监测膀胱温度、术中红细胞输注等。
179例患者均接受A型主动脉夹层手术。术中鼻咽降温至约25℃,平均动脉压维持于60~90 mmHg(1 mmHg=0.133 kPa),选择性脑灌注时间12~31 min,主动脉阻断时间与体外循环时间分别处于100~193 min和138~390 min。术后责任护士实时监测尿量、血生化、凝血等指标,收集术后30 d内并发症发生率。院后1个月、3个月、6个月、12个月做好复查与随访工作。
AKI诊断标准[9]:根据全球改善肾脏疾病预后 (KDIGO) 相关标准,术后血肌酐SCr(绝对值)>176 μmol/L或增高>44 μmol/L,或肾功能在7 d内迅速减退,或持续6~12 h无尿、少尿[<0.5 ml/(kg·h)]。
1.3 统计学处理
采用SPSS 22.0统计学软件进行数据处理。单因素分析,计量资料以“均数±标准差”描述,组间均数比较采用t检验;计数资料比较采用χ2检验。采用多因素Logistic回归分析A型主动脉夹层术后AKI发生的独立危险因素。检验水准α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 A型主动脉夹层术后肾脏功能损伤影响因素的单因素分析
单因素分析显示,两组患者年龄、BMI值、双侧肾脏灌注欠佳、CPB时长、监测膀胱温度、术中红细胞输注比较,差异有统计学意义(P<0.05),见表1。
2.2 A型主动脉夹层术后AKI影响因素的多因素Logistic回归分析
将术后早期是否存在AKI设为因变量,将年龄、BMI值、双侧肾脏灌注欠佳、CPB时长、监测膀胱温度、术中红细胞输注设为自变量,进行多因素Logistic回归分析,结果显示,年龄、BMI值、双侧肾脏灌注欠佳、CPB时长、监测膀胱温度、术中红细胞输注是A型主动脉夹层术后AKI的独立危险因素(P<0.05),见表2。

表1 A型主动脉夹层术后肾脏功能损伤的单因素分析
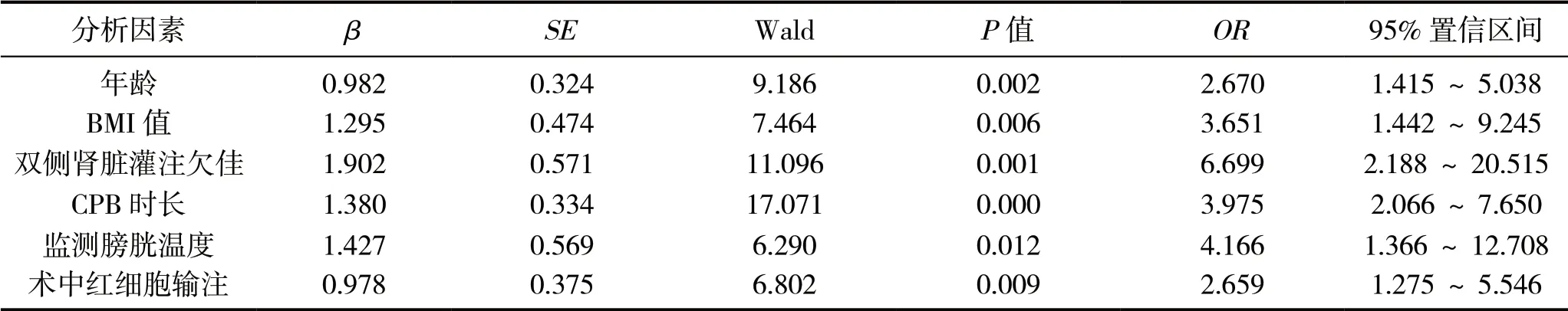
表2 A型主动脉夹层术后AKI的多因素Logistic回归分析
3 讨论
既往关于心脏术后AKI高危因素的调查研究显示,年龄、术后呼吸衰竭、左心室射血分数等[10],但较少探究急性Stanford A型主动脉夹层术后AKI的高危因素。Stanford A型主动脉夹层术后并发症多,加之体外循环(Cardiopulmonary bypass,CPB)、输血过程的诸多风险,其术后AKI整体发生率接近18%~55%,其中轻中度AKI居多,仅2%~15%患者需行连续性肾脏替代治疗(CRRT)[11-12]。尽管如此,术后并发AKI患者30 d院内病死率仍接近9%~27%。本研究回顾性分析179例我科进行Stanford A型主动脉夹层术患者,AKI发生率约为33.52%,经多因素Logistic回归分析结果显示,年龄(OR=2.396)、双侧肾脏灌注欠佳(OR=8.725)、BMI值(OR=3.454)、监测膀胱温度(OR=4.180)、CPB时长(OR=2.165)、术中红细胞输注(OR=2.291)均为此类手术患者发生AKI独立危险因素。
研究提示[13],年龄越高,Stanford A型主动脉夹层术后30 d内与远期生存率受影响越大,AKI发生风险也升高,这与本调查得出结论相吻合,术后AKI群体中年龄>60岁约占69.01%,是术后AKI的独立危险因素(OR=2.396,P=0.002),原因可能是血流动力学适应力随年龄增大逐步降低,肾脏血流量减少,易受利尿药物影响,同时老年患者对血管舒张因子反应更迟钝,导致术后AKI发生率升高。
双侧肾脏灌注欠佳亦为术后AKI发生独立危险因素,这是由于双侧肾动脉一定程度累及、激活肾素-血管紧张素-醛固酮系统,升高收缩压,使假腔持续扩张,肾脏血流持续减少,发生肾脏缺血,致使术后AKI发生率偏高[14]。
一项关于肥胖人群Stanford A型主动脉夹层术后AKI发生研究证实[15],BMI值过高是发生术后AKI独立危险因素,Englberger[16]也获得类似结果,本次也得出BMI值是术后AKI的独立危险因素,其原因可能为高BMI值患者脂肪组织影响肾脏血流动力学,而脂肪组织类型与分布也与术后肾脏功能密不可分,祝中来[17]报道的借助CT扫描方式量化腹部脂肪,也证实了上述分析。
监测膀胱均温度>28℃,即浅低温,是术后AKI发生危险因素,原因在于体温降低与复温时长、CPB时间和手术时间呈反比,同时易发生血小板功能紊乱与凝血障碍,对输血要求更高,CPB血液灌注肾脏受缺血—再灌注损害加深,肾小动脉收缩,肾小管耗氧量增加,损害肾氧合能力,造成邻近肾小管功能损伤。
李卓东报道[18]CPB>180 min患者AKI风险显著更高,这与本次调查结论相似,原因可能是CPB时长延长,肾脏获取最佳灌注压力难度加大,溶血风险、炎性反应增加,持续时间与肾脏经历缺血性损伤严重度呈正比。
此外,术中红细胞输注>10 units是术后AKI发生又一重要原因,这与吴路加等[19]报道的红细胞使用量>5 units是AKI发生独立危险因素,这是因为红细胞存储过程,细胞膜脆弱且易变形,机体后分解为铁、游离血红蛋白,微循环障碍加重,肾脏损伤严重。
综上所述,本次调查研究指出年龄、BMI值、双侧肾脏灌注欠佳、CPB、监测膀胱温度、术中红细胞输注均为影响A型主动脉夹层术后AKI的独立相关因素,临床护士应针对上述分析制订个体化针对方案以降低术后AKI发生风险。
