甲状腺激素在无脊椎动物中的研究进展
2021-03-31董震宇叶莹莹祁鹏志迟长凤郭宝英
董震宇,杨 槐,孙 扬,陈 宇,叶莹莹,祁鹏志,迟长凤,郭宝英
(浙江海洋大学海洋科学与技术学院,国家海洋设施养殖工程技术研究中心,浙江舟山 316022)
1 甲状腺激素
甲状腺激素(TH)发挥着多种功能,包括调节新陈代谢、生理发育及神经系统调控等。在脊椎动物中,3,3',5,5'-四碘-DL-甲状腺原氨酸(T4)由甲状腺滤泡细胞所合成的甲状腺球蛋白碘化酪氨酸而来。在脊椎动物中,T4 常被认为是3,5,3,-三碘甲状腺原氨酸(T3)的前体。T3 由T4 经TH 转运蛋白和甲状腺素脱碘酶催化而来[1]。脱碘酶已被证明在鼠Muridae、文昌鱼Epigonichthys cultellus、斑马鱼Brachydanio rerio、蜜蜂Apidae、海葵Actiniaria 和水蛭Whitmania pigra Whitman 中广泛存在[2],甲状腺过氧化物酶已被证明在扁形动物、海鞘Pyrosomella verticilliata、文昌鱼、软体动物和棘皮动物中存在[3-6]。
在已研究的哺乳动物和脊椎动物中,T3 是甲状腺激素核受体(THR)的主要配体,THR 与维甲类X 受体(RXR)形成二聚体[7-8]。值得注意的是,THR-RXR 异二聚体会与DNA 中的THR 反应元件(THR response element,TRE)结合,抑制转录蛋白和辅阻遏物的结合[9]。当T3 与THR-RXR 结合后,辅阻遏物被替换为一种辅激活蛋白并促进转录。并不是所有的THR 结合体都会与TRE 结合而促进转录,大多数基因都是由THR 进行调控的[10]。
除了通过THR 来实现基因组功能,TH 还具有非基因组功能[11]。与基因组功能相比,这些功能作用更为快速,会在几秒钟到几分钟内与细胞产生生理反应。例如DAVIS,et al[12]发现TH 对心脏和神经活动的调节中,几乎所有细胞都会响应TH 的非基因组功能,所需时间仅几秒钟。
在已知TH 的非基因组功能中,存在着更多的细节,如结合的TH 主要为T4[13]。TH 与膜受体结合、与膜结合蛋白激酶结合以及与核外受体结合均会产生一定的生物学作用。心脏对TH 的快速反应来自2 种非基因组功能的共同作用,T3 与THR 结合后激活细胞质中的肌醇磷脂-3-激酶,T4 作用于膜受体和αVβ3 蛋白[14]。T4 与αVβ3 蛋白结合作用时几乎能激活所有脊椎动物细胞的受体激活有丝分裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路,T4 与αVβ3 蛋白的相互作用已被验证具有促进血管生成[15],调节中枢神经系统中的钠离子通道[16],诱导成骨细胞的增殖等功能[17]。
TH 存在于古老的生物体内并进化至今,绝大多数动物体内都存在着TH 的作用机制[18]。早在上世纪末,EALES,et al[19]便发现大量无脊椎动物体内存在着对于TH 的应答机制,近年来,在更多的无脊椎生物中TH 的作用机制被人类发现,如海胆Echinoidea(棘皮类),海鞘(被囊类),文昌鱼(头索动物)等。
2 TH 在无脊椎动物中的作用
无脊椎动物包括脊索动物(如海鞘、文昌鱼)、棘皮动物(如海胆、海星Asteroidea)、软体动物(如长牡蛎Magallana gigas)和两侧不对称动物(如海月水母Aurelia aurita)。大量研究表明,无脊椎动物中存在着TH的作用机制,而THR 则起源于脊索动物中(表1)。

表1 TH 在无脊椎动物中的作用Tab.1 The role of TH in invertebrates
2.1 脊索动物
在脊索动物中,关于TH 的研究主要集中于文昌鱼上,早在上世纪研究初期,便有研究表明TH 存在于文昌鱼中[20]。
文昌鱼的内柱相当于脊椎动物的甲状腺[21],碘化发生在内柱上,过氧化物酶和甲硫咪唑会抑制其碘化[22]。文昌鱼与脊椎动物具有较近的进化关系,通过内柱/甲状腺合成TH 似乎是脊椎动物进化的选择。在文昌鱼中,THR 会结合3,5,3’-三碘甲腺乙酸(THRIAC)控制其变态发育[23],THR 拮抗物NH3会与THR 结合抑制变态。
在文昌鱼中,T3、T4 会被转化成THRIAC,文昌鱼本身也会合成THRIAC[6]。KLOOTWIJK,et al[24]提出THRIAC 可能是脊椎动物中TH 的起源,后来逐渐进化成为T3/T4,然而,在其他无脊椎生物中暂未发现THRIAC 的生理调节作用。文昌鱼的TH 作用方式有部分与脊椎动物相似,其THR 为TH 所诱导,并且在无脊椎动物和脊椎动物中,TH 的下游信号系统有功能相近的部分[25]。文昌鱼体内的TH 作用机制与脊椎动物的具有一定相似性,主要区别在于文昌鱼中作为活性成分的是THRIAC 而不是TH。文昌鱼TH 作用机制,既具有普遍存在于脊椎动物中的特征,同时也具有存在于无脊椎动物中的特征,如对THR 的诱导调节,TH 的非基因组功能,对变态发育的影响。
2.2 尾索动物
已有研究表明,属于尾索动物的海鞘从幼体到成体均会在内柱合成T4[26]。但是海鞘体内并没有甲状腺球蛋白,这意味着内柱中有一种碘化蛋白能代替甲状腺球蛋白进行TH 的合成[21]。海鞘中也具有与脊椎动物相近的甲状腺过氧化物酶[3]和脱碘酶[27]。在棘皮动物、软体动物和许多脊椎动物中,T4 具有加速变态发育的作用[28],抑制TH 的合成会延缓或停止变态的过程,而通过补充外源性TH 则可以恢复其变态发育[29-30]。THR 尚未在海鞘中被发现,但是在虎舌红Ardisia mamillata 中T3 会与核受体结合[31],在玻璃海鞘Ciona intestinalis 中克隆到了THR 直系同源物[32]。
2.3 棘皮动物
棘皮动物包含海胆,海星,海百合Crinoidea 等,在进化关系上比被囊类(尾索类)和文昌鱼距离脊椎动物更远。其中TH,尤其是T4,发挥着加速变态发育的作用,在海胆、沙钱Echinarachnius parma 和海星中均有发现[33-35],以上研究均未阐明其作用机制。
也有一些海胆自身无法合成TH,通过捕食的海藻等,利用外源性的TH 进行补充,部分可以自行合成TH,是否能自行合成TH 与海胆的品种有关系。虽然没有确定合成TH 的特定组织,海胆体内也没有内柱或甲状腺球蛋白,但可以确定的是,海胆幼体中含有TH,含量在变态前达到峰值。另外,在沙钱中发现了延缓变态的TH 抑制物[36]。
T3 与T4 已被证明存在于海胆中,对于马粪海胆Hemicentrotus pulcherrimus,T3 与T4 在幼体中可以检测到,并且随着幼体成长含量逐渐升高[37]。同时,海胆THR 已被克隆[38],但是海胆THR 对T4、T3、rT3、TETHRAC 和THRIAC 均无反应[39]。
2.4 软体动物
最近研究表明软体动物具有TH 作用系统和THR,在海兔Ovula ovum、扇贝Pectinidae 和牡蛎ostrea gigas thunberg 中发现了TH 的存在[5,40-41]。
在原肠胚形成过程中,T3、T4 水平迅速升高,变态前T3 水平缓慢升高。在鲍鱼Abalone 等腹足纲软体动物中,T4 可以诱导壳的形成和发育速度。多溴联苯醚会影响脊椎动物TH 的合成和转运,也会降低菲律宾帘蛤Ruditapes philippinarum 的T3、T4 水平[42]。
近期有研究成果,在长牡蛎中克隆到了THR 序列,通过qRT-PCR 检测发现,在TH 存在的情况下,THR 的合成进行负反馈调节,T3、T4 和THRIAC 不会导致THR 表达量上升。
TH 的功能在软体动物中尚未得到明确的验证。在WAHAB,et al[43]和CORNFORD,et al[44]的研究中,宿主体内的TH 水平会影响其体内寄生虫的发育;在SAULE,et al[45]的研究中,当宿主的TH 水平降低时,其寄生虫曼氏吸血虫Schistosoma mansoni 发育正常。THR 已经在曼氏吸血虫、肝吸虫Clonorchis sinensis 中被克隆得到[46-47]。在曼氏吸血虫中,THR 与RXR 结合;在肝吸虫中,T3、T4 促使G6Pase mRNA 升高,抑制MDH mRNA,同时对新陈代谢具有调控作用。目前软体动物中的TH 作用机制尚不明确,TH 会与THR 结合发挥生物学功能,也会与RXR 相结合。
2.5 两侧不对称动物
至今为止还没有在两侧不对称动物中发现THR,海绵中含碘量约占其总重的10%,但是海绵中尚未发现碘化物。珊瑚虫Coral 也会吸收碘进入其骨骼,约占其体重的25%,这些碘均以T4 形式存在,集中在其活体细胞与骨骼之间,柳珊瑚Sea whip Gorgonian 中T4 会促进钙的沉积。使用T4 处理海月水母的幼虫会使其耳石消失[48],如果将海月水母暴露在碘或T4 中,会影响其无性生殖[49]。但是在FUCHS,et al[50]的研究中并没有发现TH 影响海月水母无性生殖中的直接证据,并认为早期的研究结果只能证明存在一些间接性作用。在水螅的刺细胞和性腺中,含碘量很高[51],但在刺胞动物中,尚未发现T3 的存在[52]。
在已研究的生物中,两侧不对称动物体内缺乏THRs,但是却对TH 有应答。在刺胞动物和海绵中含有碘的化合物和T4,推测可能参与骨骼、细胞的发育并发挥作用。
3 甲状腺激素核受体
3.1 THRs 及其亚型
THRs 属于核受体超家族,THRs 是作为配体结合DNA 的转录因子。THRs 不仅与DNA 结合,同时也会与RXR 构成二聚体,THR-RXR 二聚体可以控制基因转录[53]。以往认为,当THRs 缺乏配合基时转录会被抑制,配合基出现时则会与其结合并激活转录[54]。THRs 与配合基的结合会影响其与DNA 结合[55]。脊椎动物中THRs 有两种亚型THRα 和THRβ,硬骨鱼类中THRα 还有两个亚型THRα-A 和THRα-B[56-57]。
细胞质和细胞核中存在THR,这一点是经过共聚焦显微镜和细胞成分分析验证过的。TH 促进THR从细胞质到细胞核的穿梭,THRb1 异构体和其他蛋白质,例如MAPK,磷脂酰肌醇3 激酶(PI3K) 的p85 调节亚基和核受体共激活复合物,均被发现于TH 处理的细胞质中,形成复合物可能有利于促进THR 进入细胞核,并启动基因转录或细胞增殖。T3 也会导致THRa1 留在细胞核内[58]。
在发育研究中发现,THRα 在发育早期表达,THRβ 则在晚期表达[59]。两栖动物中,THRβ 由T3 诱导,出现时间较晚,在变态发育时期表达[60]。非洲爪蟾Xenopus laevis THRα 在变态前期表达[61]。在牙鲆Paralichthys olivaceus 变态发育中,THRα-A 比THRα-B 和THRβ 前期表达量都高[62]。
在七鳃鳗Lampetra japonicum 中有两种进化方式尚不明确的THRs,即THR1 和THR2。在其体内THR1与THR2 会像THRs 一样将T3,T4 转运并发挥作用[63]。七鳃鳗是已研究的脊椎动物中唯一在变态发育过程中THs 降低的物种,对其补充THs 可推迟其变态发育[64],同时七鳃鳗中有2 种THRs 和3 种RXRs[65-66]。
脊椎动物中对THR 亚型的研究主要有对小鼠基因的敲除与对人类甲状腺素综合症的研究(表2)。在小鼠中,敲除THRβ 基因会引起脑垂体促甲状腺激素(TSH)分泌失调[67],其中THRβ2 比其他THRβ 亚型对TSH 分泌影响更大[68]。THRα 对TSH 的调控作用是极其有限的,小鼠中THRβ2 会影响视网膜中视蛋白的表达,从而影响色觉[69]。两种THRβ 都会影响人的耳蜗与听力的发育,而当成年后,只需要THRβ1 来维护耳蜗的正常工作[68,70]。在肝脏中,THRβ1 是TH 参与胆固醇新陈代谢的首要介质,THRβ1 与THRβ2 都会参与白色与棕色脂肪的转化[71-72]。在大脑中,两种亚型都会影响TH 的功能,但是THRα1 对交感神经系统的功能有明显影响[73]。类似的,THRα1 对骨骼、心脏、肠均有明显的作用,而THRβ1 则在细胞中发挥的功能较多。在甲状腺滤泡中,两种亚型都会影响TH 的合成[74]。
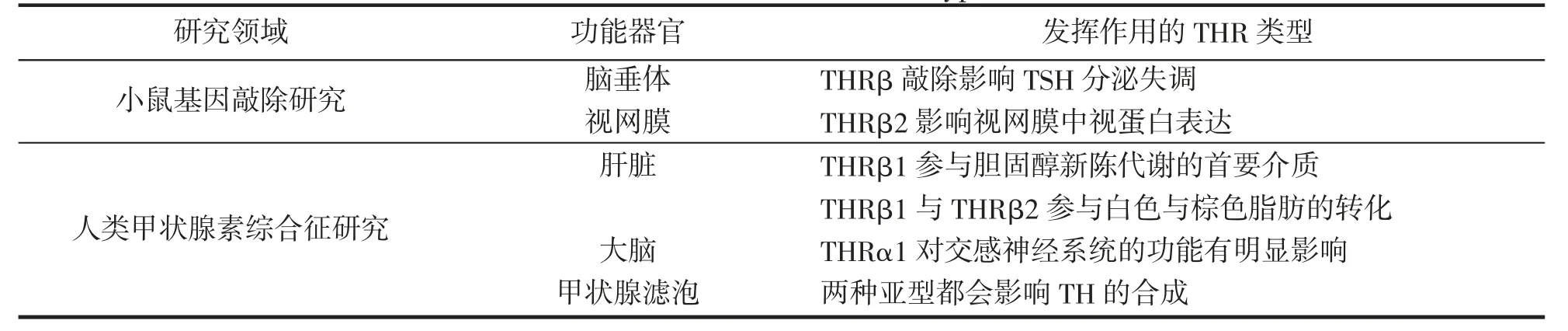
表2 人类与小鼠中几种THR 亚型的研究与功能Tab.2 Studies and functions of THR subtypes in vertebrates
3.2 THR 的调控机制
TRE 可以分为正面和负面两类。配体结合的THR 通过阳性TRE 激活转录,并通过阴性TRE 抑制转录。与正调控的靶基因相反,当TH 缺失和降低时,负调控的基因转录活性可以被激活。THR 的DNA 结合结构域(DBD)在DNA 与阳性靶基因结合中起重要作用,但在T3 调控的阴性靶基因中不发挥重要作用[75]。与THRβ1 相互作用时,T3 总是从TRE 的中心或末端开始[76]。
除了核受体转录调控模式,THR 具有其他特征,例如,THR 主要与视黄酸X 受体(RXR) 形成异二聚体,二聚体与TRE 结合,THR-RXR 异二聚体主要作用于AGGTCA 的T3 反应元件,该元件是一个由4 个核苷酸分离的正向重复序列,即DR-4 激活转录。RXR 是异二聚体的活性成分,可以结合其配体,并通过各种新机制调节THR-RXR 的活性[77]。
1997 年,NCoR1 与SMRT 蛋白首次被确认并克隆到全长序列,这两种蛋白的结构域C 区都具有THR结合位点[78-80]。NCoR1 和SMRT 蛋白都具有RIDs 结构能够与THR 和其他核受体相互作用。RIDs 与LxxLL结构共用一个规则的螺旋区域,通过这个螺旋区域使游离的THR 在第12 个螺旋上与LBD 相结合。在此结构上,NCoR1 还可以与RXR-THR 二聚体或THR-THR 二聚体结合。NCoR1 在调节转录中具有重要作用,可与组蛋白去乙酰化酶3(HDAC3)、G 蛋白通路抑制物2(GPS2)、TBL 相关蛋白(TBLR1,TBL1XR1)等结合发挥作用[81-83]。目前普遍认为与THR 结合是NCoR1 与SMRT 在TH 相关功能中发挥的主要作用。
同样的,类固醇受体辅激活物(SRC)中的SRC1 在1995 年首次被确认,之后研究得到了其两个亚型SRC2、SRC3,分析发现虽然其同源性很高,但是作用却不一致[84-85]。SRCs 中包含着LxxLL 结构,其可以与THR 等核受体相互作用。YANG Zhihong,et al[86]研究发现SRC 可与THRβ2 氨基末端结合并在TH 相关功能中发挥重要作用。并且THRs 与SRC 的各种复合蛋白也会结合并发挥作用[87]。在SRC1 敲除的小鼠中出现了类固醇受体信号的缺陷,其THR 与TSH 不会因TH 处于高水平而负调节,但是敲除SRC2 却不会影响HPT(下丘脑-垂体-甲状腺)轴的功能[88],说明SRC1 在THR、TSH、TH 的反馈调节上发挥着重要作用。
4 TH 信号通路
TH 在脊椎与无脊椎动物中,涉及诸多信号通路(表3)。

表3 TH 相关信号通路Tab.3 TH-related signaling pathway
TH 在无脊椎动物中的研究揭示了TH 合成与作用机制的进化。EALES,et al[19]在1997 年首先提出了动物最初是从食物中获取TH 这种激素来调节各项生理活动,后来进化获得了能自行合成TH 的能力。因为在海洋中各种海藻,海绵,珊瑚体内都存在着T4 形式的碘有机化合物。藻类中含有T3、T4 碘化物占总重的1%[18]。同时有些无法自行合成TH 的生物,却会对TH 有反应。如以海藻为食的海胆体内就存在着大量的外源性TH,在幼体内就会有TH 存在,水平逐渐增长直至变态[35,89]。
在长牡蛎中尽管存在着THR,并且TH 会与THR 结合调控变态发育,但通过荧光素酶检测法发现CgTHR 并不参与T3、T4 和THRIAC 调整转录活动,有推测是CgTHR 仅参与非基因组功能[44]。一种可能性是CgTHR 像脊椎动物一样通过PI3K 的途径参与非基因组作用,这可以解释为何TH 是与CgTHR 结合后影响转录,而不是直接与目的DNA 和CgTHR 结合。
在脊椎动物中,TH 的转运通过转运蛋白和跨膜核受体,其信号传递在脊椎动物发育中起重要作用[89]。在无脊椎动物中,外源性TH 在行使非基因组作用时也需要转运蛋白和核受体,这似乎是与脊椎动物共同进化而来。如刺细胞生物中含有多种能与T4 结合的整联蛋白,包括脊椎动物中存在的RGD 结合域[15],虽然刺细胞生物中没有THR,但也能结合TH 并完成非基因组功能。
在对脊椎动物的研究中,HIROI,et al[89]发现,在血管内皮细胞,THR 会结合PI3K,最终激活一氧化氮合酶。在此过程中THR 没有与RXR 形成异构体也没有结合TRE。LIU Xin,et al[90]研究发现TH 通过整合素αVβ3-PKC-PKD-HDAC5 信号转导通路促进碱性成纤维细胞成长因子(bFGF) mRNA 的表达,具有在表观遗传学层面发挥促血管新生作用的功能。整合素αVβ3 具有2 个TH 结合位点,能够结合T3、T4,促进细胞质内的THRα1、THRβ1 穿梭到细胞核,在细胞核内通过转录水平的调节,影响某些基因如VEGF、bFGF的表达[91-92]。VEGF 通过PKC/PKD 依赖途径介导Ⅱ类HDACs 中的HDAC7 磷酸化及出核,除此之外Ⅱ类中的HDAC4、HDAC5 亦可由VEGF 介导发生磷酸化及出核。bFGF 作为HDAC5 下游的靶基因,对血管形成起重要作用,细胞核内磷酸化HDAC5 降低,下游bFGF mRNA 表达增加,表明T4 通过整合素αVβ3-PKD-HDAC5 信号通路可以引起bFGF mRNA 的表达,从而在表观遗传学层面发挥促血管新生的作用。
邝娟等[93]研究发现,在甲状腺癌TPC-1 细胞中,沉默THRβ 后,p-Akt 及CCND1 蛋白水平有所下调,沉默THRβ 诱导PRMT2 后,p-Akt 及CCND1 蛋白水平进一步下调,同时PRMT2 的高表达会使THRβ 表达水平明显下调。表明PRMT2 可能通过抑制THRβ 来抑制Akt-CCND1 信号通路,对TPC-1 细胞增殖产生影响。
HASHIMOTO,et al[94]发现,类固醇反应元件结合蛋白1c(steriod response element binding protein-1c,SREBP-1c)的启动子区有TRE,SREBP-1c 激活一系列基因表达,包括脂肪酸合酶和乙酰辅酶A 羧化酶,调节肝脏脂质的合成。当THs 进入细胞质中与THRβ 结合,可促使THRβ1 与PI3K 解离,非结合的PI3K催化Akt 磷酸化,进而调节SREBP-1c 的表达。人类肝癌细胞株(HepG)中T3 诱导SREBP-1 的表达可被Akt 或ERK 抑制剂减弱[95]。识别细胞膜受体的琼脂结合T3 可促进ERK 的活化,而非琼脂结合的T3 并不能激活Akt,表明T3 可与膜表面受体整合素αvβ3 结合激活ERK[96]。因此,TH 调节SREBP-1 的表达通过两条独立的非经典途径,一是T3 通过整合素αvβ3-MAPK-ERK 通路,二是通过THR-PI3K 复合物的解离激活PI3K-AKt 通路[97]。
根据已有研究,甲状腺激素能够通过整合素αVβ3 进入细胞质,发挥非基因组功能,激活:MAPKERK1/2 信号通路、PI3K 信号通路。THs 激活的ERK1/2 促进细胞质中STATs、THRβ、ERα 等蛋白质向细胞核的转运。进入细胞核后,这些蛋白质被激活的ERK1/2 进一步磷酸化,或增强其功能,或改变其转录活性等。另外,活化的ERK1/2 可以调控细胞膜上Na+/H+交换的活性。MAPK 信号通路通过整合素αvβ3 被THs激活后,还可以诱导肿瘤细胞增殖和血管生成。PI3K 被THs 激活后,与细胞质中的THRβ 或THRα 结合,诱导下游一些特殊基因的表达,包括:ZAKI-4α、HIF-1α、GLUT-1 等。此外,被激活的PI3K 还可以激活细胞表面的Na+,K+-ATPase,并使其嵌入细胞膜中。
5 结语
在海洋无脊椎动物中存在着内源性甲状腺激素或其他含碘化合物,并且对TH 刺激有各种应答行为,但在TH 的非基因组功能上的研究很少。THR 广泛存在于各门无脊椎动物中,但相较于脊椎动物,其作用机制尚未明确。在信号通路的研究上,海洋无脊椎动物尚未有明确的研究成果。基于已有的研究,对比于脊椎动物我们可以推测,棘皮动物和软体动物中具有尚未发现的膜受体或THR 的非基因组功能配体。在腔肠动物中,THR 的缺失和T4 对细胞发育和珊瑚骨骼的矿化也值得研究。在第三代高通量测序技术的辅助下,目前已取得了大量的数据,这为研究海洋无脊椎动物的信号通路提供了极大便利与支持。在此基础上可以使用重组蛋白,免疫共沉淀和酵母双杂交等技术具体分析甲状腺激素的功能与信号通路成员。目前海洋无脊椎动物甲状腺激素信号通路分子蛋白水平的研究尚未有成果被报道,相信可以通过借鉴已知的脊椎动物部分来进行对其通路下游进行更深入的研究,揭示其作用机理。
