鸡Apob基因组织表达与CRISPR/Cas9敲除系统的构建
2021-03-30杨秋月方斐旻郁建锋顾志良
吉 琳,杨秋月,方斐旻,窦 虹,郁建锋,徐 璐,顾志良
(常熟理工学院生物与食品工程学院,苏州 215500)
载脂蛋白B(apolipoprotein B,Apob)是血浆中低密度脂蛋白(low density lipoproteins,LDL)和极低密度脂蛋白(very low density lipoprotein,VLDL)的主要蛋白质成分[1]。哺乳动物的Apob主要由肝和小肠合成,在脂类代谢、胆固醇转运[2]、吸收代谢等过程中发挥重要作用。Apob异常与冠心病[3]、糖尿病[4]、脂肪肝[5]、代谢综合症[6-8]等疾病的发生相关性较高,同时也是评估动脉粥样硬化风险的重要指标之一[9-10]。另外,近年来在家禽上的研究表明,Apob基因不仅在家禽能量代谢[11]、生长繁殖[12]、脂质代谢[13-14]等生命活动中发挥重要作用,而且可作为家禽选育的分子遗传标记。
CRISPR(clustered regularly interspaced short palindromic repeats)技术作为第三代基因编辑工具,相较于锌指核酸酶技术(zinc-finger nucleases,ZFNs)[15]和类转录激活效应因子技术(transcription activator-like effector nucleases,TALENs)[16],具有短时高效、价格实惠、靶向特异性强等优点。并且可同时靶向多个基因,因而在大量研究中被广泛应用。自CRISPR系统发现以来,科学家不断探索将其从细胞分裂与增殖的基本生物学研究应用到癌症[17-19]、精神病[20]和糖尿病[21-22]等疾病的研究,为疾病的治疗提供了新思路和新方向。Schmitt等[23]运用CRISPR/Cas9系统在Vemurafenib敏感的细胞中敲除NES(Nestin)证明,Nestin与黑色素瘤细胞获得性Vemurafenib耐药有关。Gao等[24]通过CRISPR/Cas9基因编辑技术敲除突变Tmc1基因,保留正常Tmc1基因,成功修复了小鼠模型的显性突变并缓解了听力丧失。随着更多Cas系统的开发,该系统在各种遗传性神经疾病[25]的治疗中也存在巨大的潜力。在植物研究领域,编码CRISPR/Cas系统的载体以往主要是通过农杆菌转化或基因枪轰击的方法导入植物细胞,应用于作物改良。近期,Lin等[26]构建了适用于植物的引导编辑器(plant prime editor, PPE)系统,并在重要作物中完成了引导编辑。另有研究表明,直接使用CRISPR/Cas核糖核蛋白[27-28]能更有效地导入植物细胞,介导植物基因组编辑。目前,CRISPR技术比以往任何技术都更加易用,并且在生物学、农业、微生物等研究领域都显示出了强大的优势与应用价值。随着CRISPR技术研究的不断深入和技术的不断改进,其应用会越来越广泛。
随着居民收入水平的不断提高,家禽养殖效益向好,我国家禽饲养规模持续扩大。据统计数据显示,2019年全国家禽出栏146.41亿只,较上年增长11.9%。禽肉已成为世界上第二大消费肉类,由于禽肉价格低于其他肉类,禽肉消费快速增长。据统计,2019年,我国禽肉产量2 239万吨,较2018年增长5.8%。未来随着居民肉品消费结构升级,禽肉消费量还将进一步增加。禽肉消费中鸡肉消费量占比最大,约为50%。但鸡体内过度的脂质沉积,不仅削减了鸡肉的品质和收益[29],而且对鸡的生长和繁殖性能[30]也有一定影响。因此,本试验围绕鸡的脂代谢相关基因——Apob展开,旨在探明其在鸡肝脂代谢中的作用,从分子层面为解决家禽的脂质沉积问题提供新思路。
1 材料与方法
1.1 试验材料与试剂
采集9只4周龄黄羽肉鸡的心、脑、肝、脾、肺、肾、脂肪、腺胃、腿肌、胸肌、肌胃和小肠等12个组织,液氮速冻后保存于-80 ℃冰箱备用。
大肠杆菌 (Escherichiacoli) DH5α、鸡胚胎成纤维细胞系(douglas foster-1,DF-1)、pMD-19T Vector、pX330/Cas9质粒为本实验室购买并保存;引物由苏州泓讯生物科技有限公司合成;限制性内切酶BbsI、T7核酸内切酶I (T7 endonuclease I,T7EI)均购于New England Biolabs公司;转染试剂X-tremeGENE-9购于Roche公司;100×双抗(青霉素和链霉素均为10 000 U·mL-1)、胎牛血清 (fetal bovine serum,FBS)、DMEM/F12基础培养基均购于赛默飞世尔科技公司。
1.2 试验仪器
冷冻离心机5804R(Eppendorf),PowerPacTMBasic电泳仪(Bio-Rad),7500 Real time PCR仪(ABI),制冰机SIM-F140AY6(SANYO),CO2培养箱(Thermo),超低温冰箱(Thermo),Biospectrum 410凝胶成像系统(UVP),超净工作台(苏州净化设备有限公司),全温摇瓶柜 HYG-A(太仓博莱特),立式压力蒸汽灭菌锅LDZX-75KBS(上海申安医疗器械厂),电热恒温水浴锅DK-8AX(上海一恒科技),电子天平(上海梅特勒-托利多仪器)。
1.3 试验方法
1.3.1 鸡Apob蛋白理化性质分析 根据NCBI数据库中鸡Apob蛋白氨基酸序列,利用ExPASy数据库分析该蛋白质理化性质,接着通过Pfam数据库进行蛋白结构域分析。
1.3.2 鸡各组织中Apob基因mRNA表达情况分析 采用Trizol法[31]提取各组织总RNA,使用Prime ScriptTMRT Reagent Kit将其反转录得到cDNA后,按SYBRRPremix Ex TaqTM说明书进行RT-qPCR。结果使用2-ΔCt值分析,采用GraphPad Prism软件进行作图。
1.3.3 鸡Apob基因敲除载体的构建 本试验在蛋白N端结构域对应的外显子上选取3个待敲除位点,设计合成3对sgRNA(表1)。将合成的寡核苷酸链(oligonucleotides,oligos)退火形成双链。反应体系:TE Buffer 8 μL,正、反义链各1 μL。退火程序:沸水处理5 min后,自然冷却至室温。使用T4 DNA连接酶将双链DNA与线性载体pX330/Cas9于16 ℃连接过夜,转化至大肠杆菌DH5α感受态细胞,涂布于含50 μg·mL-1氨苄青霉素(ampicillin,Amp)的LB平板。培养12 h后挑取单菌落接种于含Amp的LB液体培养基中,菌液PCR鉴定后提取阳性菌质粒进行测序。将测序成功的阳性菌扩大培养后,使用无内毒素质粒大提试剂盒提取质粒。
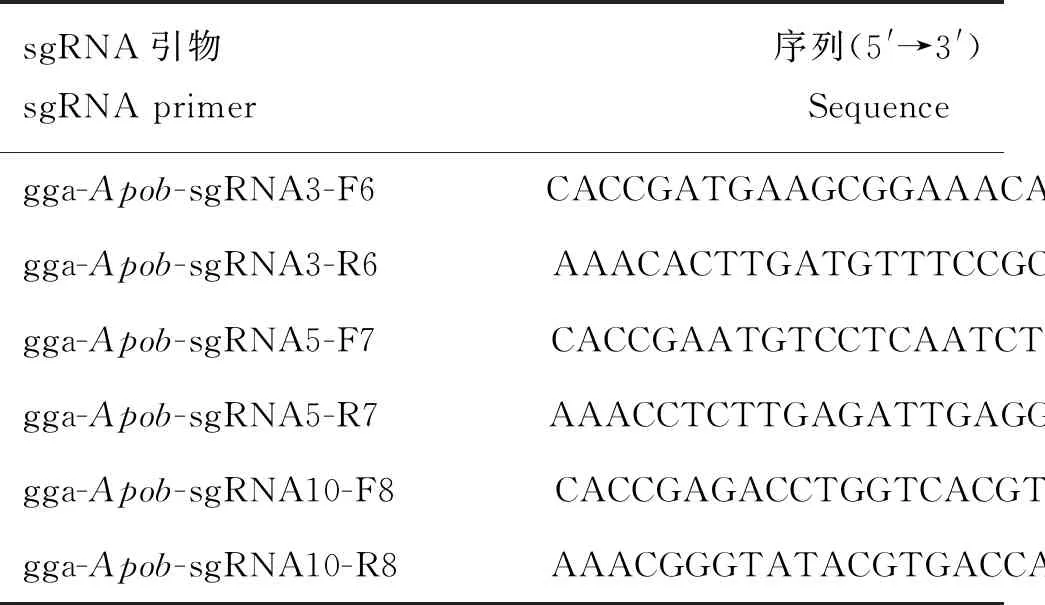
表1 sgRNA序列
1.3.4 DF-1细胞培养与转染 DF-1细胞在含1% FBS和1% 100×链霉素-青霉素的DMEM/F12基础培养基中培养。细胞汇合度达90%左右时,用磷酸盐缓冲液(phosphate buffer solution,PBS)洗涤后,加入0.25% Tyrpsin-EDTA消化。细胞脱落后加入不含抗生素的新鲜培养基,将细胞吹散后计数,以3×105个·孔-1的浓度铺于24孔板。当细胞汇合度约为70%~90%时,使用脂质体X-tremeGENE 9 DNA进行转染。以未转染的细胞为空白对照。将1 μg质粒按X-tremeGENE 9 DNA(V)∶质粒(μg)= 3∶1的比例,转染至DF1细胞。转染48 h后使用3 μg·mL-1嘌呤霉素(puromycin,puro)筛选2~3 d至对照组细胞全部死亡。去除培养基中puro,对阳性细胞扩大培养并提取基因组DNA。
1.3.5 T7EI酶切检测 以酚氯仿法[32]抽提细胞基因组DNA。利用T7EI酶可识别并切割错配双链DNA的特点,验证靶位点敲除活性。根据靶位点上、下游序列分别设计3对PCR引物(表2),以基因组DNA为模板扩增靶位点上、下游序列。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,58 ℃ 30 s, 72 ℃ 30 s,35个循环;72 ℃ 10 min。将扩增的目的片段退火后,加入T7EI酶进行酶切。反应体系:PCR退火产物5 μL,NE buffer 1.1 μL,T7EI酶0.5 μL,ddH2O补足体系至11 μL。37 ℃酶切30 min后通过2.1%琼脂糖凝胶电泳检测酶切结果。

表2 靶位点的PCR引物序列
1.3.6 TA克隆测序 将扩增的目的片段纯化回收后,与pMD-19T载体于16 ℃连接过夜;连接产物转化入感受态细胞DH5α,涂布于含50 μg·mL-1Amp的LB平板培养12 h后,取20管菌液进行测序。并计算靶位点实际敲除效率。计算公式:敲除效率=发生突变序列的菌液数/测序菌液总数×100%。
1.3.7 荧光定量PCR检测 分别提取对照组和试验组细胞RNA,通过RT-qPCR检测Apob基因敲除后其表达量变化情况。RT-qPCR方法同“1.3.2”。采用公式2-ΔΔCt值分析计算,使用GraphPad Prism软件进行作图。并用非配对t检验进行数据分析。
2 结 果
2.1 鸡Apob蛋白理化性质分析
Pfam数据库分析结果表明,鸡Apob有4个关键结构域,2个未知功能结构域以及位于C端和N端的结构域。ExPASy数据库显示,鸡Apob分子式为 C23449H37206N6214O7051S136,相对分子质量为523.356 ku,理论pI为8.44。蛋白由4 631个氨基酸组成,其中,亮氨酸含量最多,为10.6%,丝氨酸含量次之,为8.6%,半胱氨酸与色氨酸含量最少,均为0.6%。带负电荷的残基总数为533,带正电荷的残基总数为554。根据计算结果,Apob不稳定性系数为37.61,归类为稳定蛋白。其脂肪系数为90.07,平均亲水性为-0.300。
以Hphob./Kyte & Doolittle为刻度,利用ProtScale分析蛋白亲水性和疏水性(图1),该蛋白质第10位氨基酸得分最高,为3.289,表明该位点疏水性较强;第285和286位氨基酸得分最低,为-3.122, 表明该位点亲水性较强。
2.2 鸡Apob基因mRNA组织表达分析
选取9只4周龄鸡为试验材料,取其心、脑、肝、脾、肺、肾、脂肪、腺胃、腿肌、胸肌、肌胃和小肠组织。提取总RNA逆转录得到cDNA,以其为模板进行3次 平行RT-qPCR检测。检测结果表明,Apob基因主要在鸡的肝、肾和小肠组织中表达(图2)。
2.3 鸡Apob基因Cas9/gRNA敲除载体构建
合成的oligos退火后,琼脂糖凝胶电泳检测。泳道2、4、6退火产物与单链引物条带相比差异明显(图3),表明双链DNA形成,退火成功。将双链DNA与线性载体pX330/Cas9连接,连接产物转化入感受态细胞DH5a进行涂板。次日在含50 μg·mL-1Amp平板上,挑取4个单克隆菌落接种于含50 μg·mL-1Amp的LB液体培养基中,37 ℃震荡培养。泳道2、3、4、5、6试验组的菌液PCR在100 bp左右有较明显条带(图4),与预测位置一致。质粒测序比对结果表明,基因敲除载体构建成功。

图1 鸡Apob蛋白亲水性和疏水性分析Fig.1 Hydrophilic and hydrophobic analysis of chicken Apob protein

图2 Apob基因在鸡各组织中相对表达量Fig.2 Relative expression of Apob gene in chicken tissues

M.DNA相对分子质量标准; 1、3、5. sgRNA6~8上游引物; 2、4、6. sgRNA6~8双链产物 M.DL2000 DNA marker; 1,3,5. sgRNA6-8 forward primers; 2,4,6. sgRNA6-8 double strand products图3 退火产物验证Fig.3 Verification of annealed products

M.DNA相对分子质量标准; 1.对照组; 2~6. sgRNA6~8阳性克隆 M.DL2000 DNA marker; 1.Control; 2-6. Positive clones of sgRNA6-8图4 PCR 验证阳性克隆Fig.4 PCR confirmed positive clones
2.4 Cas9/gRNA敲除载体活性验证
将Cas9/gRNA质粒通过X-tremeGENE 9 DNA转染至DF-1,48 h后使用puro筛选阳性细胞,提取基因组。以基因组DNA为模板扩增靶位点6附近500 bp序列、靶位点7附近600 bp序列,靶位点8附近800 bp序列(图5),PCR结果显示,扩增的目的条带与预测大小一致。接着利用T7EI酶切法验证Cas9/gRNA的切割活性。在泳道2、4、6试验组中均检测到切割片段(图6),而在对照组则无切割条带。说明sgRNA6、sgRNA7、sgRNA8均具有切割活性。
2.5 TA克隆分析敲除效率
将2.4中扩增的目的片段回收后连至pMD-19T载体,转化至感受态细胞DH5a后涂布于Amp抗性的平板上,培养12 h后挑取20个单克隆菌落进行测序。其中,Cas9/gRNA6测序的20管菌液中有6管发生了突变,突变率为33.3%。Cas9/gRNA7测序的20管菌液中有13管发生了突变,突变率为65%。Cas9/gRNA8测序的20管菌液中有16管发生了突变,突变率为80%。其中,突变类型以碱基缺失为主,并且靶位点上、下游的双链均发生断裂(图7)。上述结果表明,Cas9/gRNA6、Cas9/gRNA7、Cas9/gRNA8均具有靶向切割活性,且Cas9/gRNA8靶向切割活性最强。

M.DNA相对分子质量标准;1、3、5.对照组;2、4、6. sgRNA6~8 PCR产物 M.DL2000 DNA marker; 1,3,5.Control; 2,4,6.sgRNA6-8 products of PCR图5 PCR 扩增sgRNA靶位点上、下游序列Fig.5 PCR amplified the upstream and downstream sequences of sgRNA targets

M.DNA相对分子质量标准; 1、3、5.对照组; 2、4、6. sgRNA6~8酶切产物 M.DL2000 DNA marker; 1, 3, 5. Control; 2, 4, 6. sgRNA6-8 enzyme-digested products图6 T7EI酶切验证结果Fig.6 The result of T7EI enzyme digestion
2.6 Apob基因敲除后其mRNA表达水平变化分析
提取对照组和敲除组亚克隆细胞RNA,反转录后利用RT-qPCR检测Apob基因mRNA的表达水平。进行3次平行试验,数据采用非配对t检验进行分析。结果显示(图8),转染Cas9/gRNA7的细胞中Apob基因mRNA表达水平约下调99.96%(P<0.01);转染Cas9/gRNA6的细胞中Apob基因mRNA的表达水平约下调85%(P<0.01);转染Cas9/gRNA8的细胞中Apob基因mRNA表达水平约下调47%(P<0.05)。表明成功敲除了DF-1细胞中Apob基因,并筛选到基因缺陷的亚克隆细胞。

(转下页 Carried forward)

图7 TA克隆测序检测靶位点突变结果Fig.7 Detection of target site mutation results by TA clone sequencing

****. P<0.01;**. P<0.05图8 敲除Apob基因的DF-1中Apob mRNA的表达情况Fig.8 Expression of Apob in DF-1 after gene knockout
3 讨 论
载脂蛋白家族通过与脂类和胆固醇的结合稳定脂蛋白结构,在血浆与组织之间转运脂质。随着研究的不断深入,载脂蛋白在脂蛋白代谢过程中的功能也陆续被发现,其不仅调节脂蛋白代谢关键酶活性,而且还参与脂蛋白受体的识别[33]。其中,Apob在载脂蛋白家族中分子量最大,疏水性也最强,主要参与LDL和VLDL的生成,负责转运内源性甘油三酯和胆固醇。
对鸡Apob基因mRNA的研究发现,鸡与哺乳动物Apob基因mRNA的大小大致相同,约为14 kb。鸡Apob的mRNA负责编码4 631个氨基酸的Apob。预测分析显示,Apob共有4个关键结构域,其N端和C端分布着两个重要结构域,分别负责结合脂类和细胞膜上的LDL受体。另外两个为未知功能结构域。鸡Apob为稳定的蛋白质,其脂肪系数为90.07,平均亲水性为-0.300。
哺乳动物中ApobmRNA主要存在于肝和小肠中。Funahashi等[34]检测表明,Apob基因在大鼠肝、小肠、肾上腺中表达量较高。另外胚胎大鼠在发育过程中,小肠和胎膜中Apob含量会显著增加,且高于肝含量。与哺乳动物不同的是,鸡Apob的mRNA在肾中含量也较高。Zhang等[11]研究表明,白羽鸡Apob基因主要表达于肾、肝和小肠中。蛋鸡和肉鸡肝中Apob基因的表达量一致,但该基因在蛋鸡肾和小肠中表达量高于肉鸡。为检测Apob基因在黄羽肉鸡中的表达情况,本试验选取4周龄鸡的12个组织提取RNA进行RT-qPCR。检测结果表明,Apob基因主要在鸡肝、肾及小肠组织中表达,与Zhang等[11]的研究结果一致。肝是禽类生长发育与能量交换的重要场所,而内源性脂类也主要由肝和脂肪合成释放进入血液。鸡的脂肪组织本身不能或者只能少量合成脂酸,Apob可将肝合成和小肠吸收的脂肪转运至肝外组织,用于氧化供能或储存堆积。另外,禽类肝内Apob的合成还受到雌激素的调节,但在肾和小肠组织中的表达却不受雌激素影响[35]。
脂肪沉积是由多基因控制的复杂过程。家禽体内不同部位脂肪沉积速度和量并不相同,肉鸡以腹脂沉积量为最高,其次是颈部脂肪和腿部皮下脂肪[36]。研究表明,8周龄仔鸡腹脂重量是颈部脂肪的3.4倍,腿部脂肪的4倍[37]。鸡的腹脂性状遗传力较为稳定[38],从遗传育种方面选育优质肉鸡效果较为理想[39-40]。因此,为探究Apob基因在鸡肝脂代谢过程中的作用,对鸡Apob基因进行敲除试验具有重要意义。与以往的基因编辑技术相比,CRISPR/Cas技术具有明显的优势,研究人员只要设计和制造用于基因组定位的RNA序列,就能精准靶向目标基因,实现对特定基因的破坏、修复、关闭和启动。因此本试验利用CRISPR/Cas9技术,设计合成靶向Apob基因的3对sgRNA,构建重组表达载体,在DF-1细胞系上进行敲除活性验证。将构建成功的Cas/gRNA转染至DF-1细胞后,提取基因组DNA,通过PCR扩增、T7EI酶切验证靶位点敲除活性。T7EI酶切显示,Cas/gRNA载体均可发挥敲除活性,且sgRNA6切割活性最强。为明确基因编辑类型,利用TA克隆测序进行检测。测序结果表明,突变类型以碱基缺失为主,且Cas/gRNA8敲除效率高达80%。RT-qPCR结果显示,转染Cas9/gRNA7、Cas9/gRNA6和Cas9/qRNA9的细胞中Apob基因mRNA表达水平分别约下调99.96%(P<0.01)、85%(P<0.01)和47%(P<0.05)。
4 结 论
本研究揭示了鸡Apob是相对分子质量为523.356 ku,平均亲水性为-0.300的稳定蛋白质;Apob基因主要在鸡肝、肾及小肠组织中表达;另外成功构建了鸡Apob基因的敲除载体,并检测到基因敲除的亚克隆细胞中Apob基因mRNA水平显著下调;为探明Apob基因在鸡肝脂代谢中的功能及家禽的良种选育提供了新方向。
