朱红毛斑蛾实时荧光定量PCR内参基因的筛选
2021-03-30王小云陈学敏王小平郑霞林
陈 炼,田 忠,王小云,陈学敏,陆 温,王小平,郑霞林*
(1. 广西大学农学院,南宁 530004;2. 华中农业大学植物科学技术学院,武汉 430070)
朱红毛斑蛾Phaudaflammans(Walker)(鳞翅目Lepidoptera:毛斑蛾科Phaudidae),是榕属Ficus植物上一种重要的食叶害虫,在南亚和东南亚国家其发生和为害的报道屡见不鲜(Nageshchandraetal.,1972;Verma and Dogra,1982;Fof,2015;刘俊延等,2016;Anonymous,2017;Zhengetal.,2017)。朱红毛斑蛾在中国广西1年发生2~3代,抗寒力强(Zhengetal.,2017),以第2代预蛹期幼虫及蛹和第3代低龄幼虫越冬,越冬幼虫喜在位于地表突出的根系附近或杂草丛下化蛹(刘俊延等,2015)。该虫成虫为日行性蛾类(Zhengetal.,2019),以幼虫取食榕属植物叶片,为害严重时,不仅植株叶片被蚕食殆尽仅剩枝干,还会取食嫩枝韧皮部(刘俊延等,2015),不仅影响榕树的生长发育,还影响其净化空气等功能的正常发挥。目前,已筛选出几种防治效果较佳的化学药剂(孟令昱,2017;蒋露等,2018),然而,由于朱红毛斑蛾的发生地多在市区道路旁、公园和河堤岸等处,化学防治存在一定的安全隐患。因此,探索朱红毛斑蛾环境友好型的生物防治措施十分必要。自然条件下,朱红毛斑蛾的天敌主要为寄生蜂和寄生蝇,但寄生率较低,仅为0.9%~7.2%(Zhengetal.,2015),防控效果有限。此外,朱红毛斑蛾性信息素防控技术的研究也取得初步进展(Zhengetal.,2019)。迄今为止,关于朱红毛斑蛾的研究主要集中在生物生态学特性、防治和线粒体基因组等方面(Zhangetal., 2020),有关转录组分析、内参基因筛选、功能基因研究等方面尚未见报道。
实时荧光定量PCR(quantitative real-time PCR,qRT-PCR),由于其定量准确、特异性性好和灵敏度高,广泛用于昆虫转录组验证和基因表达分析等方面的研究(Van Guilderetal.,2008;史彩华等,2017;Lüetal.,2018;Shakeeletal.,2018)。qRT-PCR技术关键因素之一为内参基因的选择。合适的内参基因可以对qRT-PCR数据进行校正和标准化,从而纠正由RNA分离、cDNA定量、转录和扩增的变异等带来的系列问题(Pfaffletal.,2014),从而减少样本间的误差,控制内部差异。因此,选择何种内参基因对于qRT-PCR结果是否准确就显得尤为重要。常用的候选内参基因包括肌动蛋白家族(ACTIN)(Ridgeway and Timm,2015)、微管蛋白家族(Tubulin,TUB)(Wangetal.,2015)、甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)(Yangetal.,2018)和核糖体蛋白基因(Ribosomal protein L32,RPL-32)(Mattaetal.,2011)等。近年来,这几类候选内参基因在昆虫中的表达稳定性筛选研究已有诸多报道(Tengetal.,2012;符伟等,2012;Luetal.,2013;唐培安等,2016),如偏瞳蔽眼蝶BicyclusanynanaButler(Arunetal.,2015)、狐眼袖蝶HeliconiusnumataCramer(Prunieretal.,2016)、桃蛀螟ConogethespunctiferailsGuenee(杨苓等,2017)和美国白蛾HyphantriacuneaDrury(陶蓉等,2019)等。
目前,已对朱红毛斑蛾的转录组数据进行了组装分析,得到完善的基因信息,使qRT-PCR内参基因筛选试验更具可靠性。因此,本研究以朱红毛斑蛾不同成虫组织(头、胸、腹、足、翅和触角)、性别和不同发育阶段(卵、幼虫、蛹和成虫)为材料,利用qRT-PCR技术对鳞翅目昆虫中常见的10个内参基因(ACTIN2、ACTIN3、TUB1、TUB2、TUB3、EF1α、AK、GAPDH、RPL32和TBP)进行了表达量分析,并使用GeNorm、NormFinder和BestKeeper软件及RefFinder网站对候选基因的表达稳定性进行了分析和评价,以筛选出朱红毛斑蛾不同成虫组织、性别和不同发育阶段中最合适的内参基因,为后续朱红毛斑蛾基因表达调控等系列研究提供参考资料。
1 材料与方法
1.1 供试昆虫与样品收集
于2018年6月至7月,在广西大学校园(108.29 °E,22.85 °N)内的垂叶榕F.benjaminaL.上采集朱红毛斑蛾幼虫。幼虫放入塑料盒(半径8.0 cm,高度12.0 cm,10头/盒)内饲养,置于温度26±1℃,相对湿度为60%~80%和光周期L14 ∶ D10的条件下饲养。幼虫饲以新鲜垂叶榕叶片,每日更换新鲜叶片直至化蛹。根据茅裕婷等(2017)提供的方法鉴别蛹的性别,雌雄蛹分开保存在不同的塑料管内(直径2.7 cm,高度10.3 cm),塑料管盖中间钻10个孔(直径2 mm)便于通风,置于和饲养幼虫相同的环境条件下。成虫羽化后,随机收集1日龄雌虫或雄虫头、胸、腹、足、翅和触角为组织样品,每组5头,生物学重复3次;随机收集1日龄雌虫和雄虫为性别样品,每组3头,生物学重复3次;收集卵(50粒)、2龄幼虫(5头)、蛹(初期和末期各2头)和成虫(1日龄雌雄成虫各2头)为发育阶段样品,生物学重复3次;将收集的各组样品迅速放入液氮内,随后转置于-80℃冰箱保存待用。
1.2 总RNA的提取与cDNA的合成
将收集的各组样品从-80℃冰箱中取出,置于液氮中,均按RNAiso Plus (Trizol)(TAKARA,9109,中国大连)法进行RNA提取。用以上方法提取的RNA为模板,按照Prime Script RT reagent Kit with gDNA Eraser(TAKARA,RR047,中国大连)试剂盒说明书进行反转录反应。合成好的cDNA存于-20℃冰箱待用。
1.3 内参基因的选择及引物设计
根据其它鳞翅目昆虫常用内参基因(Shakeeletal.,2015;Sunetal.,2015;Xuetal.,2017;Zhangetal.,2017),从朱红毛斑蛾转录组中筛选出ACTIN2、ACTIN3、TUB1、TUB2、TUB3、EF1α、AK、GAPDH、RPL32和TBP共10个候选内参基因(表1),并利用National Center for Biotechnology Information(NCBI)网站中的引物设计工具Primer-BLAST(https://www.ncbi.nlm.nih. gov/tools/primer-blast/)设计qRT-PCR引物(表2),由生工生物工程上海(股份)有限公司合成。
1.4 标准曲线的制作和qRT-PCR
将样品cDNA模板梯度稀释1/2、1/10、1/50、1/250和1/1250进行反应,在冰上进行反应体系的配制,具体如下(10 μL体系):SYBR©Premix Ex TaqTMII (Tli RNaseH Plus)(TAKARA,RR820A,中国大连)5.0 μL,dd H2O 2.4 μL,10 μmol/L的上下游引物各0.2 μL,cDNA 稀释液2.0 μL。在ABI QuantStudio 6 Flex (Thermo Fisher Scientific,Massachusetts,USA)上进行反应,PCR程序如下:Hold Stage:95℃,30 s;PCR Stage:95℃,5 s;60℃,30 s;40个循环;Mel Curve Stage:95℃,15 s;60℃,1 min;95℃,15 s。保存qRT-PCR检测数据供后续分析。

表1 朱红毛斑蛾候选内参基因信息
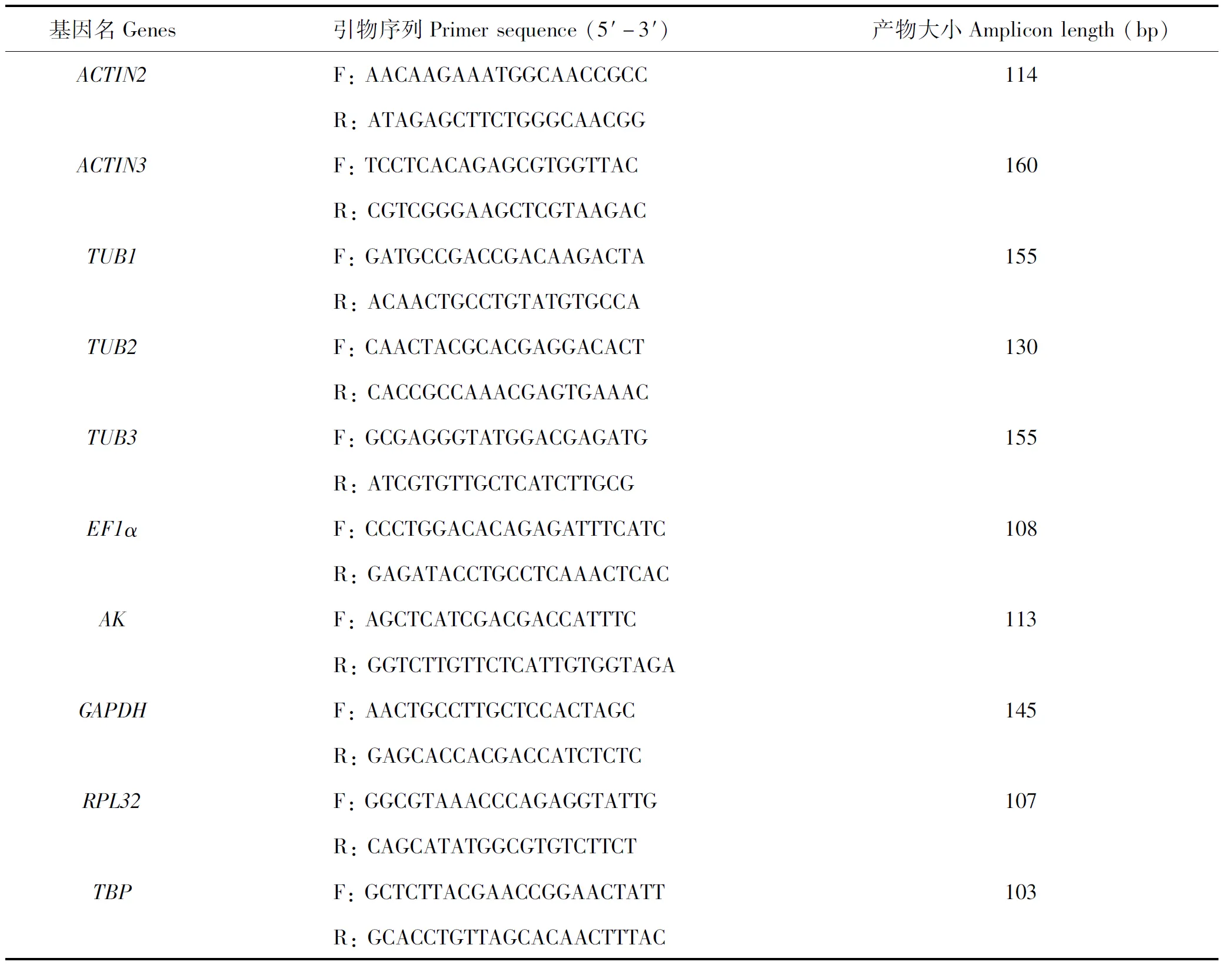
表2 朱红毛斑蛾候选内参基因的定量引物序列
1.5 候选内参基因表达稳定性分析
对10个候选内参基因的综合性评价,采用内参基因评价软件GeNorm(Vandesompeleetal.,2002)、Normfinder(Andersenetal.,2004)和Bestkeeper(Pfaffletal.,2004),并采用RefFinder在线网站(https://www.heartcure.com.au/reffinder/)进行综合比较与稳定性评估(Silveretal.,2016)。GeNorm计算不同处理中各内参基因表达稳定性(M值),当M<1.5时,则该基因可用于候选内参基因的筛选,反之则否,且M值越小代表选择的内参基因稳定性越好。同时,可通过GeNorm计算得到Vn/(n+1)值,当Vn/(n+1)<0.15时,则表示该处理中这n个内参基因达到内参基因计算要求,无需添加n+1个内参基因,从而得到使用内参基因的最佳数目。Normfinder计算不同样本组内和组间的变化来评估内参基因表达稳定值(stability value,SV),该值越小表示内参基因越稳定,同时还可得到内参基因的最佳组合。Bestkeeper直接使用基因循环阈值(Cq)进行计算,通过标准差(standard deviation,SD)、变异系数(coefficient of variation,CV)及几何平均数(geometric mean,GM)来评估内参基因的稳定性,且SD<1时,该基因可被作为内参基因。最后,通过RefFinder在线网站对所有候选内参基因进行综合排名。
2 结果与分析
2.1 引物扩增效率和特异性评价
基于标准曲线的结果,发现10个候选内参基因的相关系数(R2)均在0.991~0.999之间(表3),表明梯度稀释的内参基因模板cDNA获得的标准曲线相关系数良好。所有候选内参基因的扩增效率(E)均在97.6%(RPL32)~113.6%(TUB2)之间,位于80.0%~120.0%的要求范围内,且每个候选基因获得的溶解曲线均表现出单一峰,说明本试验选择的定量引物设计合理,具有良好的扩增效率和特异性,符合荧光定量分析的要求,适用于内参基因的定量测定。

表3 候选内参基因qRT-PCR引物的扩增效率及相关系数
2.2 候选内参基因的表达水平分析
qRT-PCR分析了朱红毛斑蛾10个候选内参基因的表达水平,Cq表示其转录水平。在朱红毛斑蛾不同成虫组织、性别和不同发育阶段3组处理综合条件下,所有基因的Cq值在15.54~30.37个循环之间(图1),表明各候选内参基因各组处理中均具有较高的表达水平。基于Cq值变化,发现各候选内参基因转录表达水平表达量均有差异,其中,RPL32表达量变化最小,其次是ACTIN3、TUB2和GAPDH;ACTIN2表达量变化最大,且Cq值大于30,因此不考虑作为内参基因。
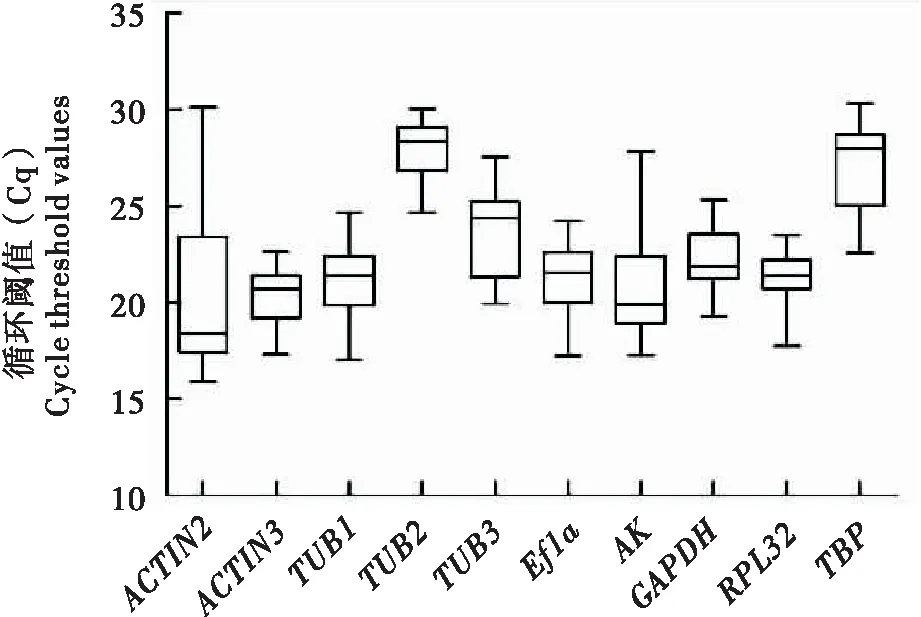
图1 候选内参基因在朱红毛斑蛾不同样品中的表达水平Fig.1 Expression levels of candidate reference genes for different samples in Phauda flammans
2.3 朱红毛斑蛾候选内参基因稳定性分析
2.3.1GeNorm稳定性分析
根据GeNorm软件对10个候选内参基因稳定性(M值)的分析,发现在不同成虫组织处理中,M值稳定顺序为TUB1=TUB2(0.284)>EF1α(0.349)>ACTIN3(0.358)>RPL32(0.439)>GAPDH(0.492)>TBP(0.559)>TUB3(0.620)>AK(0.964)>ACTIN2(1.346),其中TUB1和TUB2为最稳定的内参基因,ACTIN2为最不稳定的内参基因;在不同成虫性别处理中,ACTIN2=EF1α(0.169)>AK(0.233)>ACTIN3(0.270)>RPL32(0.295)>TUB2(0.353)>GAPDH(0.396)>TUB1(0.486)>TUB3(0.654)>TBP(0.786),其中ACTIN2和EF1α为最稳定的内参基因,TBP为最不稳定的内参基因;在不同发育阶段处理中,TUB2=TBP(0.255)>AK(0.591)>RPL32(0.806)>ACTIN3(0.986)>TUB3(1.162)>GAPDH(1.427)>ACTIN2(1.669)>TUB1(2.242)>EF1α(2.695),TUB2和TBP为最稳定的内参基因,EF1α为最不稳定的内参基因(图2),其中ACTIN2、TUB1和EF1α的M值>1.5,因此这3个基因不适合用于不同发育阶段处理中的内参基因。

图2 geNorm软件分析候选内参基因的表达稳定值MFig.2 Expression stability of the candidate reference genes as calculated by the geNorm注:A,不同成虫组织;B,不同成虫性别;C,不同发育阶段。Note:A, Different adult tissues; B, Different adult sexes; C, Different developmental stages.
同时,利用GeNorm软件对Vn/(n+1)值进行计算,分析得到了所需要最佳内参基因数目(图3)。3个处理中,Vn/(n+1)值均存在小于0.15的组分,所以最佳内参基因组合数目为2个,无需加入第3个内参基因进行校正。其中,在不同成虫组织处理内,TUB1和TUB2为最佳组合;在不同成虫性别处理中,ACTIN2和EF1α为最佳内参基因组合;在不同发育阶段处理中,TUB2和TBP为最佳内参基因组合。

图3 GeNorm软件分析不同条件下所需内参基因的最适数目Fig.3 Determination of the optimal number of reference genes analyzed by GeNorm
2.3.2Normfinder稳定性分析
基于Normfinder的分析,发现在不同成虫组织中,TUB2为最稳定内参基因,与GeNorm软件分析一致,其次是GAPDH,最不稳定基因为RPL32;在不同成虫性别中,TUB1为最稳定内参基因,其次为EF1a和ACTIN3,TBP依然为最不稳定基因;在不同发育阶段处理中,ACTIN3为最稳定内参基因,其次为TBP,最不稳定基因为AK(表4)。

表4 基于NormFinder软件的朱红毛斑蛾内参基因稳定性分析
2.3.3Bestkeeper稳定性分析
BestKeeper分析得到的标准差SD值、变异系数CV值和几何平均数GM值等可用来判断内参基因的稳定性,SD、CV和GM值越小,表明基因表达越稳定。在不同成虫组织处理中,ACTIN3为最稳定内参基因,其次为AK;RPL32为最不稳定基因,与Normfinder软件分析结果一致。在不同成虫性别处理中,AK为最稳定内参基因,其次为TUB2和GAPDH;TBP在3种分析中均为最不稳定基。在不同发育阶段处理中,ACTIN2和TUB2为最稳定内参基因,其次为GAPDH;最不稳定基因为AK。所有处理每个内参基因的标准差SD值均小于1,故3组处理中的所有基因都可被作为内参基因(表5)。
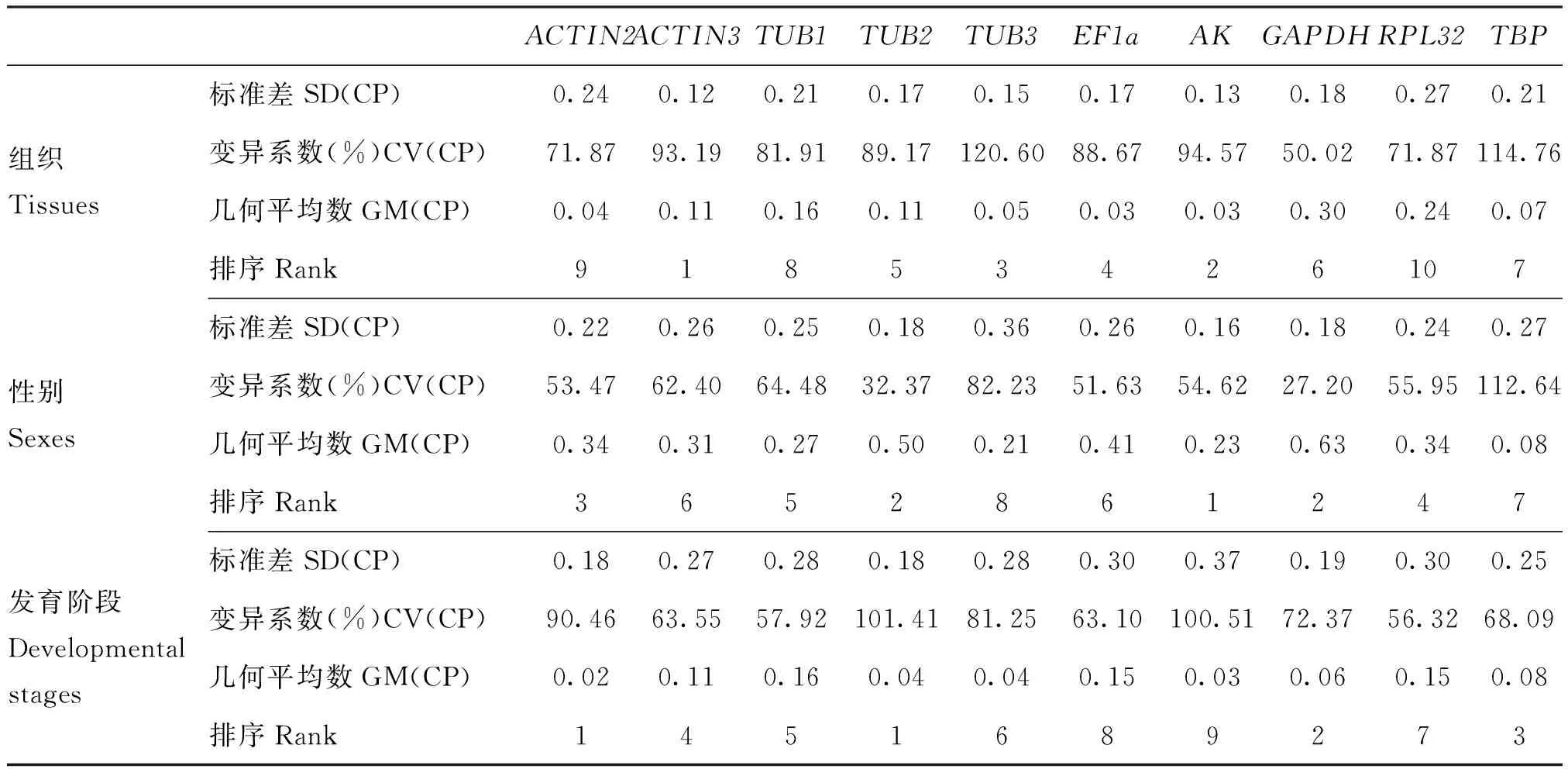
表5 基于Bestkeeper软件的朱红毛斑蛾内参基因稳定性分析
2.3.4RefFinder综合分析
根据RefFinder综合分析,发现在不同成虫组织处理中,表达最稳定内参基因为TUB2,其次为GAPDH;不同性别处理中,表达最稳定内参基因为TUB1,其次为EF1α;在不同发育阶段处理中,表达最稳定内参基因为ACTIN3,其次为TBP(图4)。

图4 RefFinder中Geomean法分析候选内参基因的表达稳定性Fig.4 Expression stability of the candidate reference genes analyzed by the Geomean method in RefFinder注:A,不同成虫组织;B,不同成虫性别;C,不同发育阶段。Note:A, Different adult tissues; B, Different adult sexes; C, Different developmental stages.
3 结论与讨论
qRT-PCR是基因表达分析研究中一种非常可靠的技术,可对靶标基因的表达水平定量,具有灵敏度高和特异性强等优点(Lüetal.,2018),是目前基因表达研究中检测或比较mRNA水平的标准技术。然而,其对基因表达量的成功检测必须要有合适的内参基因作为标准进行校准(Stéphanieetal.,2009)。对于qRT-PCR分析评价内参基因,通常需添加多种参考进行验证,例如,不同处理条件和多种候选内参基因的选择(Shakeeletal.,2018)。目前,关于鳞翅目昆虫利用qRT-PCR技术进行内参基因筛选已有诸多报道,如研究了桃蛀螟、美国白蛾和偏瞳蔽眼蝶不同发育阶段、成虫组织、性别或温度处理下内参基因的表达量(Arunetal.,2015;杨苓等,2017;陶蓉等,2019)。本研究基于朱红毛斑蛾转录组数据库,采用不同成虫组织、性别和不同发育阶段3个处理,对鳞翅目昆虫中常见的10个候选内参基因的稳定性进行了评定。
首先,在朱红毛斑蛾不同成虫组织中,TUB2和GAPDH为最适内参基因,但结果与桃蛀螟(杨苓等,2017)、金纹细蛾PhyllonorycterringoniellaMatsumura(郭长宁,2014)和小菜蛾PlutellaxylostellaLinnaeus(Heetal.,2017)等鳞翅目昆虫的研究结果不同,可能与物种的生物学特异性和组织样品取样类型差异有关。其次,在黄翅绢野螟DiaphaniacaesalisWalker内参基因研究中,发现不同成虫性别最佳内参基因为ACTIN和EF1α(Wangetal.,2020),其中EF1α为延伸因子1-α(elongation factor-alpha),是在mRNA翻译时促进多肽链延伸的蛋白质因子(Serdyuk and Galzitskaya,2007)。例如,在鳞翅目粉蝶科斑粉蝶属Delias中,利用EF1α与其他21个类群进行系统发育关系分析(Morinaketal.,2002),由此可见该基因的保守性和表达稳定性。在朱红毛斑蛾不同成虫性别处理中,也发现EF1α为最适内参基因之一,认为EF1α可能在鳞翅目性别表达中较稳定,适合作为成虫性别处理中基因表达的内参基因。最后,在朱红毛斑蛾不同发育阶段处理中,ACTIN3和TBP为最适内参基因,但与小菜蛾和桃蛀螟等鳞翅目昆虫的研究结果不同(Fuetal.,2013;杨苓等,2017),表明内参基因的表达稳定性随物种而异,同时可能也会受试验处理方法和条件的影响。同时,不同软件分析结果存在一定差异,可能与软件的算法不同有关,在其他昆虫内参基因评价中也存在类似情况(唐培安等,2016;刘宁等,2017)。
内参基因稳定性分析完成后,基于GeNorm计算得到Vn/(n+1)值<0.15,推算出朱红毛斑蛾最佳内参基因使用数目为2个。自2002年Vandesompele编写了GeNorm软件以来,双内参基因在qRT-PCR检测中越来越广泛使用,其原理是不管在任何试验条件下,2个最佳内参基因的表达水平比值均保持一致,不受基因表达差异的影响(Vandesompeleetal.,2002)。因此,在本研究中不同成虫组织、性别和发育阶段3个试验处理下,最佳内参基因使用数目均为2个即可。
本文研究结果表明,在朱红毛斑蛾不同成虫组织基因定量研究中,建议以TUB2和GAPDH作为内参基因;在不同成虫性别基因定量研究中,建议以TUB1和EF1α作为内参基因;在不同发育阶段基因定量研究中,建议以ACTIN3和TBP作为内参基因。为保证qRT-PCR结果的准确性,最佳内参基因使用数目为2个。
