芒根组织在不同非生物胁迫下最适内参基因的筛选
2021-01-18黄逸之唐铭余钟旻依王芮嘉陈嘉怡叶云天张新全
黄逸之,唐铭余,钟旻依,王芮嘉,陈嘉怡,叶云天,张新全,聂 刚*
(1.四川农业大学动物科技学院,成都 611130;2.四川农业大学园艺学院,成都 611130)
基因表达分析已广泛运用于新基因预测、基因功能研究等方面。实时荧光定量PCR(real-time quantitative PCR,qRT-PCR)能准确定量地分析目标基因的表达,在检测基因表达方面具有重要作用[1]。与传统的基因检测方法相比,实时荧光定量PCR灵敏度高、特异识别性强、重复性好、定量准确[2-3]。然而,qRT-PCR相对定量表达结果的准确性受多种因素的影响,如RNA反转录合成效率、RNA质量、扩增效率和分析方法等[4-5]。为避免此类误差的产生,在进行实时荧光定量PCR分析时,需引入特异性好、表达稳定的高质量内参基因对目的基因的表达进行校正[6]。通常,高质量内参基因可以在不同试验条件、不同组织、细胞都稳定表达,通常为看家基因[7],如 β 微管蛋白(tubulin,TUB),肌动蛋白(β-actin,ACTIN),蛋白磷酸酶 2A(Protein Phosphatase 2A,PP2A),多聚泛素酶基因(UBQ),转录延伸因子(transcription elongation factors,EF-1a)以及 18S 核糖体RNA(18S ribosomal RNA,18S rRNA)等基因[8-9]。但越来越多的研究表明,在一定试验条件下稳定表达的内参基因,其稳定性会随试验条件的变化而变化[10-11],在任何试验条件下都稳定表达的内参基因很少[12]。因此,针对不同的植物、组织及试验处理,筛选表达稳定的内参基因很有必要。
芒(Miscanthus sinensis)是禾本科芒属多年生高草本植物,光合碳固定效率高,生态适应性强,适宜在边际土地上种植,具有很大的发展潜力和应用价值[13]。边际土地易受干旱、重金属等非生物胁迫的影响,而芒根系发达,生物量大,抗氧化和光合能力强,且根系具有多种有益微生物辅助芒吸收养分,分泌有机酸,从而有利于芒应对重金属等非生物胁迫[14]。目前,有关植物进行非生物胁迫下内参基因筛选的研究报道很多,如多年生黑麦草(Lolium perenne)[15]、拟南芥(Arabidopsis thaliana)[16]、番茄(Lycopersicon esculentum)[17]、紫花苜蓿(Medicago sativa L.)[18]等,但对于芒内参基因筛选的研究报道相对较少。因此,有必要根据芒的不同组织和不同的试验处理,筛选不易受外源性或内源性因素影响的稳定表达的内参基因。本研究中,通过实时荧光定量PCR技术分析比较12个候选内参基因在芒根组织中不同非生物胁迫(干旱、盐、镉、铬和砷)下的表达稳定性,运用 geNorm(ver.3.5)[19]、NormFinder(ver.0.953)[20]、BestKeeper(ver.1.0)[21]和 RefFinder[22]程序软件以及ΔΔCt法[23]分析试验数据,以期获得不同胁迫条件下芒根组织中稳定表达的内参基因。
1 材料和方法
1.1 供试材料
供试材料为“M20100819”和“M20101302”两个野生芒品种,分别采自海拔高度差异较大的两地:四川省雅安市天全县二郎山和眉山市洪雅县(N 29°57′30.1″,E 102°24′36.4″,1388m;N 29°53′22.6″,E 103°21′59.2″,483.5 m)。
1.2 试验方法
1.2.1 材料培养与胁迫处理
在滤纸上发芽芒种子后,移栽到塑料杯(直径9 cm)中进行沙培,用1X的Hoagland’s营养液在植物生长室中进行培养。培养温度为白天28℃进行12 h,夜间25℃进行12 h。待植株长到5到6叶时对材料分别进行干旱胁迫、盐胁迫、砷胁迫、铬胁迫和镉胁迫处理。干旱胁迫采用20%PEG 6000模拟,盐胁迫用300 mmol/L NaCl处理,砷、铬、镉3个重金属胁迫分别用含200 mg/L As5+(Na2HASO4·7H2O)、200 mg/L Cr6+(K2Cr2O7)、200 mg/L Cd2+(CdCl2·2.5H2O)的霍格兰营养液进行处理。所有处理均持续6 d,并在处理的第0、1、3、6天对不同胁迫处理分别取样,将植株洗净取其根组织,液氮冷冻,于-80℃冰箱保存备用。
1.2.2 RNA提取与cDNA合成
采用Direct-zolTMRNA MiniPrep试剂盒并按照其说明书提取芒根组织的总RNA。使用1.0%琼脂糖凝胶电泳检测总RNA的完整性,检测合格的RNA采用iScript cDNA SynthesisKit试剂盒(Bio-Rad Laboratories Inc.)按说明反转录合成cDNA第一链,反转录程序为:25℃启动5 min,46℃开始反转录20 min,95℃反转录失活1 min,最后于4℃保存。cDNA产物在-20℃储藏备用。
1.2.3 候选内参基因的选择和引物设计
本试验选择以下12个内参基因作为芒的候选内参基因:18S rRNA、甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、ACTIN、蛋白磷酸酶 2A(Protein Phosphatase 2A,PP2A)、真核起始因子 4a(Eukaryotic initiation factor 4 alpha,eIF4a)、S-腺苷甲硫氨酸合成酶(S-adenosylmethionine synthase,SAMS)、S-腺苷甲硫氨酸脱羧酶(S-adenosylmethionine decarboxylase,SAMDC)、Sb09g019750、Sb02g041180及从转录组数据中筛选出的 3个 unigene:Unigene33312、Unigene33024和Unigene26576(NCBI SRA 数据库编号:SRP102136)。通过同源基因序列比对后,使用在线软件primer 3.0(http://primer3.ut.ee/)对候选内参基因的引物进行设计。其中Sb09g019750和Sb02g041180的引物参考于前人对芒属植物的研究[24](表1)。

表1 12个候选内参基因引物序列及相关信息Table 1 Primer sequences and related information for 12 candidate reference genes
1.2.4 qRT-PCR反应
将cDNA产物稀释3倍,作为实时荧光定量PCR的模板,对12个内参基因的引物进行PCR扩增。配制的荧光定量PCR总反应体系共10 μL:SsoAdvanced Universal SYBR® Green Supermix(2X)5 μL,上游下游引物各 0.5 μL,cDNA 模板1.5 μL及2.5 μL的Nuclease H2O。qRT-PCR扩增过程:95℃预变性 30 s,95℃变性 10 s,60℃延伸 30 s,35个循环。为验证每种引物的特异性,进行了Tm分析。所有qRT-PCR反应均做了3个技术重复和生物学重复。数据由实时荧光定量PCR仪(Bio-Rad,USA)读取,并为每对引物构建标准曲线,以确定每对引物的扩增效率和回归系数(R2)。
1.3 数据处理与分析
本研究使用4种软件工具geNorm、NormFinder、BestKeeper和RefFinder来分析12个候选内参基因的稳定性。geNorm软件对候选内参基因表达稳定值(average expression stability value,M)进行分析并排序,M值越低的基因越稳定。一般认为M值低于1.5的内参基因表达稳定,可作为理想内参[25]。该软件还可通过对内参基因的表达稳定值进行排序,并依据标准化因子配对差异分析Vn/Vn+1判定最适内参基因的数量。NormFinder软件根据12个候选内参基因的表达稳定性筛选出最优内参基因[20]。此外,可以通过BestKeeper软件计算变异系数(coefficient of variation,CV)和标准偏差(standard deviation,SD)来确定内参基因的稳定性,CV值越小,内参基因越稳定[21]。由于这3种方法的分析结果存在一定的差异性,故使用在线网络工具RefFinder进行综合分析,并将其作为整体的最终排名,从而筛选出在不同胁迫下最稳定的内参基因。
2 结果与分析
2.1 引物特异性验证
以芒根组织材料RNA反转录合成的cDNA为模板,对12个内参基因进行qRT-PCR扩增,利用1.0%的琼脂糖凝胶电泳检测(图1),结果显示,所有基因扩增引物目标片段均为单一清晰可辨条带,且条带大小与预期大小一致。表明引物能特异性扩增且不存在引物二聚体,适用于qRT-PCR研究。
2.2 不同非生物胁迫条件下内参基因的Ct值分析
利用Ct法测定12个内参基因在不同非生物胁迫下的相对表达量,从而分析内参基因间转录水平的高低。Ct值(cycle threshold)与基因表达丰富度密切相关,Ct值越小,表达丰度越高[26]。Ct值比较结果显示,各个内参基因的表达水平存在一定的差异(图2)。12个候选内参基因的Ct值处于7.27到34.59之间,其中18S rRNA的表达丰度最高,Unigene33312表达量最低,其他候选内参基因的表达丰度介于中间水平。
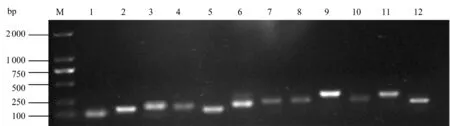
图1 12个候选内参基因PCR扩增结果Figure 1 PCR results for twelve candidate reference genes
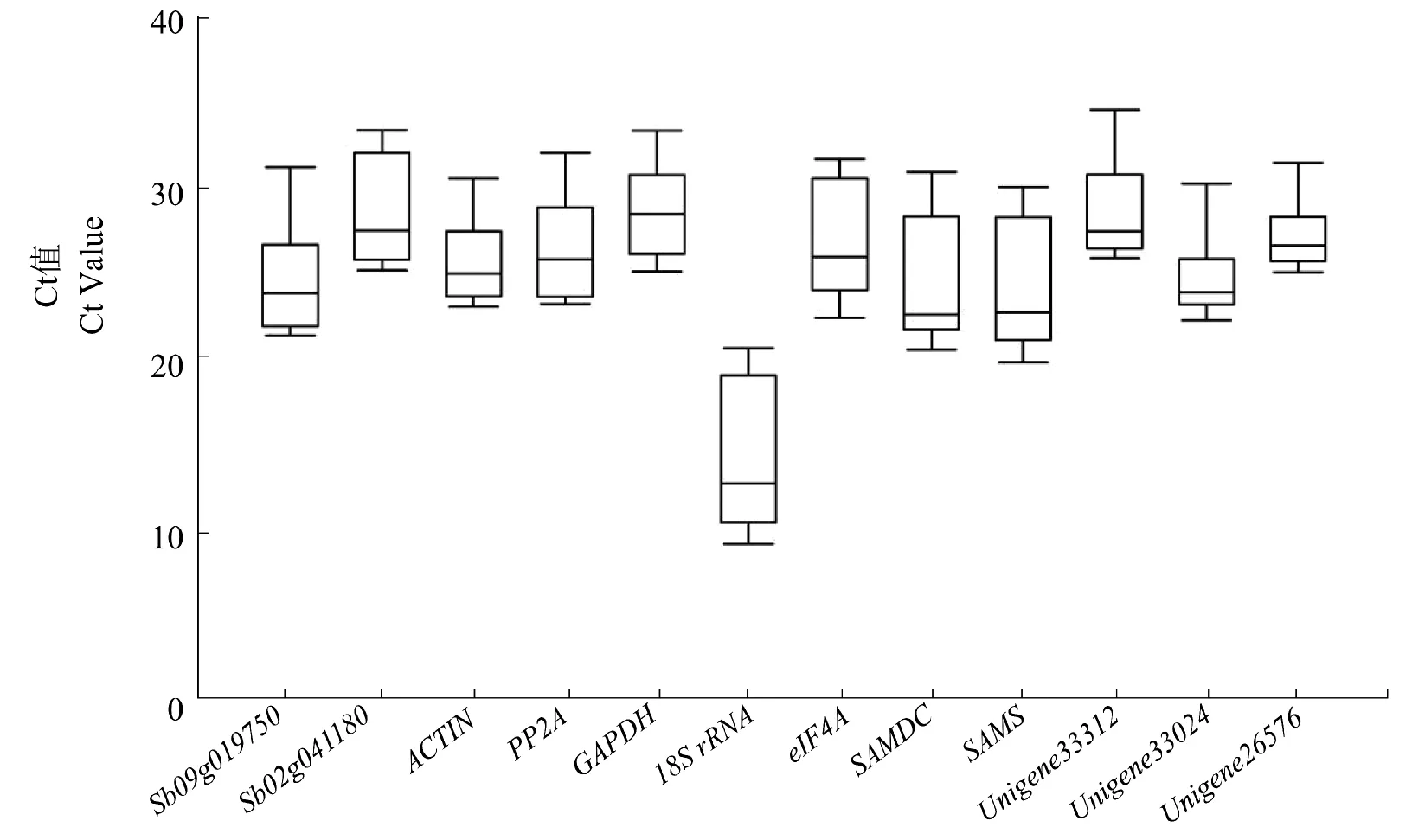
图2 候选内参基因在不同非生物胁迫环境下的平均Ct值Figure 2 All candidate reference genes in the different abiotic stress environments mean Ct values
2.3 geNorm分析
geNorm软件分析结果显示:在铬胁迫处理下,所有候选内参基因的M值都小于1.5,表明12个候选内参基因均能稳定表达,稳定性排名前两位的内参基因为PP2A和Sb09g019750;在干旱胁迫和盐胁迫下,表达最稳定的内参基因分别为Unigene33024和 Unigene26576 、Unigene26576和 Sb09g019750;在重金属镉胁迫和重金属砷胁迫处理下,表达最稳定的内参基因分别是PP2A和Unigene26576、PP2A和Sb09g019750;而在考虑所有样本的情况下,表达最稳定的内参基因为Unigene26576和Unigene33024(图 3)。

图3 12个候选内参基因在geNorm分析下的表达稳定性值(M)Figure 3 Expression stability values(M)of 12 candidate reference genes by geNorm
此外,geNorm程序还能基于成对变异分析确定所需的最佳内参基因数量。geNorm软件可用于分析内参基因的配对差异值(Vn/Vn+1),软件分析默认值为0.15。当Vn/Vn+1大于0.15时,需要引入第n+1基因;当Vn/Vn+1小于0.15时,无须引入新的内参基因[19]。本次试验中,所有样品的V2/3小于0.15,则该试验条件下的最适内参基因数目是2个。铬胁迫下的成对变异(V2/3)小于0.15,表明使用两个最稳定的内参基因(PP2A和Sb09g019750)可以足够。干旱胁迫、镉胁迫、砷胁迫、盐胁迫的成对变异(V3/4)均大于0.15,这表明可能需要4个内参基因来进行精确的归一化(图4)。
2.4 NormFinder分析
本研究利用NormFinder软件分析12个候选内参基因的表达稳定性,内参基因具有较低的稳定值表明该基因更稳定(表2)。根据NormFinder软件分析结果可知:在所有样品中,Unigene26576的稳定值最低,为最佳内参基因。而不同胁迫处理的水平不同,在镉和铬胁迫下最稳定的内参基因均为Unigene33312;干旱胁迫下GAPDH最稳定,其值为0.470;盐胁迫和砷胁迫下最稳定的内参基因分别为Sb02g041180和 Sb09g019750。比较NormFinder和geNorm,ΔΔCt法的结果,虽然排名各有一些不同,但最稳定的前5名内参基因几乎相同,总体趋势一致。

图4 geNorm通过成对变异(V)分析计算最佳内参基因数Figure 4 geNorm calculated the optimal number of reference genes by pairwise variation (V)analyses.
2.5 BestKeeper分析
BestKeeper通过计算候选内参基因的CV±SD值,结果以升序排序,值越小的候选内参基因的稳定性越好。通过结果分析(表3),在所有样品中Sb02g041180(4.07±0.40)最稳定,当考虑不同处理时,最稳定的内参基因各不相同:干旱胁迫下为ACTIN(2.17±0.65);盐胁迫下是 Sb09g019750(4.02±0.40);砷胁迫和镉胁迫下均为Unigene26576;铬胁迫下最稳定的内参基因是Unigene33312(12.56±0.45)。整体来看,BestKeeper分析候选内参基因稳定性结果排名同以上3种算法结果基本一致。
2.6 RefFinder分析
使用在线网络工具RefFinder综合评估和筛选内参基因。结果显示(表4),干旱胁迫处理下,最稳定的内参基因为Sb02g041180和ACTIN;盐胁迫处理下,最稳定的内参基因为Sb09g019750和Unigene26576;3种重金属(砷、镉、铬)胁迫处理下,最稳定的内参基因分别为Sb09g019750和PP2A、Uni-gene26576和 PP2A、Sb09g019750和 Unigene33312。而在所有样本中,Unigene26576和Unigene33024是最理想的内参基因,18S rRNA和SAMS是最不稳定的内参基因。

表2 12个候选内参基因在NormFinder分析下的表达稳定值Table 2 Expression stability values of 12 candidate reference genes calculated by the NormFinder

表3 12个候选内参基因在BestKeeper分析下的表达稳定值Table 3 Expression stability values of 12 candidate reference genes determined via BestKeeper.

表4 12个候选内参基因的综合排名Table 4 The comprehensive ranking of 12 candidate reference genes
3 讨论与结论
在不同的植物、组织和试验条件下,最优内参基因的表达稳定性不同[27]。Huang L.等[28]发现,在涝胁迫下,鸭茅(Dactylis glomerata L.)叶组织中 CYP2是最稳定的内参基因,而蒋晓梅等[29]证实,在相同条件下,鸭茅根组织中表达最稳定的内参基因是TCTP。冷胁迫下,柳枝稷(Panicum virgatum)叶组织中UBC表达稳定性最好[30],而根组织中ACTIN表达稳定性最强[31]。研究表明,内参基因除了在不同组织中表达稳定性不同,在不同植物中也具有表达差异。ACTIN在油菜[32](Brassica napus)中表达稳定性较差,而相同条件下在柠条锦鸡儿[33](Caragana Korshinskii)中表达稳定性较好。此外,叶新如等[34]研究了冬瓜(Benincasa hispida)的7个候选内参基因在不同非生物胁迫处理叶片中的表达稳定性。结果表明,不同胁迫处理下,表达最稳定内参基因也不同,高温胁迫下表达最稳定的是UBQ基因,而干旱胁迫下表达最稳定的则是TUA基因。
近年来,越来越多的研究选择从本物种的转录组数据中筛选内参基因。Yang C.L.等[35]通过分析圆齿野鸦椿(Euscaphis konishii)3个不同发育阶段的转录组数据筛选出3个稳定表达的内参基因:EkUBC23、EkCYP38和EkGAPDH2。Liu Q.等[36]在多花黑麦草(Lolium multiflorum L.)的转录组数据中筛选得到在盐碱胁迫下表达最稳定的内参基因为Unigene14912。本研究候选的unigene中Unigene26576在镉胁迫下和所有样本中表达最稳定,表明了其作为芒新内参基因的应用潜力,同时证明了基于本物种转录组数据筛选内参基因的可行性。此外,通过RefFinder软件分析发现在盐、砷和铬3种胁迫下,芒根组织最稳定的内参基因为Sb09g019750。然而Zhong M.等[37]证实,RefFinder鉴定下芒叶组织中Sb09g019750基因在盐和铬胁迫处理下没有表现出较强的稳定性,这表明在同一植物的不同组织中,内参基因也具有表达差异。在实时荧光定量PCR分析中,常选择功能较稳定的管家基因用于试验分析。侯维海等[38]对地黄(Rehmannia glutinosa)实时定量PCR内参基因进行筛选,结果显示18S rRNA表达丰度最高。而一些研究发现管家基因在某些植物中存在表达不稳定的情况。比如,在本研究中,18S rRNA在所有非生物胁迫下表达均不稳定,在盐、砷、镉胁迫下稳定性最差。因此,验证候选内参基因在不同植物、组织及试验条件下的表达稳定性,选择最适内参基因是保证试验结果准确性的前提保障。
本研究使用 geNorm、NormFinder、BestKeeper软件分析试验数据,结果显示3种分析方法在鉴定最稳定内参基因时存在排序差异,这可能与不同程序使用不同算法而产生的差异有关。如王宁航等[39]对望春玉兰内参基因筛选时发现,使用geNorm和NormFinder两种软件分析结果具有较高相似性,分析得到的最佳内参基因为MbTEF,最差的内参基因为MbUBC,而BestKeeper软件分析结果与二者差异较大,该软件筛选得到的最佳内参基因为MbCYP。在本研究中,分析结果与其大致相似。geNorm和NormFinder鉴定下最稳定的内参基因均为Unigene26576,而BestKeeper分析发现最稳定的内参基因为Sb02g041180,最不稳定的基因和geNorm和NormFinder筛选结果相同,均为18S rRNA。目前对于使用哪个软件能够更加科学准确地评价内参基因的稳定性并没有公认的经验,为此我们利用线上网络工具RefFinder对试验数据进行综合分析。结果显示,在所有样本中,表达最稳定的内参基因为Unigene26576和Unigene33024,此结果与 geNorm分析结果一致。同时,使用以上4种分析软件检测18S rRNA的稳定性均较差。因此,利用不同的软件分析试验数据,并比较不同的算法差异能更加准确地筛选出稳定的内参基因。
本研究对芒根组织在不同非生物胁迫下12个候选内参基因的表达进行分析,结果显示,在盐、砷、铬胁迫下,最稳定的内参基因为Sb09g019750;在干旱胁迫下,Sb02g041180基因稳定性最高,其次为ACTIN;在镉胁迫下,Unigene26576基因稳定性最高,PP2A其次。综合数据显示,Unigene26576和Unigene33024为芒根组织在不同非生物逆境下的最适内参基因。此为芒在不同胁迫下的进一步研究提供了合适的候选内参基因,为开展芒功能基因表达奠定了一定的基础。
