新生儿及产妇感染单核细胞增生李斯特菌分离株的血清型、耐药性及分子特征研究
2021-03-28王双杰岑贞娇吕素玲曾尚娟阮佳玲李颖丰
王双杰,岑贞娇,吕素玲,曾尚娟,阮佳玲,李颖丰
1. 广西壮族自治区妇幼保健院检验科,广西壮族自治区 南宁 530002; 2. 广西壮族自治区疾病预防控制中心, 广西壮族自治区 南宁 530028
单核细胞增生李斯特菌(Listeriamonocytogenes,Lm)可引起人畜共患李斯特菌病[1],尤其是在孕产妇、新生儿、老年人和免疫功能低下者中可引起严重的侵袭性疾病,死亡率高达 20%~30%[2-4]。Lm为兼性胞内寄生菌,广泛存在于自然界,如水、土壤、腐败植物等。Lm能在0~45 ℃环境中生长,具有较强的耐干冷环境特性,易污染食品加工环境,导致食物污染引起人、畜感染,已成为重要的威胁食品安全的食源性致病菌[5-6]。Lm可引起孕产妇宫内感染导致流产、早产及死胎[7],其主要通过胎盘垂直传播或吸入污染的羊水引起新生儿严重感染。目前,国内关于孕产妇感染Lm导致新生儿感染的病例不断被报道,提示孕产妇及新生儿Lm感染正在增加,且致死率升高[8-9]。当前针对新生儿Lm感染的发病率、临床分离株分子流行病学特点及临床特征的研究尚缺乏,本研究回顾性收集分析2015—2017年广西壮族自治区妇幼保健院从新生儿科及产科送检的血液、羊水、宫颈分泌物及耳拭子标本中分离的Lm毒株资料,对分离株进行体外抗生素药物敏感试验、血清学分型及多位点序列分型 (multilocus sequence typing,MLST)后做进一步分析,拟从药物敏感性、血清型和基因遗传背景角度为Lm的临床诊治提供更多的流行病学信息。
1 材料与方法
1.1 菌株来源
临床分离菌株:分别从新生儿科患儿送检的血液、耳拭子标本,以及从产科送检的患儿母亲血液、宫颈分泌物、羊水标本中分离培养Lm。在哥伦比亚血琼脂平板上挑取呈现β-溶血环的菌落单克隆置于菌种保存管中,储存在-80 ℃低温冰箱备用。
1.2 实验菌株的鉴定及体外药物敏感性试验
菌株鉴定:使用革兰阳性菌鉴定卡片GP鉴定卡(法国生物梅里埃公司),严格按照厂家操作说明对所分离菌进行鉴定。
体外药物敏感性试验:采用Lm微量肉汤稀释法药敏试剂盒(上海星佰生物技术有限公司),严格按照厂家操作说明对所分离的Lm进行药敏试验:挑取数个新鲜菌落,用灭菌生理盐水制成0.5麦氏单位的菌悬液后,吸取菌悬液60 μL,加至营养肉汤培养液中(12 mL)。按说明书要求,加入600 μL无菌马血清,完全混匀。用微量移液器吸取稀释菌液100 μL,加至除阴性对照孔外的微量药敏板中,阴性对照孔加入100 μL无菌营养肉汤培养液。放入恒温培养箱中35 ℃培养20~24 h。根据美国临床和实验室标准化协会(Clinical and Laboratory Standards Institute, CLSI)关于Lm抗微生物药物敏感性试验的要求,选择青霉素、氨苄西林、复方新诺明及美罗培南等药物进行测试。药敏试验结果判断参照不常见菌和苛氧菌药物敏感性试验解释标准[10]执行。
1.3 血清学分型
Lm的血清型由O抗原和H抗原共同决定。参照Lm诊断血清使用说明书,O抗原检测采用玻片凝集法,H抗原检测采用试管凝集法。所用试剂盒来自日本生研(Denka Seiken公司,日本)。结果判断参照中华人民共和国出入境检验检疫行业标准《单核细胞增生李斯特菌血清分型方法》[11]。
1.4 Lm的MLST检测
1.4.1Lm总DNA提取采用lysis buffer for microorganism to direct PCR试剂盒(大连TaKaRa公司,Code No.9164)提取菌株DNA,同时采用NanoDrop 2000微量紫外分光光度计(Thermo Scientific公司,美国)测定DNA浓度并于-20 ℃保存备用。
1.4.2Lm的MLST分析将所分离的Lm进行MLST分析。查阅相关文献[12]可知,所使用的Lm的7对管家基因分别为abcZ,bglA,cat,dapE,dat,ldh及lhkA;引物序列均摘自Institut Pasteur在线数据库(http://bigsdb.pasteur.fr/index.html),具体如表1所示。

表1 Lm的MLST分型中7对管家基因引物序列
1.4.3 聚合酶链反应(polymerase chain reaction,PCR)扩增产物分析采用50 μL PCR体系:6 μL DNA模板,正、反向引物各2 μL,25 μL Taq PCR MasterMix [天根生化科技(北京)有限公司],15 μL H2O。PCR扩增条件:94 ℃预变性4 min;94 ℃变性30 s,52 ℃(bglA为45 ℃)退火30 s,72 ℃ 延伸2 min,35个循环;72 ℃终末延伸 10 min。PCR产物经电泳验证后,送至广州艾基生物技术有限公司测序。使用Chormas软件查看编辑DNA峰形图,评估测序结果质量。将所得到的Lm7对管家基因测序结果提交至LmMLST数据库(http://bigsdb.pasteur.fr/listeria/listeria.html)中进行分析,确定各个管家基因的等位基因数值,与已公布的Lm7对管家基因的等位基因进行比较,进而确定Lm临床分离株的序列分型(sequence type,ST)。
2 结果
2.1 临床感染Lm情况分析
从2015年1月—2017年12月广西妇幼保健院新生儿科及产科送检的血液、羊水、宫颈分泌物及耳拭子标本中共分离培养出6株Lm,分别命名为Lm1~Lm6。其中Lm1、Lm2及Lm6从新生儿血标本中分离获得,Lm3和Lm4分别从患儿母亲(病例2)羊水及宫颈分泌物标本中分离获得,Lm5从新生儿(病例2)耳拭子标本中分离获得(表2)。期间共计 32 864 例活产儿纳入本研究,新生儿Lm发病率为0.091‰(3/32 864),2例患儿最终放弃治疗死亡,死亡率高达66.7%(2/3)。其中血培养检出Lm的2例患儿(病例1及病例2),均因宫内感染导致胎儿窘迫,行剖宫产娩出,为早产(<32周)低出生体重儿(出生体重<2 500 g),出生后均出现呼吸困难、气促、呼吸不规则,可见三凹征,两肺呼吸音粗;1例患儿(病例6)顺产娩出,出生后出现呼吸困难、气促、呻吟、少许红色血性痰、指端凉以及心率、血氧下降等重度窒息症状(见表2)。
患儿的母亲主要表现为呼吸系统症状、全身酸痛、乏力、急性发热等似流感样轻度症状,同时伴有胎膜早破、先兆早产、胎儿窘迫等宫内感染症状,流行病学调查显示均存在不洁净饮食史,近期食用过易被Lm污染的食物如冰淇淋、生冷食物、凉拌菜及蔬菜沙拉等,这些均增加了感染的风险(见表2)。
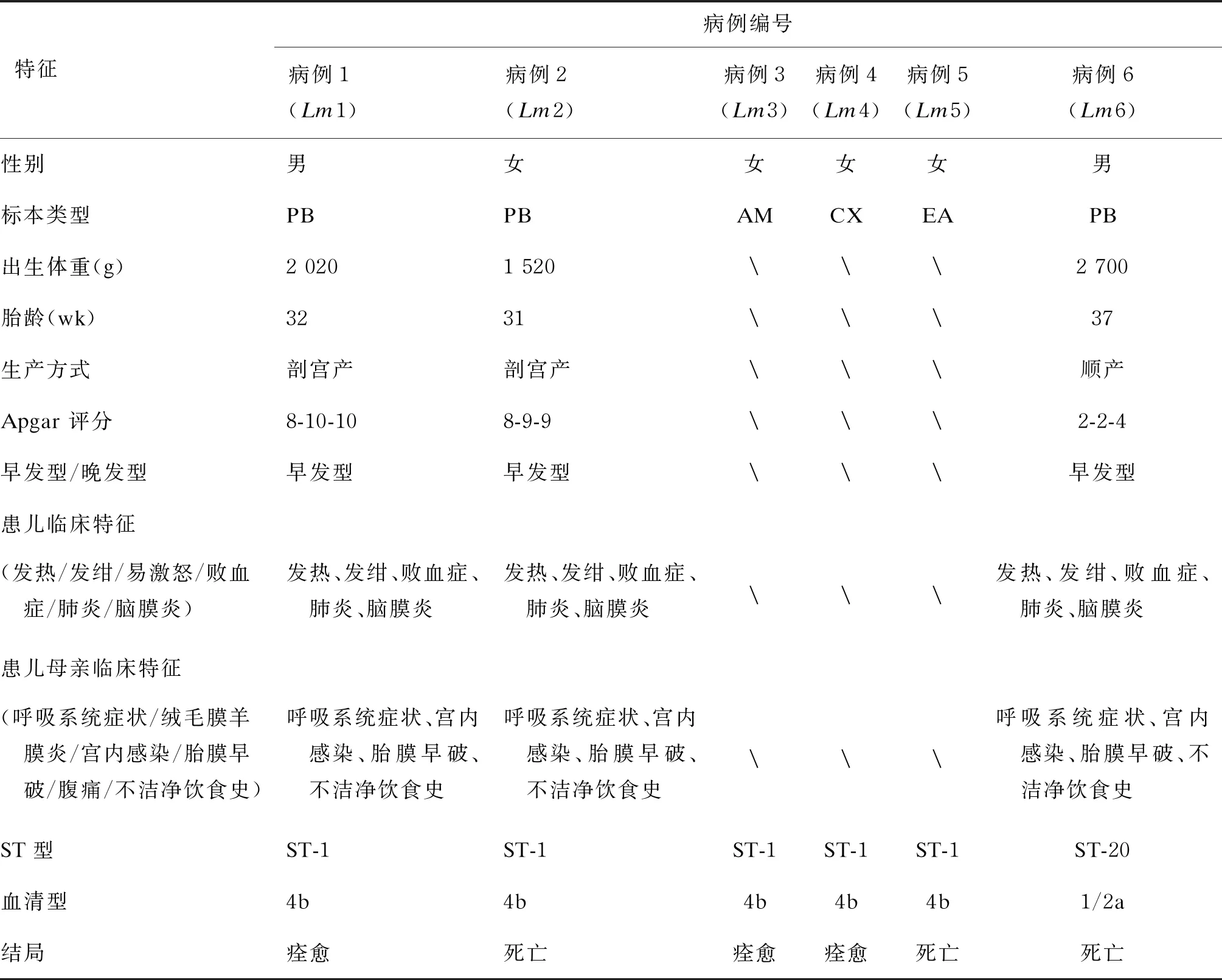
表2 侵袭性Lm感染患儿及其母亲的流行病学特征
2.2 分离株药物敏感性试验及血清学分型
Lm药物敏感性试验结果显示,分离株对CLSI M45推荐检测的4种抗菌药物均100%敏感。最低抑菌浓度(minimum inhibitory concentration,MIC)分别为青霉素0.5 μg/mL、氨苄西林 0.25 μg/mL、复方新诺明0.015/0.3 μg/mL及美罗培南0.125 μg/mL。
血清凝集试验检测发现,Lm分离株分属2个血清型,分别为4b(5株)和1/2a(1株)。其中4b是分离率最高的血清型,占83.3%(5/6);其次是1/2a,占16.7%(1/6)(见表2)。
2.3 MLST分型结果
按照Institut Pasteur MLST官网(http://bigsdb.pasteur.fr/)提供的特异性引物序列合成引物,经过特定的PCR体系扩增后,得到Lm的7对管家基因abcZ,bglA,cat,dapE,dat,ldh及lhkA的特异性PCR产物,经1.5%琼脂糖凝胶电泳可见各个管家基因清晰特异的目的条带,且阴性无污染,无明显二聚体。
将Lm分离株的7个管家基因等位基因数值提交至MLST数据库以获取对应的ST值。ST结果显示,临床所分离的Lm分为2个不同的ST型,对照数据库中的序列分型结果均能找到相同等位基因数值排列,即均为已知的ST型(见表2)。Lm的MLST分析定义7个管家基因的等位基因型中,拥有5个以上相同等位基因型的菌株组成一个克隆复合物(clonal complex,CC)[13]。在确定ST的基础上应用Institut Pasteur MLST数据库对分离的菌株进行同源性分析,结果显示,所分离的6株Lm可分为2个ST型(ST-1和ST-20),ST-1属于CC1克隆复合物,ST-20属于CC20克隆复合物。
3 讨论
李斯特菌病具有低致病率和高致死性的特点。据统计,国外新生儿李斯特菌病发病率为0.52‰[14],死亡率达20%~30%[15]。孕产妇感染Lm致流产及早产的发生率为2.4‰~5.5‰,与种族、饮食习惯及社会经济状况等有关[16-18]。目前,国内同类研究报道较少,本研究针对新生儿Lm感染的发病率及临床分离株的血清型、耐药性及分子特征进行研究,同时分析总结患儿及其母亲的临床特征。结果显示,广西南宁地区新生儿李斯特菌病发病率为0.091‰(3/32 864),低于国外水平,可能与我国以熟食为主的饮食习惯有较大关系。本研究统计发现该地区新生儿感染Lm的死亡率高达66.7%(2/3),远高于其他地区水平。其中3例(病例1、病例2及病例6)患儿均为败血症且于出生后24 h内发病(早发型感染,即出生后6 d内发病),患儿母亲均有宫内感染指征,提示大多数早发型感染在子宫内即发病。这3例早发型感染患儿(患儿出生后不久均出现呼吸困难、气促、发绀)均发生严重的败血症合并化脓性脑膜炎,最终1例(病例1)患儿治愈出院,2例(病例2及病例6)患儿因感染严重而放弃治疗。国内外因孕产妇感染Lm导致新生儿败血症及化脓性脑膜炎死亡的病例不断有报道[19],且有上升趋势。李斯特菌病多为散发病例,且潜伏期较长,大多数情况下呈隐性感染,无明显特异性症状[20]。本研究中3例患儿母亲的临床症状均不典型,具体表现为呼吸道感染(似流感样)、产前发热、宫内感染、胎膜早破及C反应蛋白显著持续升高等),疾病预防控制中心(简称“疾控中心”)流行病学调查显示均有不良饮食因素如凉食及生食蔬菜、水果史,增加了感染Lm的风险。以上资料提示临床医师面对孕晚期产妇出现急性发热、腹痛、羊水浑浊及轻度流感样等症状时,应重视排查其感染Lm的可能性,从而进行病原学检查,做到早期诊断与及时治疗,可降低新生儿感染发生。
Lm通常对青霉素、氨苄西林、复方新诺明及美罗培南等抗生素敏感。本研究结果显示,所有分离的Lm对上述4种抗生素的敏感率均为100%,暂未发现该地区有耐药菌株。需要特别注意该菌对头孢菌素天然耐药,而临床针对感染Lm孕产妇的标准治疗方案多为头孢菌素。本研究中1例患儿(病例6)胎龄37周,Apgar评分2-2-4,出生体重 2 700 g,C反应蛋白66.22 mg/L,在当地医院未明确病原菌前经验性使用头孢他啶抗感染,转至广西壮族自治区妇幼保健院后,病情严重,予美罗培南+氨苄西林舒巴坦抗感染,但最终因病情危重放弃治疗。
Lm目前可分为13个血清型,而引起人类感染的90%血清型[21-22]为1/2a、1/2b和4b,均具有较强的致病性。其中1/2a和1/2b血清型主要引起Lm散发感染,4b血清型主要引起Lm大范围暴发流行[23-24]。本研究结果中新生儿及产妇Lm血清型以4b型为主,占83.3%,血清型1/2b型占16.7%,与国内外相关研究一致[25-27]。结果提示该地区存在可引起暴发流行的血清型别,须加强食源性疾病监测,警惕大范围暴发流行的可能。
MLST是一种基于核酸序列测定的分型方法,可对病原菌生物进化进行分析及对耐药菌株进行追踪[28]。本研究对来源于新生儿血培养及患儿母亲分泌物的6株Lm进行MLST检测分析,ST分型结果显示,临床所分离的6株Lm可分为2个ST型(ST-1和ST-20),ST-1属于CC1克隆复合物,ST-20属于CC20克隆复合物。同源性分析结果表明广西南宁地区新生儿Lm感染的主要流行菌株为ST-1(83.3%)。在本研究中,分析来自同一新生儿患者(病例2)外周血(Lm2)、耳拭子(Lm3)及其母亲羊水(Lm4)、宫颈分泌物(Lm5)的4株菌,发现其具有相同的药物敏感表型、血清型以及MLST分型,提示新生儿早发型Lm感染源于宫内感染,由母婴垂直传播引起或在分娩过程中新生儿受到产道的病原菌感染。
被Lm感染的孕妇在围生期可有轻微自限性流感样症状、发热、腹痛、呕吐、腹泻、先兆早产等不同表现;新生儿则可表现出发热、气促、皮疹、反应差、呼吸异常、惊厥等,但临床表现缺乏特异性。因此,应高度重视具有高危因素的孕产妇及新生儿,警惕宫内感染的可能,及时给予适当的干预。在未明确病原菌前,临床经验性用药方案多为头孢菌素类抗生素,但须注意Lm对头孢菌素天然耐药。本研究纳入病例数较少,主要原因为目前该地区产Lm感染率较低,但研究内容仍可在一定程度上为临床诊治提供数据支持。实验室检出Lm后,应主动联系临床,并告知疾控中心食源性疾病监测工作组,及时对孕期妇女、新生儿家属进行食品安全宣传教育及流行病学调查,降低妊娠期感染率,减少新生儿李斯特菌病,杜绝Lm感染暴发的可能。
综上所述,临床医师积极采集孕产妇的血液、羊水及宫颈分泌物进行Lm检测,可对部分病例做出早期诊断;胎儿出生时可对血液、脑脊液、胎盘、羊水、皮肤拭子或婴儿的胎粪等标本进行Lm筛查培养,为临床医师明确病因、早期诊断、及时精准治疗、降低病死率提供帮助。
