脓毒症患者中可溶性髓样细胞触发受体1、降钙素原、核因子κB水平与肠道菌群失调的相关性
2021-03-28刘莉吴晓颖李兴泉
刘莉,吴晓颖,李兴泉
1. 重庆市綦江区人民医院消化内科,重庆 401420; 2. 重庆市綦江区人民医院感染科,重庆 401420
脓毒症是常见感染性疾病,病情发展迅速,很容易引起中毒性休克和多器官功能衰竭,病死率较高[1]。其重症患者机体存在应激反应,可导致肠道黏膜屏障破坏,肠道菌群失调,肠道细菌/内毒素移位,从而引发过度炎症反应和器官功能损害。可溶性髓样细胞触发受体1(soluble myeloid cell trigger receptor 1,sTREM1)是一种炎症因子,能激发炎症反应并使其放大[2]。降钙素原(procalcitonin,PCT)是一个全身细菌性感染诊断指标,具有较高的敏感度和特异度,在临床广泛应用[3]。核因子κB(nuclear factor-κB,NF-κB)是一种核转录因子,能调控多种炎性因子基因的表达[4]。为了探讨脓毒症患者中血清sTREM1、PCT、NF-κB水平与肠道菌群失衡的相关性,本研究选取重庆市綦江区人民医院重症医学科收治的86例脓毒症住院患者作为研究对象,检测个体肠道菌群α多样性、肠道菌群含量,以及血清sTREM1、PCT、NF-κB水平。
1 材料与方法
1.1 一般资料
选取2016年5月—2019年6月重庆市綦江区人民医院重症医学科收治的86例脓毒症患者,纳入脓毒症组。纳入标准:符合2016年美国重症医学会关于脓毒症的最新定义“Sepsis 3.0”诊断标准[5];患者知情同意;医院伦理委员会批准。排除标准:肛周感染、肠造瘘、慢性胃肠道疾病患者;近3个月内应用过肠道菌群调节剂、肠内营养剂的患者;恶性肿瘤患者;孕妇;患者入院前2周采用相关抗生素治疗。脓毒症组中男性46例,女性40例,年龄29~68岁,平均47.25(±4.51)岁,体质指数(body mass index,BMI)20.93~26.12 kg/m2,平均22.64(±2.86)kg/m2。将同期收治的50例未并发脓毒症的患者纳入非脓毒症组,其中男性26例,女性24例,年龄25~61岁,平均44.73(±7.63)岁,BMI为21.23~25.87 kg/m2,平均22.42(±2.65)kg/m2。选取同期于本院进行体检的健康人50例作为对照组,其中男性27例,女性23例,年龄25~61岁,平均44.73(±7.63)岁,BMI为21.50~25.61 kg/m2,平均22.31(±2.74)kg/m2。对照组均身体健康,无慢性疾病、代谢性疾病、消化道疾病;近3个月内未应用过肠道菌群调节剂、肠内营养剂。各组间基本资料无统计学差异,具有可比性。
1.2 研究方法
1.2.1 肠道菌群多样性研究留取脓毒症组及非脓毒症组患者入院的第1次粪便样本,对照组在体检时留取粪便样本。部分患者无法自主排便,采用灌肠取样。从新鲜粪便深处取2份样本:一份用无氧罐采集,于半小时内送检,检测肠道菌群含量;另一份装入标本盒内,贴上标签,置于液氮罐速冻后,置于-80 ℃冰箱保存。将粪便标本送至杭州美联医学控股有限公司检测,采用高通量16S rRNA基因测序技术分析。具体步骤包括:①样品总DNA的提取与质检;②聚合酶链反应(polymerase chain reaction,PCR)扩增及产物纯化,扩增优势细菌16S rRNA基因V3、V4可变区;③文库制备与库检,用标准Illumina MiSeq PE300文库构建及测序流程;④测序及分析,采用MiSeq测序仪,将结果提交至Silva和RDP数据库进行比对分析,并分析其菌群多样性。肠道菌群α多样性指标包括肠道菌群丰度指数(Ace指数、Chao指数)和肠道菌群多样性指数(Shannon指数、Simpson 指数)。Ace指数、Chao指数、Shannon指数越大,Simpson 指数越小,表明样本中微生物含量越丰富。
1.2.2 肠道菌群含量测定取1.0 g样本用无菌生理盐水稀释,按10倍连续稀释法稀释至10-8,振荡混匀,制成悬液。取各稀释度的悬液50 μL,涂于不同培养基。厌氧菌双歧杆菌培养方式:取稀释的菌液定量接种于0.1 mL双歧杆菌选择性培养基(BS)中,置于厌氧培养箱。托盘上放入适量钯粒,于厌氧袋内加入约 15 mL水,放入厌氧罐,立即盖好厌氧罐,于37 ℃电热恒温培养箱中培养48 h。需氧菌类杆菌(类杆菌选择性培养基)、大肠埃希菌(EMB琼脂培养基)、肠球菌(肠球菌选择性培养基)、葡萄球菌(葡萄球菌选择性培养基)采用相应培养基于37 ℃,体积分数5%的CO2培养箱中常规培养48 h。采用法国生物梅里埃公司ATB半自动微生物鉴定系统进行细菌鉴定。
1.2.3 血清sTREM1、PCT、NF-κB水平检测sTREM1、NF-κB采用酶联免疫吸附试验检测,试剂盒均购自武汉艾美捷科技有限公司。PCT采用化学发光法检测,试剂盒购自四川沃文特生物技术有限公司,检测设备为美国Bio-Rad Model 550酶标仪。
1.3 统计学分析
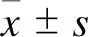
2 结果
2.1 肠道菌群α多样性的比较
脓毒症组Ace指数、Chao指数、Shannon指数显著低于非脓毒症组和对照组,Simpson指数显著高于非脓毒症组和对照组(P<0.05)。结果如表1所示。
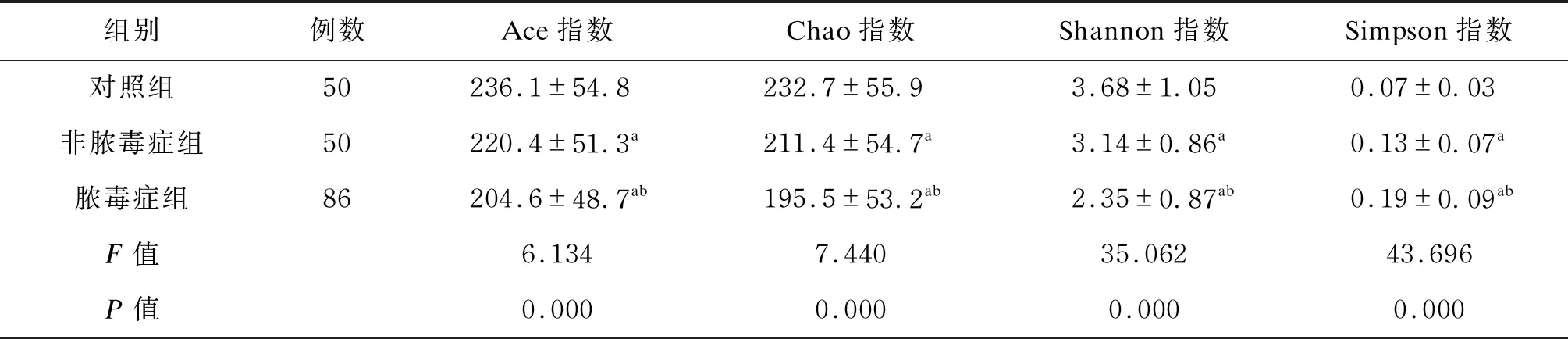
表1 肠道菌群α多样性的比较
2.2 肠道菌群含量的比较
脓毒症组类杆菌、双歧杆菌含量显著低于非脓毒症组和对照组,肠球菌、大肠埃希菌、葡萄球菌含量显著高于非脓毒症组和对照组(P<0.05)。结果如表2所示。
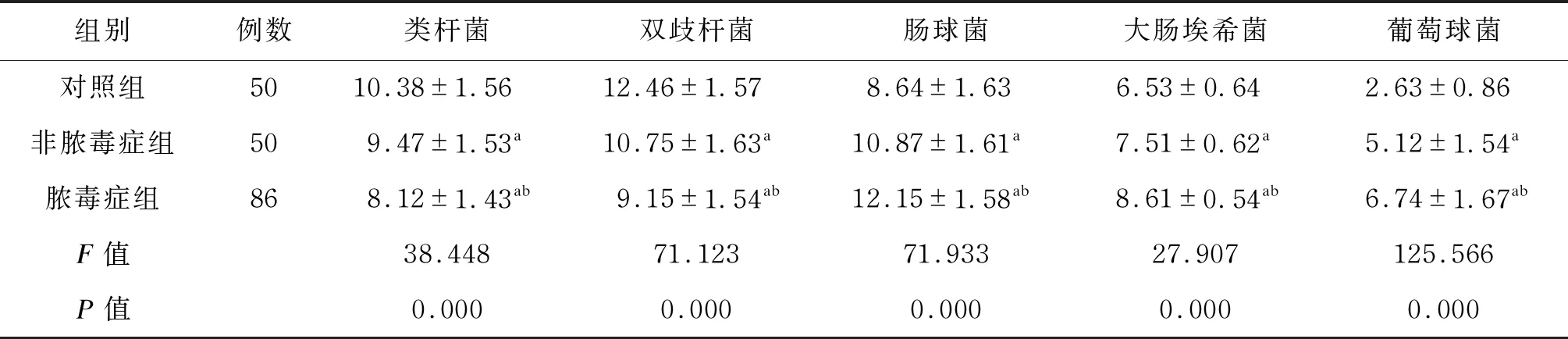
表2 肠道菌群含量的比较
2.3 血清sTREM1、PCT、NF-κB水平的比较
脓毒症组血清sTREM1、PCT、NF-κB水平显著高于非脓毒症组和对照组(P<0.05)。结果如表3所示。
表3 血清sTREM1、PCT、NF-κB水平的比较
2.4 脓毒症患者中sTREM1、PCT、NF-κB水平与肠道菌群失衡的相关性分析
Spearman相关性分析显示,脓毒症患者中sTREM1、PCT、NF-κB水平与Ace指数、Chao指数、Shannon指数均呈负相关(P<0.05),与Simpson指数呈正相关(P<0.05)。结果如表4所示。
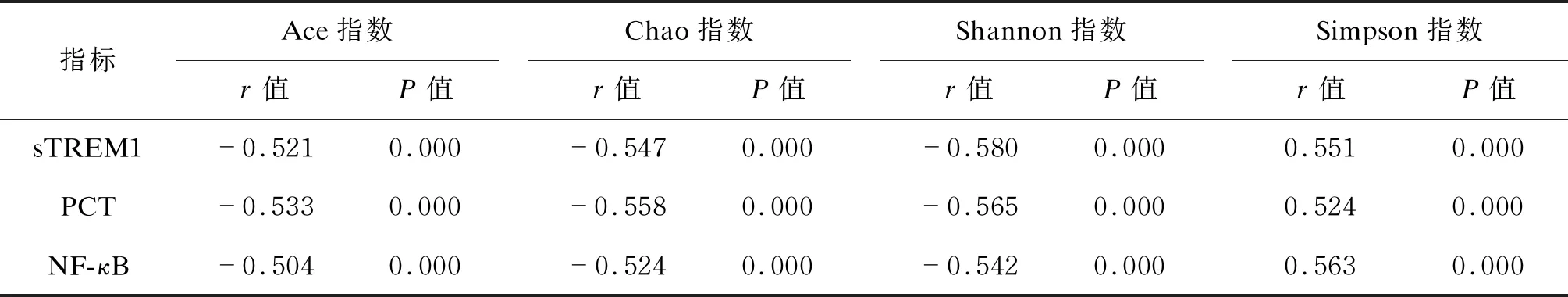
表4 脓毒症患者中sTREM1、PCT、NF-κB水平与肠道菌群失衡的相关性分析
3 讨论
脓毒症引起的多器官功能衰竭是临床上最常见的死亡原因,发病机制尚不十分清楚,但很多研究表明,主要是由机体过度释放炎性介质导致炎症反应和免疫功能紊乱引起的[6]。健康人体内肠道菌群保持着动态稳定,以维持机体健康。发生脓毒症时,肠道稳态被破坏,肠道菌群的种类、数量及比例等发生变化,主要表现为肠内益生菌减少,致病菌大量繁殖,肠道黏膜屏障被破坏,肠道通透性增加,从而导致各种细菌诱导宿主产生的炎性介质及免疫细胞因子通过破坏的黏膜屏障进入血液循环,并随着血液进入各组织器官,从而引发多器官功能障碍[7]。研究表明,肠道微生态紊乱程度与后续严重脓毒症的发生之间存在剂量效应关系[8]。本研究结果显示,脓毒症组Ace指数、Chao指数、Shannon指数显著低于非脓毒症组和对照组,Simpson指数显著高于非脓毒症组和对照组(P<0.05),提示脓毒症患者肠道菌群的丰度和多样性显著下降。细菌培养结果显示,脓毒症组类杆菌、双歧杆菌含量显著低于非脓毒症组和对照组,肠球菌、大肠埃希菌、葡萄球菌含量显著高于非脓毒症组和对照组(P<0.05),表明脓毒症患者肠道微生态严重失衡,潜在致病菌转变为优势菌。结果提示,脓毒症患者肠道菌群结构和数量的变化可能是导致疾病进展的一个重要原因。
本研究结果还显示,脓毒症组血清sTREM1、PCT、NF-κB水平显著高于非脓毒症组和对照组(P<0.05),提示血清sTREM1、PCT、NF-κB水平与脓毒症的发生、发展密切相关。此外,Spearman相关性分析显示,脓毒症患者sTREM1、PCT、NF-κB水平与Ace指数、Chao指数、Shannon指数均呈负相关(P<0.05),与Simpson指数呈正相关(P<0.05),进一步表明脓毒症患者中血清sTREM1、PCT、NF-κB水平与肠道菌群失衡有关。可能的原因是肠道为机体细菌和毒素的储存场所,脓毒症患者肠内致病菌大量繁殖,肠道菌群平衡被打破,益生菌减少,肠上皮功能发生障碍,炎性反应被激活,进而导致sTREM1、PCT、NF-κB等炎性介质释放,而sTREM1、NF-κB还可通过多种途径调控其他炎性因子的释放,使炎症反应级联放大,肠道菌群失调,肠壁通透性增加,进一步加重病情。由此提示,通过调节脓毒症患者的肠道菌群,恢复肠道菌群平衡,有利于修复肠道黏膜屏障,改善肠道免疫,促进其功能恢复。
TREM1是表达于髓样细胞的免疫球蛋白超家族成员,能选择性表达于中性粒细胞和单核-巨噬细胞,诱导炎性因子的表达,并放大细菌和真菌感染后的炎性级联反应,从而加重病情进展[9]。有研究显示,脓毒症患者外周血sTREM1和PCT水平明显增加,随着病情加重,sTREM1和PCT水平进一步升高,经过治疗可显著下调sTREM1和PCT的表达[10]。PCT是降钙素前体物质,无激素活性,在正常人体内水平极低。当机体发生细菌、真菌或寄生虫感染时,血清PCT水平会随着炎症反应的加重显著升高[11]。研究表明,PCT能评价脓毒症的严重程度,监测其动态变化有助于预测预后[12-13],还能对脓毒症患者的感染程度进行评估,具有重要的临床应用价值[14-15]。有研究表明,Toll样受体(Toll-like receptor,TLR)/NF-κB通路的激活是脓毒症发病的关键机制,TLR识别病原体后,通过细胞内途径激活NF-κB,在其调控下产生大量炎性介质,从而导致脓毒症的发生[16]。综上所述,血清sTREM1、PCT、NF-κB水平与脓毒症患者的肠道菌群失衡有关。
本研究还存在一定的局限性,所有受试者均来自单中心,存在潜在的选择偏倚,样本量也较小,研究结果需多中心、大样本、前瞻性研究的进一步证实。针对不同基础疾病、不同严重程度和预后情况可进行分组研究,对不同时间点的肠道菌群进行动态检测,以探讨不同组间菌群差异及变化规律性。此外,sTREM1、PCT、NF-κB三者之间也可能存在相互作用关系,后续可进行分子机制研究。
