不同条件下伤寒沙门菌Vi荚膜多糖的表达调控研究
2021-03-28尹芬芬谢中艺杨帆帆生秀梅黄新祥张盈
尹芬芬,谢中艺,杨帆帆,生秀梅,黄新祥,张盈
江苏大学医学院,江苏 镇江 212013
伤寒沙门菌(SalmonellaentericaserovarTyphi,S.Typhi)是一种寄生在人类肠道的革兰氏阴性杆菌,属于胞内寄生菌,具有严格的宿主特异性,人是其唯一感染宿主[1]。伤寒沙门菌的主要传播途径是粪-口传播,其通过污染的食物和水源进入机体,经消化道感染,最终引发严重的全身系统性疾病。伤寒热是典型症状,还会出现其他症状,如躯干出现玫瑰疹、腹痛、腹泻、肝及脾大、胃肠出血等[2]。
Vi荚膜多糖是伤寒沙门菌和丙型副伤寒沙门菌特有的一种多糖抗原[3],纯化后的Vi荚膜多糖可作为预防伤寒沙门菌感染的疫苗[4]。Vi荚膜多糖由位于沙门菌毒力岛7(Salmonellapathogenicity island 7,SPI-7)的viaB基因簇编码,viaB基因簇含有10个基因,包括负责调控的tviA、编码Vi荚膜多糖生物合成的tviBCDE、编码Vi荚膜多糖转运及细胞表面定植的vexABCDE[5]。其中,TviA调节蛋白是RcsB的辅助蛋白,可正向调控Vi荚膜多糖的表达;此外,TviA能抑制鞭毛调节因子flhDC和fliZ的表达进而抑制鞭毛蛋白分泌,还能抑制Ⅲ型分泌系统1(type Ⅲ secretion system 1,T3SS-1)基因的表达,导致细菌FliC蛋白表达减少,动力减弱,侵袭能力下降[6],从而减轻肠道炎症[7]。在鼠伤寒沙门菌(SalmonellaentericaserovarTyphimurium)中表达tviA基因可抑制鞭毛蛋白分泌,进而减少上皮T84细胞中白细胞介素8(interleukin 8,IL-8)的表达,还能抑制人急性单核细胞白血病(human acute monocytic leukemia,THP-1)细胞发生焦亡[8-9]。
Vi荚膜多糖是伤寒沙门菌的重要致病因子,其阳性菌株往往表现出更强的毒力,在从急性伤寒患者血液、骨髓及粪便中分离的菌株中大多可检测到其表达[10]。本研究探索了不同培养条件对伤寒沙门菌Vi荚膜多糖表达的影响,并使用野生(wide type,WT)株和Vi荚膜多糖缺陷株探讨Vi荚膜多糖对伤寒沙门菌在巨噬细胞内生存能力的影响,为进一步了解其致病机制提供一定的思路。
1 材料和方法
1.1 材料
1.1.1 菌株及细胞伤寒沙门菌WT株GIFU10007由日本岐阜大学医学院微生物学教研室馈赠,ΔvexE株为编码Vi荚膜多糖转运因子的vexE基因缺陷株,由本实验室制备及保存。THP-1细胞购自上海生命科学研究院细胞库。
1.1.2 试剂RNA提取试剂、丙二醇甲醚醋酸酯(1-methoxy-2-propyl acetate,PMA)购自德国Sigma公司,反转录试剂、SYBR荧光定量试剂购自南京Vazyme生物科技有限公司,RIPM 1640细胞培养液购自美国Gibco公司。流式细胞术检测中,一抗为兔源抗Vi荚膜多糖抗体,购自宁波天润生物药业有限公司;二抗为异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的羊抗兔抗体,购自武汉ABclonal生物科技有限公司。
1.1.3 引物实验中所用实时荧光定量反转录聚合酶链反应(real time fluorescent quantitative reverse transcription polymerase chain reaction,real time RT-PCR)引物均由苏州泓讯生物科技有限公司合成,序列如表1所示。

表1 Real time RT-PCR特异性引物
1.2 方法
1.2.1 细菌培养将WT株接种于2 mL新鲜LB液体培养基中,37 ℃、250 r/min培养过夜,作为种子液。次日,按1∶100比例将种子液转接至20 mL新鲜液体培养基中。当细菌培养至对数早期(A600≈0.4)时,在转接LB培养基中分别加入应激原:加入30% H2O2作为氧应激,并使其终浓度达到5 mmol/L;加入浓盐酸作为酸应激,并使其pH值为5.0;加入MgCl2溶液作为Mg2+应激,使Mg2+终浓度分别为10 mmol/L和50 mmol/L;加入多黏菌素B(polymyxin B,PB)作为抗菌肽应激,并使其终浓度达到0.1 mg/L。加入各种应激原后继续培养 30 min,转接至新鲜SOB(1∶100,静置培养)、LPM(1∶50)、M9(1∶50)培养基,转接后的培养时间与LB应激培养时间保持一致。
1.2.2 RNA提取和real time RT-PCR将1.2.1中培养的细菌以 4 000 r/min离心10 min,收集菌体,用TRIzol法提取细菌RNA,取2 μg RNA,消化基因组DNA,用反转录试剂将其反转录为cDNA。以16S rRNA作为内参基因,采用相对定量法检测tviA、tviB、vexE基因的表达水平。实验均进行3次以上生物学重复。
1.2.3 流式细胞术取1.2.1中培养的细菌 1 mL,以 4 000 r/min离心10 min,弃去上清液;加入500 μL磷酸盐缓冲液(phosphate buffered saline,PBS)洗2次,12 000 g 离心2 min,弃去上清液;加入200 μL兔源抗Vi荚膜多糖抗体(用PBS按1∶100稀释),4 ℃孵育过夜;加入500 μL PBS洗2次,12 000 g离心2 min,弃去上清液;加入200 μL FITC标记的羊抗兔二抗(用PBS按1∶100稀释),4 ℃孵育 20 min;加入500 μL PBS洗2次,12 000 g离心2 min,重悬于100 μL PBS。用流式细胞仪检测菌株表面的荧光信号强度,以反映Vi荚膜多糖的表达变化[11]。实验均进行3次以上生物学重复。
1.2.4 THP-1胞内生存实验THP-1细胞用含10%胎牛血清的RIPM 1640培养液培养。24孔板中每孔接种5×105个细胞,加入PMA(终浓度为150 μg/L),置于37 ℃、体积分数为5% CO2细胞培养箱中静置培养48 h,诱导THP-1细胞分化为巨噬细胞。实验前1 h吸弃培养液,用无菌PBS洗1次后加入新鲜细胞培养液。取1.2.1中置于SOB培养基静置培养8 h的菌液,以感染复数(multiplicity of infection,MOI)为20感染巨噬细胞1 h,每孔加入庆大霉素(终浓度为100 mg/L)继续培养1 h杀死胞外细菌。每个菌株的前1/2孔用预热的PBS洗3次,加入1 mL 0.5% Triton裂解细胞,37 ℃放置10 min后吸取孔内所有液体离心,弃上清液后用PBS重悬菌体,适当稀释后涂布于LB平板,37 ℃过夜培养后进行菌落计数并乘以稀释倍数作为T0(代表基础吞噬水平)。后1/2孔吸弃一半旧培养液,加入等量新培养液继续培养2 h。按上述方法涂板,次日进行菌落计数并乘以稀释倍数作为T2(代表胞内细菌增殖水平)。计算各菌株的T2/T0,以比较不同菌株的胞内生存能力。实验均进行3次以上生物学重复。
1.3 统计学分析
采用GraphPad Prism 8.0统计软件分析数据,两组间均数比较采用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 不同应激对Vi荚膜多糖表达的影响
将WT株在LB培养基中培养至对数早期(A600≈0.4),分别加入酸应激、氧应激、Mg2+应激、PB应激后继续培养30 min,检测Vi荚膜多糖相关基因的转录情况。Real time RT-PCR结果显示,加入酸应激后,tviA、tviB、vexE的mRNA水平显著增加(见图1A);加入氧应激、PB应激、Mg2+应激后,tviA、tviB、vexE的mRNA水平显著下降(见图1B~1D)。
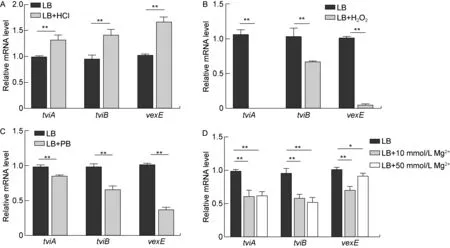
A: S. Typhi was cultured under acid stress. B: S. Typhi was cultured under oxygen stress. C: S. Typhi was cultured under antimicrobial peptide stress. D: S. Typhi was cultured under Mg2+ stress. *P<0.05, **P<0.01.
流式细胞术结果显示,加入酸应激和氧应激后,FITC荧光信号强度均增强(见图2),表明Vi荚膜多糖表达增加;加入PB应激和Mg2+应激后,荧光强度均减弱(见图3),表明Vi荚膜多糖表达下调。除氧应激外,其余应激组的流式细胞术检测结果与real time RT-PCR检测结果一致。
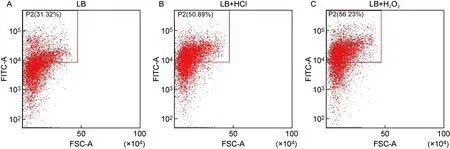
A: S. Typhi was cultured without stress. B: S. Typhi was cultured under acid stress. C: S. Typhi was cultured under oxygen stress.
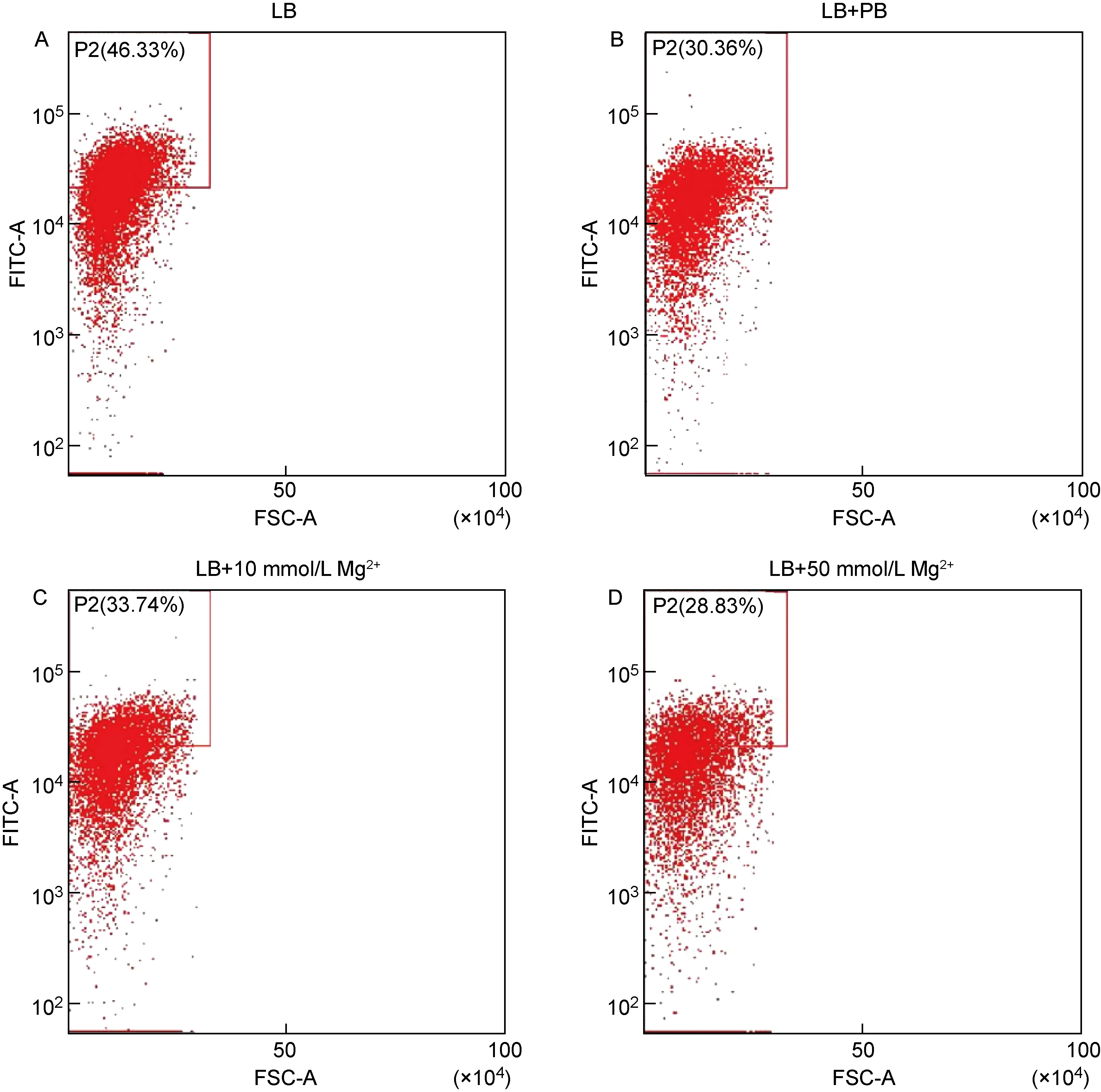
A: S. Typhi was cultured without stress. B: S. Typhi was cultured under antimicrobial peptide stress. C and D: S. Typhi was cultured under Mg2+ stress.
2.2 不同培养环境对Vi荚膜多糖表达的影响
将WT株种子液分别转接至SOB、LPM、M9培养基中,培养时间与LB组保持一致,检测Vi荚膜多糖相关基因的转录水平。已有相关文献报道,SOB培养基促进Vi荚膜多糖表达增加[12],因此本研究将SOB培养条件作为阳性对照。Real time RT-PCR结果显示,在SOB培养基中,tviA、tviB、vexE的mRNA水平显著增加(见图4A);在LPM和M9培养基中,tviA、tviB、vexE的mRNA水平也明显上升(见图4B、4C)。
流式细胞术检测结果显示,与LB组相比,SOB阳性对照组Vi荚膜多糖表达明显增加(见图5A、5B)。LPM、M9培养基中表达Vi荚膜多糖的细菌数量较LB培养基明显增加(见图5A、5C、5D),与SOB阳性对照组相比也显著上升(见图5B、5C、5D),表明LPM和M9培养基有利于诱导Vi荚膜多糖的表达。
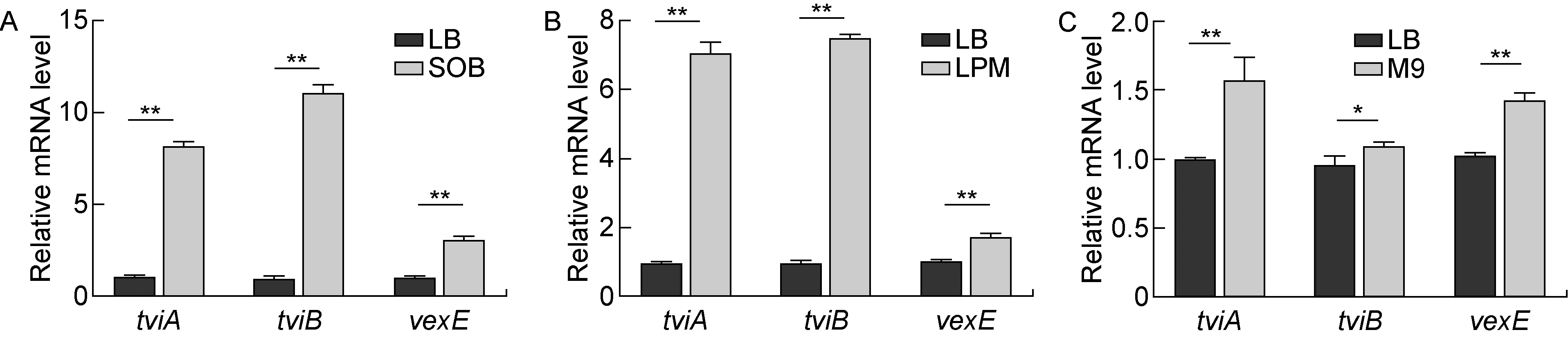
A: S. Typhi was cultured in LB and SOB media. B: S. Typhi was cultured in LB and LPM media. C: S. Typhi was cultured in LB and M9 minimal media. *P<0.05, **P<0.01.
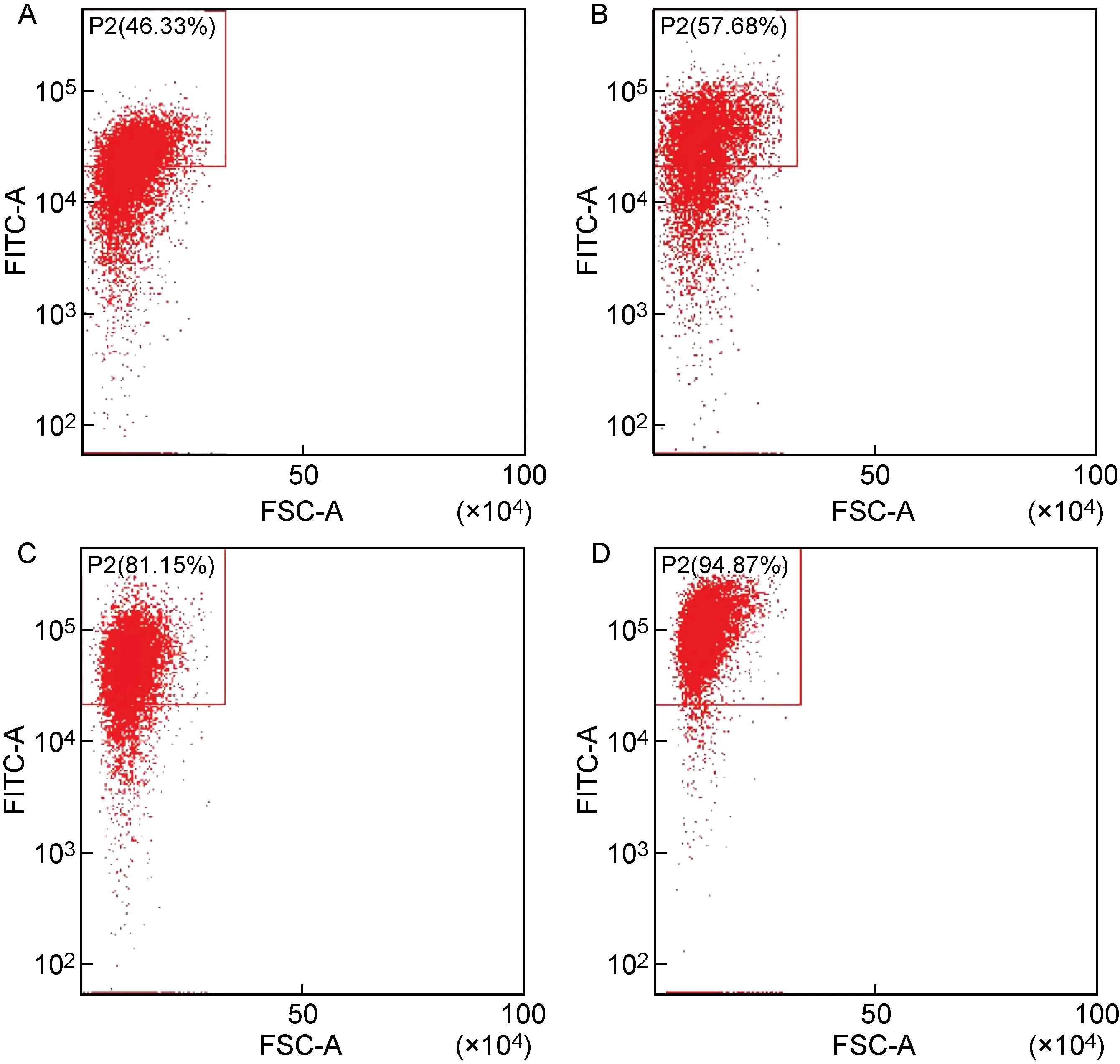
A: S. Typhi was cultured in LB medium. B: S. Typhi was cultured in SOB medium. C: S. Typhi was cultured in LPM medium. D: S. Typhi was cultured in M9 minimal medium.
2.3 Vi荚膜多糖增强伤寒沙门菌在巨噬细胞内的生存能力
vexE基因编码Vi荚膜多糖的转运因子,其缺陷基本不影响Vi荚膜多糖的生物合成,但对Vi荚膜多糖的正常转运及在细胞表面紧密定植有很大的影响[13]。本课题组已证实ΔvexE菌株表面基本无Vi荚膜多糖表达。将WT株和ΔvexE株分别感染THP-1细胞,探究Vi荚膜多糖对细菌胞内生存能力的影响。结果如图6所示,与WT株相比,ΔvexE株在培养2 h后胞内生存能力显著下降,表明Vi荚膜多糖的表达有利于伤寒沙门菌在巨噬细胞内生存。
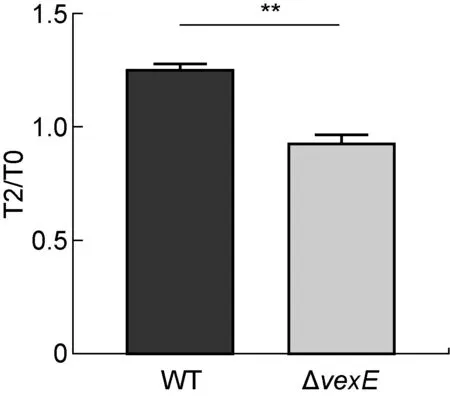
**P<0.01.
3 讨论
全球每年有 2 100 多万人感染伤寒沙门菌[2],在人口密度大、医疗卫生落后的国家和地区,伤寒沙门菌感染是值得关注的公共卫生问题[14]。伤寒沙门菌通过污染的食物和水源进入机体,突破胃酸屏障到达小肠,穿越一种具有抗原呈递功能的特殊上皮细胞——M细胞后,进入派尔集合淋巴结,引起炎症反应,然后被巨噬细胞、中性粒细胞等免疫细胞吞噬。
细菌经过胃时会遭遇酸性环境,本研究中酸应激促使Vi荚膜多糖表达增加可能是细菌抵抗胃酸环境的一种机制。抗菌肽是天然免疫系统的重要组成部分,PB可与细菌表面带负电荷的脂多糖(lipopolysaccharide,LPS)结合,改变细菌外膜通透性后进入细菌并发挥杀菌作用。同时,细菌也进化出多种策略来抵御抗菌肽,如PmrA/PmrB双组分系统调控的基因pbgP和pmrC能修饰脂质A分子,增加对阳离子抗菌肽的抗性;PmrG蛋白能介导核心低聚糖的去磷酸化作用[15-16],从而中和外膜上的负电荷,阻止PB与LPS结合。本研究显示,加入PB应激后伤寒沙门菌Vi荚膜多糖表达减少,可使细菌更好地修饰LPS,进而抵抗PB的杀伤作用。
细菌能感知生存环境中二价阳离子如Mg2+的浓度变化,PhoP/PhoQ双组分调节系统在其中发挥重要作用。组氨酸激酶PhoQ与Mg2+结合后发生自身磷酸化,生成PhoP-P。当周边环境中Mg2+浓度较低时,激活PhoP-P生成的基因转录增加;而当Mg2+浓度较高时,PhoP-P去磷酸化,激活PhoP-P生成的基因转录受到抑制[17]。本研究中,分别加入终浓度为10 mmol/L、50 mmol/L的Mg2+应激后,Vi荚膜多糖的表达减少,可能与激活PhoP-P生成的基因转录被抑制有关。PhoP/PhoQ双组分系统是否参与Vi荚膜多糖的表达调控,以及PhoP是否直接或间接调控Vi荚膜多糖相关基因值得进一步探究。
巨噬细胞吞噬伤寒沙门菌后会产生具有较强杀菌能力的活性氧如超氧阴离子、H2O2等,同时伤寒沙门菌受到氧化胁迫时会启动抗氧化应激系统进行自我保护。细菌中主要存在SoxRS和OxyR两类氧化还原调控因子以抵抗氧应激。研究表明,伤寒沙门菌中的OxyR能直接结合tviA启动子区域,正向调控viaB基因簇的表达,进而促进Vi荚膜多糖的表达[5]。本研究中流式细胞术检测结果表明,加入氧应激后Vi荚膜多糖表达明显增多,与以前报道一致,这是细菌氧化防御系统启动后自我保护的结果。但real time RT-PCR结果表明,加入氧应激后Vi荚膜多糖相关基因转录减少,原因是H2O2应激早期Vi荚膜多糖相关基因转录增加引起Vi荚膜多糖表达增加,但氧应激后期由于H2O2的杀菌作用,许多细菌无法增殖及维持Vi荚膜多糖相关基因的表达,从而real time RT-PCR结果表现为Vi荚膜多糖表达明显减弱。
伤寒沙门菌能在巨噬细胞中形成含沙门菌液泡(Salmonella-containing vacuole,SCV)来抵抗免疫细胞的杀伤清除作用,并在其中增殖,从而对机体产生持续性感染。LPM培养基可用来模拟巨噬细胞SCV内环境(SCV内环境是一个低Mg2+浓度和酸性环境)。本研究中,LPM培养基诱导Vi荚膜多糖表达,猜测是低浓度Mg2+和酸性环境共同作用的结果,与加入Mg2+应激、酸应激后的结果一致。M9最小培养基是一种营养缺乏的培养基,伤寒沙门菌通过上调Vi荚膜多糖表达来抵抗周边恶劣的生存环境,保护自身免受其他细菌的攻击,这可能是细菌的自我保护策略之一。
此外,SCV成熟后酸化可激活SPI-2,促进SPI-2编码的T3SS-2的组装及效应蛋白的转运[18]。M9最小培养基能诱导SPI-2毒力基因的表达[19]。参与SPI-2毒力基因表达调控的EnvZ/OmpR双组分系统中,OmpR在高渗应激条件下能结合tviA启动子区域,促进Vi荚膜多糖相关基因的转录[20],且能直接并正向调控伤寒沙门菌在巨噬细胞内生存的相关基因ssrA、ssrB和sipC的转录,从而增强细菌的胞内生存能力[21]。伤寒沙门菌在酸应激和使用LPM、M9培养基培养后Vi荚膜多糖表达增加,Vi荚膜多糖转运因子vexE基因缺陷后伤寒沙门菌胞内生存能力下降,这些是否与SPI-2相关需更多的证据。SPI-2毒力基因是否直接或间接调控Vi荚膜多糖相关基因, Vi荚膜多糖相关基因是否影响SPI-2基因的表达也有待进一步探究。
综上所述,本研究通过体外模拟伤寒沙门菌入侵机体后遭遇的各种宿主环境,发现酸应激、LPM、M9培养均显著促进了Vi荚膜多糖的表达,抗菌肽和高浓度Mg2+抑制了Vi荚膜多糖的表达,Vi荚膜多糖有利于细菌在巨噬细胞内生存。氧应激对Vi荚膜多糖的表达调控是否存在时相性及动态变化还有待进一步探究。
