不同严重急性呼吸综合征冠状病毒2抗体检测试剂盒的诊断应用评价
2021-03-28李海聪王前英韩伟靖周毅曹丹朱召芹
李海聪,王前英,韩伟靖,周毅,曹丹,朱召芹
上海市(复旦大学附属)公共卫生临床中心检验医学科,上海 201508
2020年1月30日,世界卫生组织(World Health Organization,WHO)宣布严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)感染所致疫情为国际公共卫生紧急事件[1]。至2021年6月,新冠疫情已扩散至全球,造成超过2亿人感染,450多万人死亡[2]。SARS-CoV-2为β属冠状病毒,基因特征与严重急性呼吸综合征冠状病毒(severe acute respiratory syndromes coronavirus,SARS-CoV)和中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus,MERS-CoV)有明显区别[3]。目前,WHO推荐病毒核酸检测[如反转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)等方法]为SARS-CoV-2感染确诊的常规手段,但核酸检测对样本采集、样本运输、实验室环境、仪器设备和操作人员均有较高的要求[4-5]。
国务院应对新型冠状病毒肺炎疫情联防联控机制综合组在2021年5月11日发布的《新型冠状病毒肺炎防控方案(第八版)》中指出,SARS-CoV-2血清特异性IgM抗体和IgG抗体的检测可作为确诊病例和无症状感染者的血清学证据,也可用于排除疑似病例[6]。血清学检测可作为核酸检测的补充手段。已有文献报道,发病约3周后,SARS-CoV-2感染者体内的IgG和IgM血清学转换率可分别达到100%和73.7%[7]。国内一些体外诊断试剂生产公司已陆续开发出SARS-CoV-2抗体免疫检测试剂。为了对SARS-CoV-2血清学诊断方法进行验证,本研究选取6个品牌的SARS-CoV-2抗体检测试剂盒进行临床灵敏度和特异性的评估,期望为SARS-CoV-2的临床诊断提供数据,为临床工作者提供参考。
1 对象和方法
1.1 标本来源
收集2020年1月30日-5月11日在上海市(复旦大学附属)公共卫生临床中心的住院患者血清245例,其中122例SARS-CoV-2感染确诊患者(SARS-CoV-2核酸检测阳性)作为病例组,包含男性67例(年龄34.09±16.79岁)和女性55例(年龄 31.21±12.11岁);其余123例为排除SARS-CoV-2感染的其他疾病患者,作为对照组,包含男性77例(年龄47.73±21.51岁)和女性46例(年龄46.40±18.95岁),其中肺部感染28例,发热9例,肺结核8例,肝炎7例及糖尿病、人类免疫缺陷病毒(human immunodeficiency virus, HIV)感染等其他疾病71例。
本研究为回顾性研究,经上海市(复旦大学附属)公共卫生临床中心医学伦理委员会审查批准(公卫伦审[2020]YJ-2020-S80-02-01号),符合《赫尔辛基宣言》原则。
1.2 试剂与仪器
本研究选择6个品牌的SARS-CoV-2抗体检测试剂盒,其中3个试剂盒为胶体金法(POCT),另外3个试剂盒为基于化学发光免疫分析法(chemiluminescence immunoassay, CLIA)平台;2个试剂盒检测抗SARS-CoV-2总抗体,其余4个试剂盒分别检测SARS-CoV-2特异性IgG和IgM抗体。将选用的6个试剂公司生产的SARS-CoV-2抗体检测试剂盒依次编号为A,B,C,D,E,F。A为SARS-CoV-2抗体检测试剂盒(胶体金法,试剂批号为W19500209);B为SARS-CoV-2 IgG/IgM抗体检测试剂盒(胶体金法,试剂批号为20200311,20200404);C为SARS-CoV-2 IgG/IgM抗体检测试剂盒(胶体金法,试剂批号为2004080410);D为SARS-CoV-2抗体检测试剂盒(磁微粒CLIA,试剂批号为20200417,仪器为Caris 200);E为SARS-CoV-2 IgG抗体测定试剂盒和SARS-CoV-2 IgM抗体测定试剂盒(CLIA,试剂批号为20200101,20200202,仪器为iFlash3000);F为SARS-CoV-2 IgG抗体检测试剂盒和SARS-CoV-2 IgM抗体检测试剂盒(CLIA,试剂批号为20200425,仪器为AE-180)。
1.3 SARS-CoV-2抗体检测
使用编号为A,B,C,D,E,F的6个SARS-CoV-2抗体检测试剂盒,分别对245例住院患者的血清进行抗体检测,并分析其临床灵敏度、临床特异性、阳性预测值(positive predictive value,PPV)和阴性预测值(negative predictive value,NPV)等指标。所有操作均严格按照仪器和试剂盒说明书进行。
1.4 SARS-CoV-2核酸检测
采用PCR方法对245例住院患者的咽拭子进行核酸检测。所有操作均严格按照仪器和试剂盒说明书进行。
1.5 统计学方法
采用 Wilson得分方法计算95%置信区间,采用 McNemar’s Test(配对卡方检验)对血清学检测结果与核酸检测结果进行统计学分析,P<0.05代表有统计学差异。应用GraphPad对数据进行作图并分析。
2 结果
2.1 试剂盒临床特异性和临床灵敏度比较
以病例组122例经核酸检测证实为SARS-CoV-2感染的患者和对照组123例排除SARS-CoV-2感染的其他疾病患者为检测对象,胶体金试剂和CLIA试剂检测的临床特异性和敏感性结果如表1所示。结果显示,各品牌试剂的临床灵敏度表现差异较大,使用胶体金法的试剂盒中,A试剂、C试剂(IgG+IgM)和B试剂(IgG+IgM)的灵敏度分别为84.4%、59.8%和55.7%;使用CLIA的试剂盒中,D试剂、E试剂(IgG+IgM)和F试剂(IgG+IgM)的灵敏度分别为85.2%、72.1%和77.9%。CLIA的阳性检出率整体高于胶体金法。在区分SARS-CoV-2 IgM和IgG抗体检测试剂的结果中,IgG抗体的检出率均高于或等于IgM,但并非所有IgM阳性的样本都可检出IgG阳性。IgG和IgM联合检测的灵敏度均高于单独检测IgG或IgM。
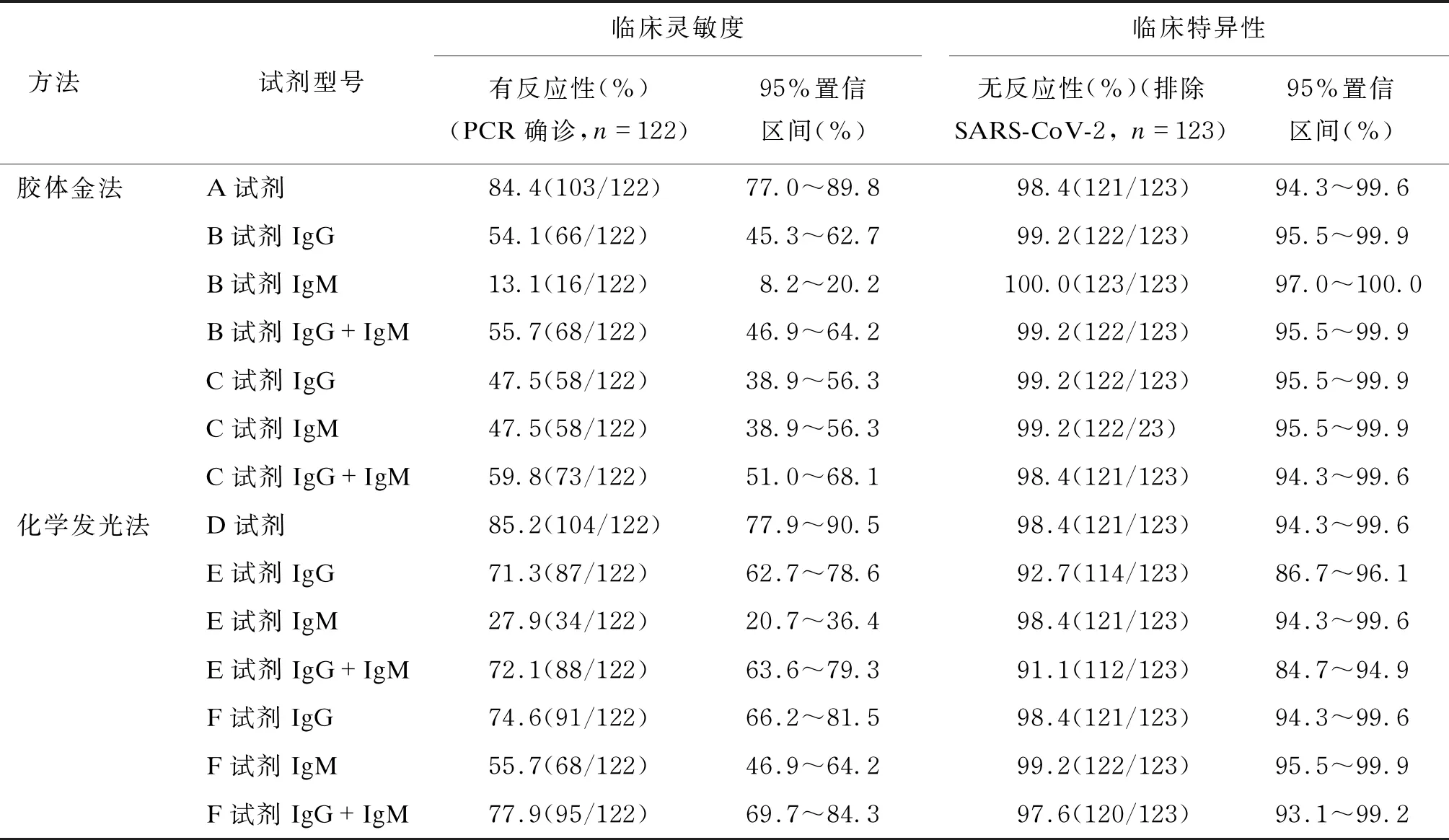
表1 各试剂临床特异性和临床灵敏度比较(n=245)
在对照组的假阳性样本中,1例患者C试剂IgG、D试剂总抗体、F试剂IgG的检测结果均为阳性,此患者为男性,67岁,临床诊断为结核性气胸,经证实阳性;另有15例样本的某一试剂检测结果为阳性。IgM检测的特异性略高于IgG。
2.2 血清学检测与核酸检测比较
依据阳性预测值,得出阳性检测的样本中,SARS-CoV-2感染患者占阳性检测样本总数的88.9%~100%(见表2)。依据阴性预测值,得出阴性检测的样本中,正常样本占阴性检测样本总数的 53.7%~87.1%(见表2)。
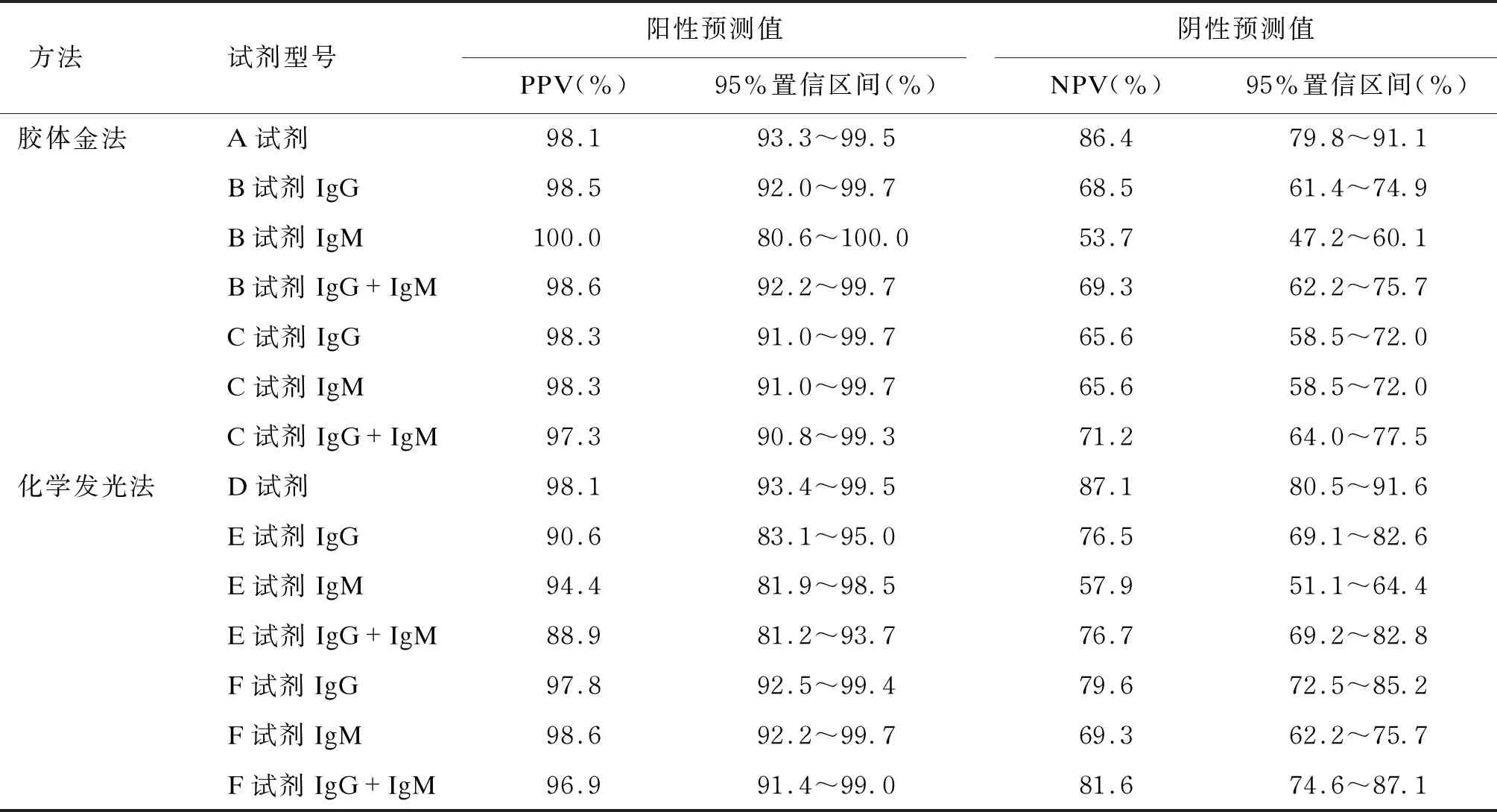
表2 各试剂阳性预测值和阴性预测值
胶体金检测试剂中,A试剂总抗体、B试剂(IgG+IgM)、C试剂(IgG+IgM)与核酸诊断的符合率分别为91.4%、77.6%和79.2%。经 McNemar’s Test检验,χ2值分别为12.19、49.16和41.49,且P<0.05,与核酸诊断的差异具有统计学意义。
CLIA试剂中,D试剂、E试剂(IgG+IgM)和F试剂(IgG+IgM)与核酸诊断的符合率分别为91.8%、81.6%和87.8%,经 McNemar’s Test检验,χ2值分别为11.25、10.76和17.63,P<0.05,与核酸诊断的差异有统计学意义。
2.3 血清学检测与核酸检测确诊时间
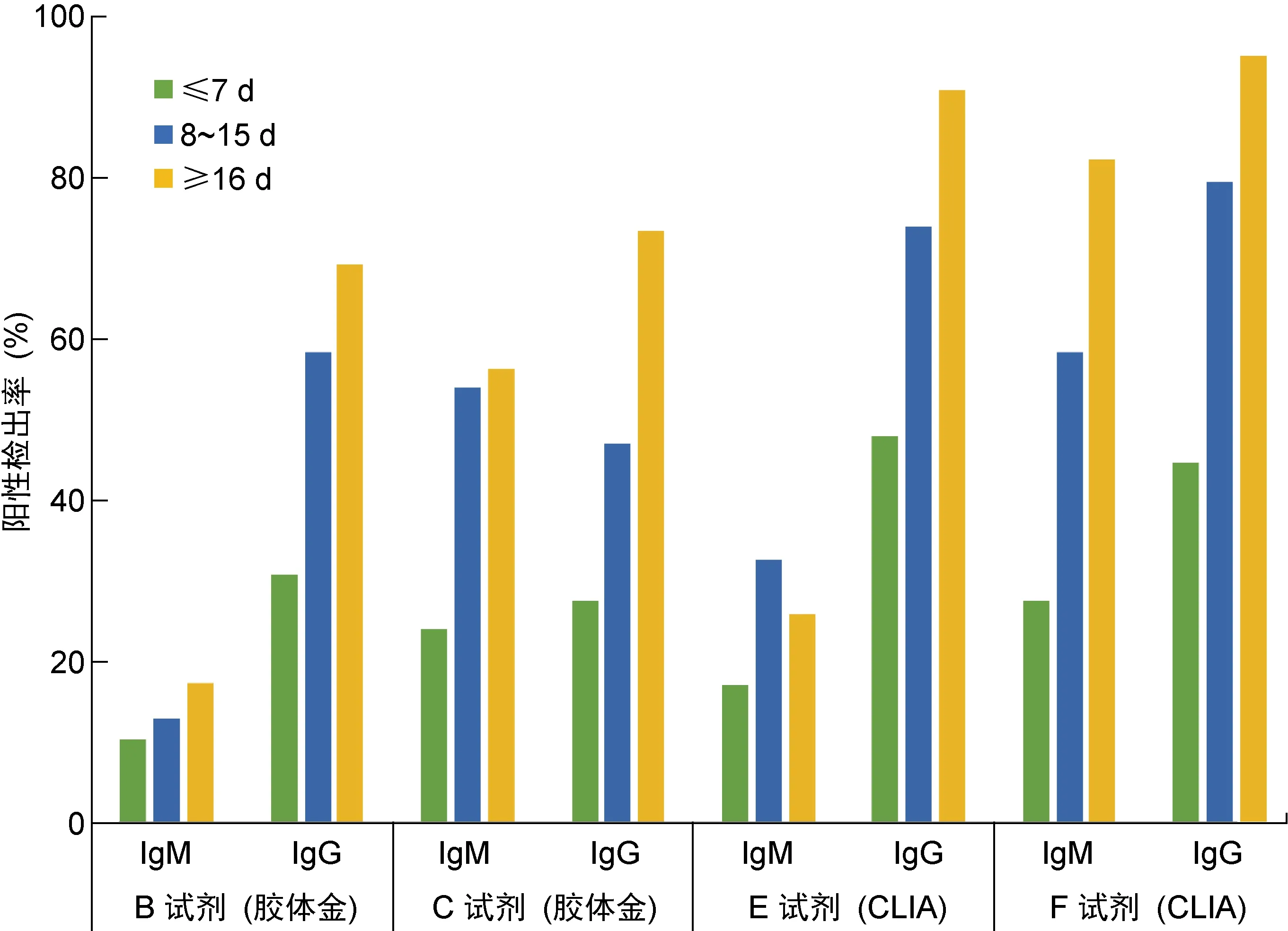
为分析感染后不同阶段血清学总抗体(IgG+IgM)的检测结果,将病例组所有样本根据核酸检测确诊后的天数分为3组:≤7 d、8~15 d和≥16 d。3组的灵敏度分别为31%~66%、61%~91%和70%~96%,所有评估试剂的阳性检出率均随时间上升(见表3、图1)。区分IgG和IgM检测的试剂也根据时间进行了统计(见表3,图2),其中F试剂对IgG的检测表现最优,≥16 d组的灵敏度为96%。
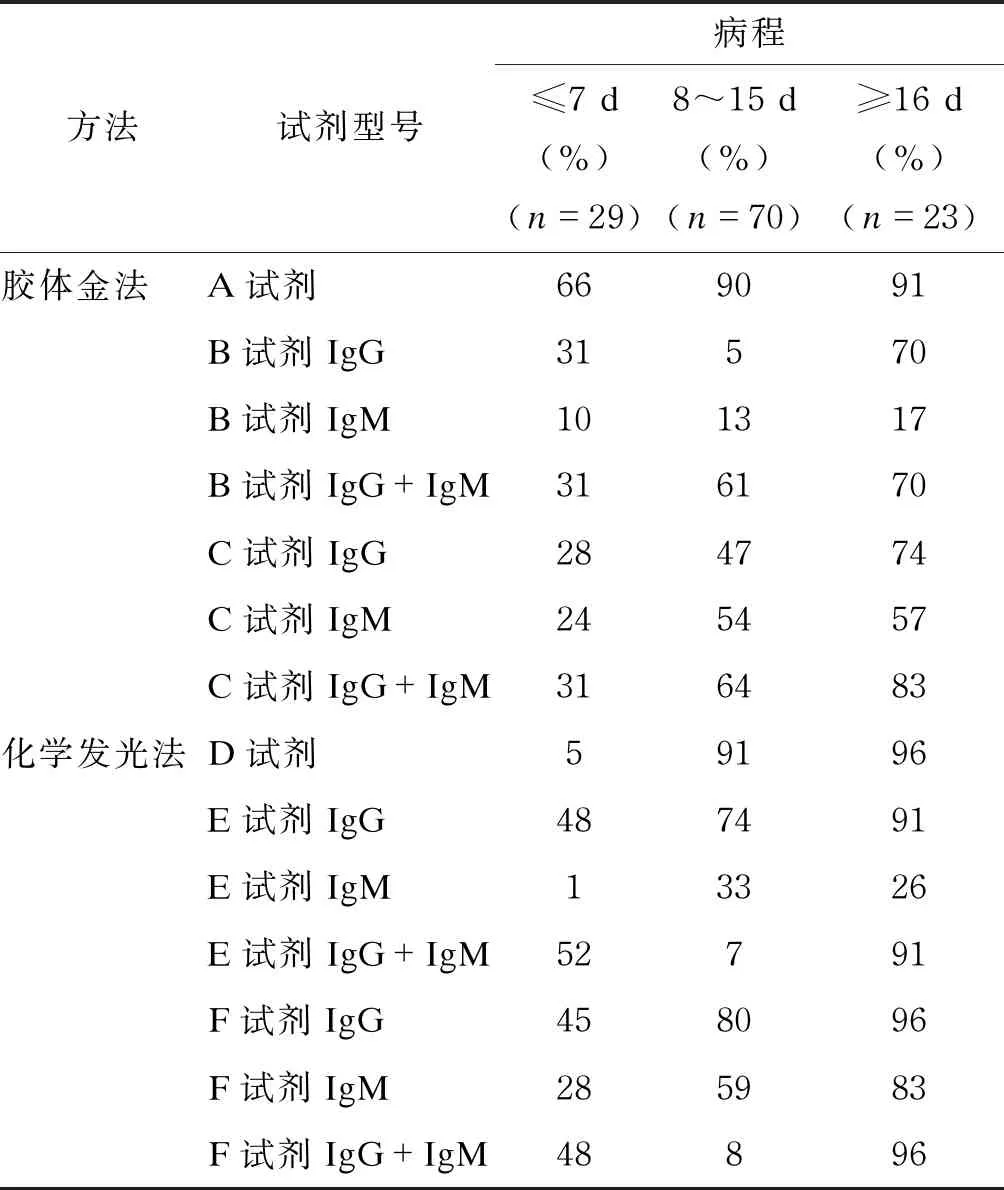
表3 各试剂在各病程标本检测中的敏感性比较(n=122)
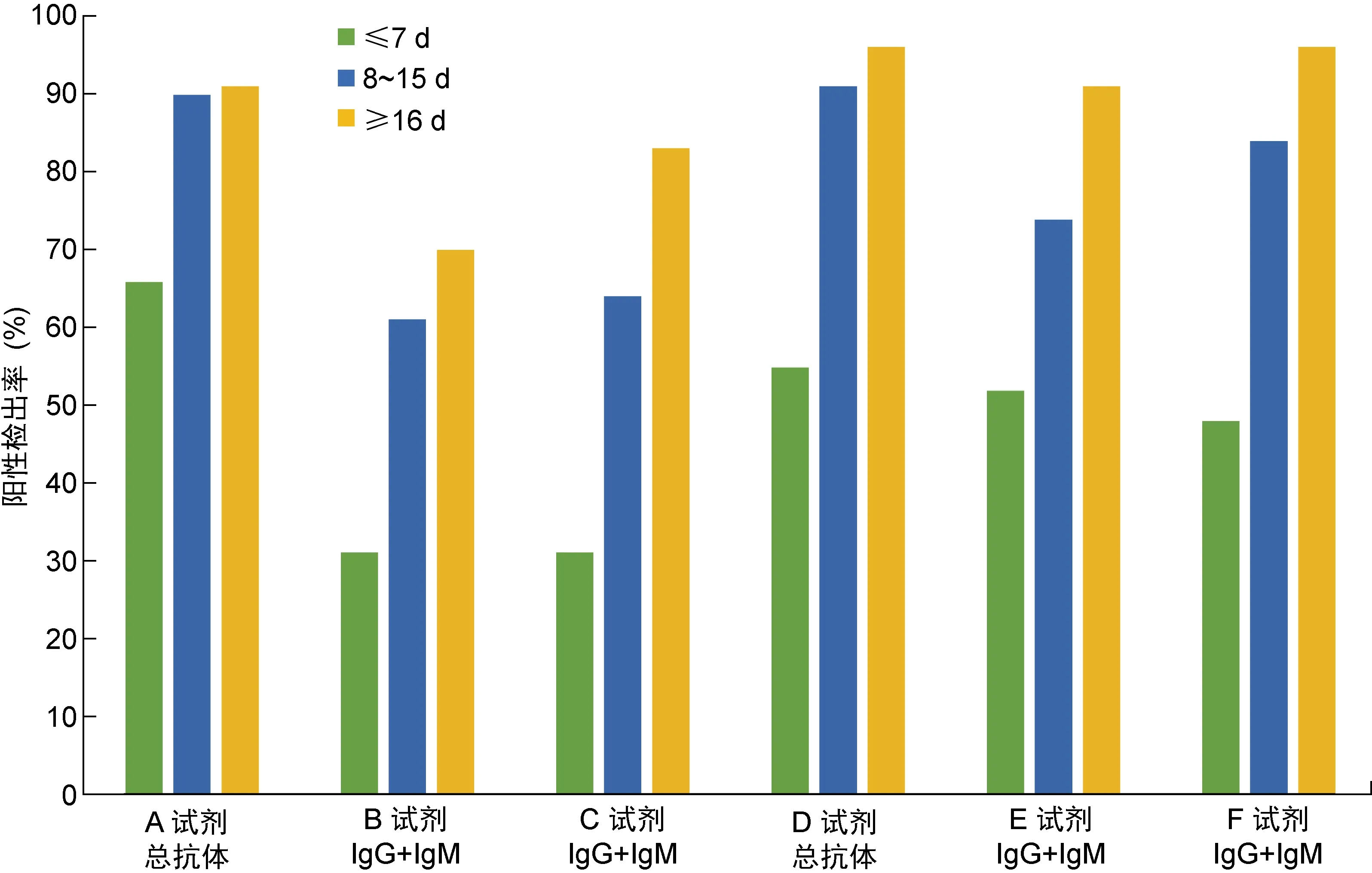
注:根据核酸确诊时间将患者进行分组:≤7 d, 8~15 d, ≥16 d。
注:根据核酸确诊时间将患者进行分组:≤7 d, 8~15 d, ≥16 d。
2.4 各试剂间检测结果符合率
尽管一些试剂的临床灵敏度表现相近,但对于病例组中的单个样本,各试剂的检测结果并不一定相同,所有试剂检测结果一致的样本仅占55.7%(68/122)。此外,有14例样本所有试剂均未检出阳性。
分析病例组样本所有试剂检测的结果,并对其符合率进行统计,具体结果如表4所示。其中,D试剂与A试剂、D试剂与F试剂的符合率最高,分别为93.4%和91.0%。CLIA试剂之间的符合率均达到85%以上,胶体金试剂之间的符合率平均值为77%,比CLIA试剂略低。
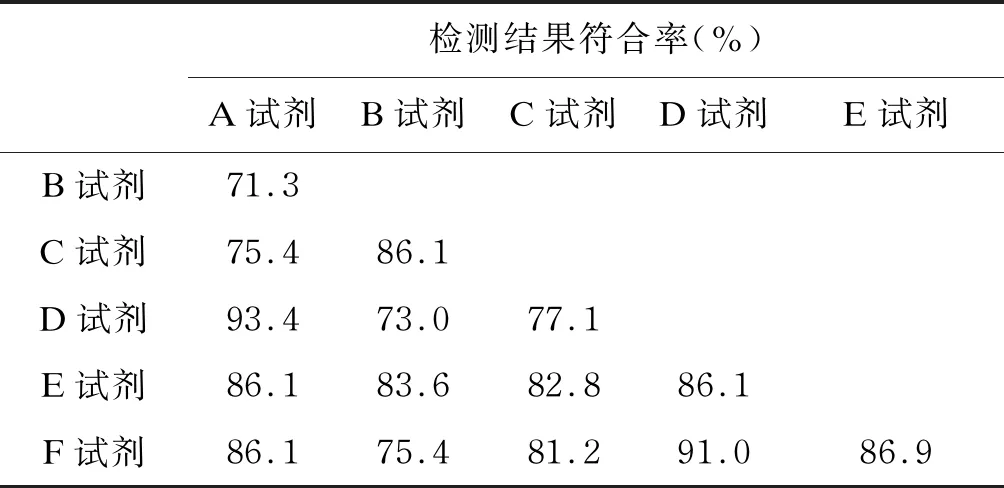
表4 各试剂对病例组检测结果的符合率
3 讨论
中华人民共和国国家卫生健康委员会在2020年3月3日印发的《新型冠状病毒肺炎诊疗方案(试行第七版)》中,首次将血清抗体检测阳性作为SARS-CoV-2感染的临床特点(实验室检查)和诊断标准[8]。目前国内已有多家诊断试剂公司基于免疫学检测紧急开发出SARS-CoV-2抗体检测试剂。因此,有必要对抗体检测试剂的性能进行充分评估,从而为血清学检测在临床诊断、病例追踪和流行病学调查中发挥辅助作用提供数据支持。本研究选取A试剂、B试剂、C试剂(这3个试剂为胶体金法)和D试剂、E试剂、F试剂(此3个试剂为CLIA)6个品牌的检测试剂,主要对其临床灵敏度、临床特异性等指标进行评估。胶体金免疫技术具有实用性强、操作简便快捷等特点,可用于基层医疗机构和现场检测;CLIA具有线性宽、灵敏度高、速度快等特点,可实现自动化的批量检测[9]。
通常情况下,病毒进入人体后,机体免疫系统会产生相应的特异性抗体进行防御。IgM在病毒感染早期首先出现,持续时间较短,因此可作为急性感染的标志。相反,IgG出现时间晚于IgM,但持续时间长,感染清除后仍可维持在较高水平,IgG阳性代表机体处于感染恢复期或既往感染。有研究结果显示,在SARS-CoV-2感染后的最初2周内,血清学转换率和抗体水平快速增长,累积阳转率在感染后11 d可达50%,感染后39 d可达100%[10]。本文研究结果显示,IgG和IgM的检出率均随时间而上升,在核酸检测确诊7 d内,IgM的灵敏度仅为10%~28%,而IgG显著高于IgM,为28%~45%。根据核酸检测时间分组,在核酸检测确诊时一些患者可能已发病一段时间,进入感染中期或恢复期,因此IgM的检出率低于IgG;亦有文献报道,有22%核酸检测确诊阳性患者IgM为阴性[11]。当核酸检测确诊时间>16 d,IgG灵敏度最高可达96%,此时IgM并未消失,阳性检出率最高可至83%。因此,在临床应用中推荐使用IgG和IgM联合测试,有助于提高检测的灵敏度。
对照组样本检测中,各品牌试剂盒临床特异性为91.1%~100%。其中,D试剂的临床特异性为98.4%,略低于其说明书的100%临床特异性;E试剂IgG和IgM抗体检测试剂的临床特异性分别为92.7%和98.4%,与其他文献报道的92.41%和96.20%相近[12]。抗体检测产生的假阳性可能与其所使用的抗原有关,也可能来自样本中的异嗜性抗体、自身抗体等物质的干扰,或检测试剂对于其他非SARS-CoV-2产生的抗体有交叉反应。方法学的差异也可能会导致假阳性,与总抗体检测使用的双抗原夹心法不同,IgG和IgM检测通常采用间接法或捕获法,试剂中使用的抗IgG/IgM二抗与待测抗体的结合为非特异性反应,因此更容易导致假阳性产生。在病例组样本的检测中,试剂间表现差异较大,临床灵敏度为13.1%~85.2%,样本用量、方法学和原料的差异可能是导致灵敏度差异的原因。D试剂总抗体检测采用双抗原夹心法,样本无需稀释,因此灵敏度更高;其他试剂盒均采用间接法或捕获法检测IgG/IgM抗体,样本需要稀释使用。此外,CLIA试剂在方法学上占有一定的优势,整体阳性检出率相较胶体金法更高,CLIA是以磁微粒为固相载体的液相反应,反应面积更大、反应更为充分,可更高效地捕获待测抗体,因此灵敏度更高。病例组中有14例样本在所有试剂检测中均未获得阳性结果,这可能是由病毒感染时间较短,患者体内还未产生抗体或抗体滴度较低造成的;也可能是由于年龄、药物、免疫抑制等原因,患者的免疫系统无法对病毒感染产生应答,这种情况在其他文献中也有报道[13]。
对于单个SARS-CoV-2确诊样本来说,不同品牌试剂间可能会产生不同的检测结果。与SARS-CoV抗体检测试剂类似,SARS-CoV-2抗体检测试剂通常使用刺突蛋白(spike protein,S蛋白,主要暴露在病毒表面)和核衣壳蛋白(nucleocapsid,N蛋白,在病毒感染过程中大量表达)作为特异性抗原[14-15]。此外,包膜蛋白(envelope protein,E蛋白)和位于S蛋白S1亚基的受体结合位点(receptor binding sites, RBSs)也用于SARS-CoV-2抗体检测[14-15]。D试剂总抗体检测使用RBD蛋白(S蛋白的受体结合位点)[16],B试剂IgG和IgM检测使用N、S蛋白[17],C试剂IgG和IgM检测使用N蛋白[18],E试剂抗体检测使用N蛋白和E蛋白[11]。有文献统计,使用S蛋白的检测试剂灵敏度高于N蛋白,且使用S蛋白的检测试剂灵敏度最高可达93.5%,而单独使用N蛋白的检测试剂灵敏度最高仅为80.8%[18]。本文的研究结果也显示,使用RBD蛋白的D试剂阳性检出率略高于使用N、E蛋白的E试剂,这可能是由于人体对于S蛋白有更强的敏感性和更早的免疫应答。
SARS-CoV-2核酸检测具有局限性,血清学检测可作为一种有效的检测方法用来辅助诊断,也可作为筛查和流行病学调查的手段。不同品牌试剂的性能表现有差异,应根据使用场景和临床需求选择合适的试剂盒。
