沉默调节蛋白4在胃癌组织中的表达及其预后价值
2021-03-28梅佳李军
梅佳 李军
作者单位:430014武汉 华中科技大学同济医学院附属武汉中心医院肿瘤科
我国胃癌的发病例数和死亡例数约占全世界的50%,疾病负担较严重[1]。而目前胃癌的早诊率依然较低,大部分患者确诊时已处于进展期。手术、放疗、化疗、分子靶向及免疫治疗等虽然在一定程度上改善了胃癌的治疗效果[2-3],但预后仍不理想[4]。其中复发转移是导致胃癌患者死亡的首要原因[5]。而胃癌的发生、进展和转移是一个多基因、多条信号通路参与的复杂过程,具体作用机制仍不明确[3]。因此进一步探究胃癌发生发展过程中涉及的基因表达改变,有望找到新的治疗靶点。沉默调节蛋白(sirtuin,SIRT)是一类烟酰胺腺嘌呤二核苷酸(NAD+)依赖的去乙酰化酶家族,由SIRT1~7等7个成员组成,其异常表达与人类多种疾病的发生发展密切相关[6]。其中SIRT4是去乙酰化酶家族中特征最不明显的成员之一,既往研究发现其在乳腺癌、食管癌、结直肠癌和膀胱癌等多种实体恶性肿瘤中表达下调,且扮演抑癌基因的角色[7]。但SIRT4在胃癌中的作用尚未明确。本研究检测117例胃癌组织中SIRT4的表达并分析其与患者临床病理特征及预后的相关性,以期阐明SIRT4在胃癌中的作用及其作为治疗靶点提供依据。
1 资料与方法
1.1 临床资料
回顾性收集2013年10月—2014年10月于武汉市中心医院接受胃癌根治术治疗的117例胃癌患者的癌组织及其癌旁正常组织(距癌组织边缘5 cm以上)。入组标准:⑴经组织病理学确诊为胃腺癌;⑵术前均未接受抗肿瘤治疗;⑶具有完整的临床病理资料和5年随访信息。排除标准:⑴术前已转移、接受姑息性切除的患者;⑵合并其他恶性肿瘤既往史者。纳入患者的平均年龄为(63.7±9.0)岁;男性68例,女性49例。本研究经武汉市中心医院医学伦理委员会批准,患者知情同意。
1.2 免疫组化检测胃癌组织中SIRT4蛋白的表达
取组织石蜡切片置于恒温箱中烘烤脱蜡,再置于二甲苯中脱蜡2次,酒精梯度水化后,3% H2O2去离子水(无色液体)孵育10~30 min,以灭活内源性过氧化物酶活性。山羊血清封闭15~30 min后,加入SIRT4一抗(1∶200稀释,美国Abcam公司),4℃孵育过夜;次日滴加标记有HRP的二抗(山羊抗兔二抗,武汉赛维尔生物科技有限公司),室温孵育30 min;显色剂(DAB)显色,显微镜下控制反应时间;苏木素复染,逐级脱水、透明、中性树胶封片染色。在奥林巴斯光学显微镜下进行阅片和结果判定。
1.3 免疫组化染色结果判定
免疫组化染色结果判定根据染色强度及阳性细胞百分率进行。染色强度:0分(阴性),1分(弱阳性,淡黄色),2分(中等强度,黄色)和3分(强阳性,棕黄色或褐色);阳性细胞百分率:0分(≤5%),1分(6%~25%),2分(26%~50%),3分(51%~75%),4分(≥76%)。两项评分的乘积为最终评分,总分≤3分定义为低表达,>3分定义为高表达。
1.4 资料收集及随访
收集患者性别、年龄、肿瘤位置、肿瘤大小、分化程度、浸润深度、淋巴结转移状况、淋巴脉管浸润状况、神经侵犯状况、术前癌胚抗原(carcinoembryonic antigen,CEA)水平及TNM分期等临床资料,其中TNM分期采用国际抗癌协会(Union for International Cancer Control,UICC)第7版肿瘤分期系统。采用电话或门诊复诊随访,随访截止时间为2019年9月30日,记录患者的总生存期(overall survival,OS)。OS定义为确诊之日至死亡或末次随访的时间。
1.5 统计学方法
采用SPSS 22.0软件进行数据分析。采用配对样本t检验分析SIRT4在胃癌组织及癌旁组织中的表达水平差异;采用χ2检验分析胃癌组织中SIRT4蛋白表达水平与患者临床病理特征的关系;采用Kaplan-Meier法计算总生存率并绘制生存曲线,组间差异比较采用Log-rank检验;采用单因素Cox回归分析影响患者OS的相关因素,将差异有统计学意义的因素纳入多因素Cox比例风险模型。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 SIRT4蛋白在胃癌组织及癌旁组织中的表达
免疫组化检测结果显示,SIRT4蛋白表达主要定位于细胞质,在胃癌组织和癌旁组织中均有表达,且在癌组织中的表达低于癌旁组织[(2.138±1.306)分vs(9.582±3.243)分,t=19.078,P<0.001)],见图 1。
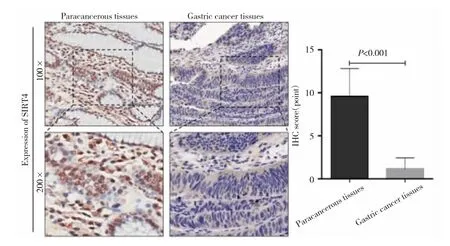
图1 SIRT4蛋白在胃癌组织及癌旁组织中的表达Fig.1 The expression of SIRT4 in gastric cancer and paracancerous tissues
2.2 SIRT4蛋白表达水平与胃癌患者临床病理特征的关系
胃癌组织中SIRT4低表达率为62.39%(73/117),SIRT4蛋白表达水平与肿瘤分化程度、浸润深度、淋巴结转移、淋巴脉管浸润、神经侵犯及TNM分期有关(均 P<0.05),见表 1。

表1 SIRT4蛋白表达水平与胃癌患者临床病理特征的关系(n)Tab.1 Relationships between SIRT4 protein expression and clinicopathological characteristics of gastric cancer patients(n)
2.3 SIRT4表达水平与胃癌患者OS的关系
本组中位随访时间为58.2个月,随访期间,死亡60例,失访11例。Kaplan-Meier生存分析及Log-rank检验结果显示,SIRT4低表达组1年、3年、5年的总生存率分别为100.0%、61.6%、37.0%,SIRT4高表达组分别为100.0%、86.4%、68.2%,SIRT4低表达组的总生存率低于 SIRT4高表达组(χ2=11.244,P=0.001),见图2。

图2 SIRT4高表达和低表达胃癌患者的生存曲线Fig.2 The survival curves of gastric cancer patients with high and low expression of SIRT4
2.4 影响胃癌患者OS的单因素及多因素分析
单因素分析结果显示,肿瘤分化程度、浸润深度、淋巴结转移、淋巴脉管浸润、神经侵犯、TNM分期及SIRT4表达水平与胃癌患者OS有关(均P<0.05);进一步多因素Cox回归分析显示,SIRT4蛋白低表达是影响患者OS的独立危险因素(HR=2.241,95%CI:1.252~4.165,P=0.021),见表 2。
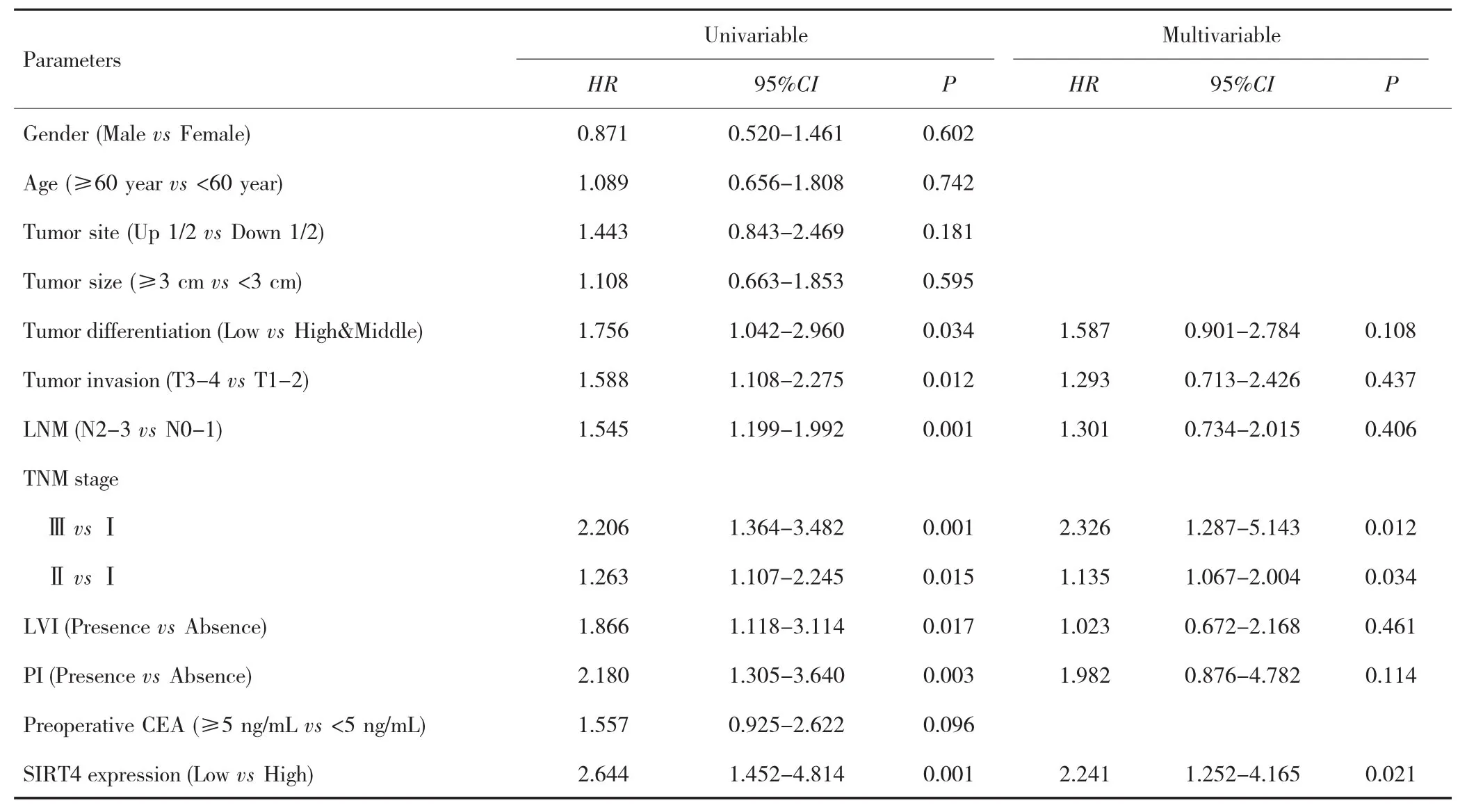
表2 影响胃癌患者OS的单因素和多因素分析Tab.2 Univariable and multivariable analysis of OS in patients with gastric cancer
3 讨论
SIRT4是位于线粒体上的NAD+依赖ADP核糖转移酶,通过抑制谷氨酰胺脱氢酶活性可抑制细胞内的谷氨酰胺代谢途径,从而发挥抑癌基因功能,广泛参与多种恶性肿瘤进程[7]。既往研究表明,SIRT4在多种恶性肿瘤中表达下调,且与不良预后有关[7-9]。MIYO等[8]研究发现,SIRT4在结直肠癌组织中表达降低,且其表达水平与肿瘤浸润深度、淋巴结转移、淋巴脉管浸润、远处转移及TNM分期呈显著负相关,生存分析显示低表达患者的无复发生存时间显著缩短。也有研究报道SIRT4表达水平与食管癌患者临床病理特征无关,但多因素分析显示SIRT4低表达是影响预后的独立危险因素[9]。GONG 等[10]通过分析 TCGA数据库发现SIRT4在非小细胞肺癌中高表达,且SIRT4高表达预示生存期更长。本研究发现SIRT4在胃癌组织中呈低表达,且SIRT4低表达与肿瘤分化程度、浸润深度、淋巴结转移、淋巴脉管浸润、神经侵犯及TNM分期等不良临床病理特征相关。进一步预后分析发现,SIRT4低表达患者的总生存期明显缩短,且是影响预后的独立危险因素,提示SIRT4在胃癌的发生发展中可能扮演抑癌基因角色。目前有研究表明,SIRT4可能通过影响肿瘤细胞的代谢和生物学活动参与肿瘤进展过程,从而影响患者预后[11-14],但SIRT4抑制胃癌发生发展的分子机制仍尚未知,需进一步探索。
本研究结果证实,SIRT4蛋白在胃癌组织中低表达,且其低表达与患者的恶性临床病理特征及不良预后密切相关,也是影响患者总生存期的独立危险因素。因此,SIRT4有望成为胃癌患者预后评估标志物及潜在的治疗靶点。但本研究为单中心回顾性研究,且样本量有限,因此有关结论仍需进一步研究证实。
