槲皮素调控Wnt信号通路对阿尔茨海默病模型小鼠海马神经的影响
2021-03-27陈方方白杨
陈方方 白杨
阿尔茨海默病(AD)是最常见的痴呆类型,是一种进行性、不可逆的神经退行性疾病,主要表现为记忆、思维、定向、理解、学习、语言和判断等高级功能的衰退[1-2]。随着人口老龄化加剧,预计到2050年全世界痴呆人口数量将达到1.31亿[3]。该病的特征性病理改变包括β淀粉样蛋白(Aβ)沉积形成的细胞外老年斑、Tau蛋白过度磷酸化形成的神经细胞内神经原纤维缠结、胆碱能神经减少及大脑皮层突触标志丢失等[4-5]。一项基础研究结果显示,6~8月龄的AD小鼠前额叶皮层Aβ的聚集与认知功能损害密切相关,额叶皮层Aβ的聚集越广泛则认知功能损害越严重[6]。大部分AD患者海马组织萎缩严重,且发病过程中海马神经原纤维缠结数量与痴呆程度具有相关性。槲皮素是一种天然黄酮类化合物,可从植物的花、叶、果实中提取,分子式为C15H10O7,分子量为302.24[7]。槲皮素具有抗氧化、抗病毒、抗癌、减轻肺脏炎症及保护肝细胞、肾脏、心脏等作用。目前,槲皮素在临床上作为一种新型的治疗氧化应激性神经退行性疾病的药物,效果较为显著[8]。在AD治疗中,槲皮素可以通过清除多余活性氧,维持线粒体功能正常运行,发挥保护神经元的作用;槲皮素还可抑制炎症反应和细胞凋亡,从而减轻AD后继发性神经元损伤。本文通过探讨槲皮素对AD模型小鼠海马神经的影响及其作用机制,希望为AD治疗药物研发提供新的方向。
材料与方法
1.材料:(1)实验动物:SPF级6周龄小鼠60只(雌雄各30只),体质量(20.0±3.0)g,由北京维通利华实验动物技术有限公司提供,动物许可证号为SCXK(京)2017-0022,于SPF级环境饲养,饲养环境温度为15~18 ℃,相对湿度为35%~40%。(2)药物与试剂:槲皮素(纯度>98%,批号:2016011204)购自美国Sigma公司;Aβ25-35购自美国Biossource公司;轴蛋白(Axin)抗体(货号:sc-293190,批号:20181210)、β连环蛋白(β-catenin)抗体(货号:sc-133240,批号:20181210)、Wnt抗体(货号:sc-373780,批号:20181209)购自美国Santa Cruz公司;磷酸盐缓冲液(PBS)购自天津科密欧公司;丝氨酸苏氨酸类激酶(GSK-3β)免疫试剂盒(货号:48T/96T;批号20181111-T01)购自上海瓦兰生物科技有限公司;蛋白磷酸酶2A(PP2A)免疫试剂盒(货号:CD-1058008GM)购自武汉纯度生物科技有限公司;原位末端转移酶标记技术(TUNEL)凋亡检测试剂盒(货号:AAT-22844,批号:20181021)购自艾美捷科技有限公司。(3)仪器:小鼠脑立体定位仪购自国营西北光学仪器厂;酶标检测仪购自北京宾达英创业科技有限公司;电子天平购自沈阳德克天平仪器有限公司;超薄切片机购自北京迪索仪器有限公司;显微镜购自日本Olympus公司;TDL-5型台式离心机购自上海安亭科学仪器厂;光学显微镜购自东莞市同创仪器有限公司;蛋白电泳及转膜仪购自美国Bio-Rad公司。本实验经过新疆医科大学实验动物伦理委员会审批通过。
2.方法
(1)分组及建立模型:随机将小鼠分为假手术组、模型组及实验组,每组20只。参考文献[9]使用Aβ25-35建立AD小鼠模型并判定建模是否成功。具体方法如下:使用300 mg/kg 10%水合氯醛腹腔注射麻醉模型组及实验组小鼠,剥开皮下筋膜暴露顶骨,并消毒手术区小鼠皮肤,在两侧冠状缝后钻出小孔,取出小鼠大脑碎骨屑,保持硬脑膜的完整。按小鼠脑立体定位图谱选择小鼠海马区域进行注射。分别在前囱后3.5 mm、中线外侧2 mm、硬脑膜下2.7 mm注射浓度为5 μg/μl的聚集肽的Aβ25-35。5 min内注射完毕,并留针5 min再拔出针头,防止药物溢出,将小鼠伤口缝合,3 d内每天肌注青霉素5万单位防止感染。假手术组手术方法同前,颅内不注射药物,改为注射等量生理盐水。完成造模后小鼠出现无法行走或行走时原地打转等现象表明造模成功。造模过程中若有小鼠死亡,及时补足并继续实验。
(2)干预方式:将纯度为98%的槲皮素与超纯水配成饱和溶液,按照50 mg/kg的剂量对实验组小鼠进行灌胃,假手术组和模型组小鼠灌胃等体积生理盐水,每天1次,持续14 d。
(3)Y-迷宫检测小鼠学习记忆水平[10]:完成药物干预后12 h,开始使用Y-迷宫中控制仪释放电击电压为70 V、延迟2 s的电刺激来电击小鼠足部。控制仪中的反射箱顶端有3个信号灯,根据动物所在位置随机改变安全信号灯方位。此时有灯光信号的信号灯不通电,另外两个通电。小鼠受电击会从开始位置逃至有灯光信号的安全区,这种逃离为正确反应,否则为错误反应。手术后给药14 d后开始实验,每次实验后休息1 min,每天实验20次,共训练5 d,记录每天小鼠逃离的错误次数并计算平均值。错误次数越少说明小鼠的海马组织受损较轻,记忆能力较好。
(4)小鼠灌注固定:Y-迷宫检测实验结束后,麻醉小鼠,使用剪刀剪开胸腔,暴露心脏。用镊子夹住小鼠心脏,使用灌注针插入小鼠的心脏灌入约50 ml生理盐水后,观察从右心房流出的液体颜色,当变成无色透明时,说明血液已经冲洗干净,使用预冷过的4%多聚甲醛的吊瓶继续输液,待小鼠抽搐停止后继续灌注5 min固定小鼠内脏,当小鼠四肢僵硬时表明灌注完成。
(5)海马组织凋亡情况检测[11]:分别于药物干预后12 h、14 d,各组取6只小鼠断头,分离出海马组织并固定于4%多聚甲醛溶液中,进行常规石蜡包埋、切片,然后按照TUNEL说明书步骤进行操作,在400倍显微镜下统计每张海马组织切片5个不重叠视野,记录凋亡阳性细胞数目和细胞总数,细胞核呈现出棕褐色或棕黄色颗粒则是凋亡阳性细胞,凋亡率(%)=(凋亡阳性细胞数目/细胞总数)×100%。
(6)免疫组化法检测小鼠海马组织的Axin和β-catenin表达:处死小鼠后,立即取小鼠海马组织,常规石蜡包埋、切片、二甲苯脱蜡,蒸馏水冲洗,使用3%的H2O2和0.01 mol/L PBS冲洗,使用微波修复抗原,再次使用3%的H2O2溶液孵育10 min,PBS冲洗后微波修复抗原,使用4%牛血清蛋白孵育15 min,PBS冲洗后使用兔抗Axin抗体一抗(1∶500)孵育120 min,使用0.01 mol/L PBS冲洗并加入羊抗兔IgG(1∶300)孵育60 min,PBS冲洗,加入链霉亲和素和生物素标记的过氧化物酶复合物(SABC,1∶300)孵育60 min,3,3’-二氨基联苯胺(DAB)显色,苏木素复染,常规脱水、透明、封片,并在400倍的显微镜下观察Axin和β-catenin的表达。β-catenin免疫组化方法同上,采用一抗为兔抗β-catenin(1∶1 000),二抗为羊抗兔IgG(1∶500)。观察结果中棕色为阳性,阳性率(%)=(阳性细胞数目/细胞总数)×100%。
(7)蛋白质免疫印迹法(Western blot)检测相关蛋白表达:处死小鼠后立即取小鼠海马组织,使用剪刀剪碎后,提取总蛋白,经10%SDS-聚丙烯酰胺凝胶电泳、蛋白转移至聚偏二氟乙烯膜(PVDF)膜,置于5%脱脂奶粉室温封闭2 h后加入Axin、β-catenin和Wnt 1一抗(1∶500)4 ℃孵育过夜,TBST漂洗40 min,加入辣根过氧化物酶(HRP)标记二抗(1∶500)孵育2 h,TBST洗净,以β-actin为内参蛋白,采用显色液显色后行吸光度分析,计算各蛋白相对表达量。
(8)酶联免疫吸附试验(ELISA)检测GSK-3β和PP2A表达:处死小鼠后立即腹腔取血0.1 ml,使用GSK-3β试剂盒和PP2A试剂盒检测小鼠全血GSK-3β和PP2A含量。
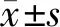
结 果
1.3组小鼠Y-迷宫检测结果比较:假手术组小鼠和实验组小鼠错误次数随着训练天数的增加显著降低(P<0.01),模型组小鼠错误次数随着训练天数的增加有一定程度降低但差异无统计学意义(P>0.05)。与假手术组比较,模型组小鼠的错误次数从训练的第1天开始明显升高(P<0.01);而相较于模型组小鼠,实验组小鼠的错误次数从训练的第2天开始明显降低(P<0.01)。见表1。
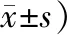
表1 3组小鼠Y-迷宫错误次数比较(n=20,次,
2.3组小鼠海马组织凋亡率比较:药物干预12 h和14 d时,模型组小鼠海马组织凋亡率分别为(16.58±2.68)%和(38.95±3.87)%,明显高于假手术组[分别为(3.54±0.98)%和(3.97±0.91)%,P<0.01];相较于模型组,实验组药物干预12 h和14 d海马组织凋亡率[(6.87±0.84)%、(8.98±0.93)%]明显降低(P<0.01)。见图1。
3.3组小鼠海马组织Axin表达情况比较:假手术组小鼠海马组织Axin蛋白阳性率为(8.44±1.23)%,细胞呈规律排列,细胞有较清晰的细胞核、细胞质,细胞整体呈淡蓝色;模型组小鼠的海马组织中Axin蛋白阳性率为(38.97±3.25)%,明显高于假手术组(P<0.01),细胞排列不规则,细胞无法看到清晰的细胞核和细胞质,Axin蛋白在细胞核和细胞质中均有显著表达。实验组中Axin蛋白阳性率为(12.11±2.03)%,明显低于模型组(P<0.01),细胞核、细胞质中阳性Axin蛋白表达不显著,与假手术组结果相近。见图2。
4.3组小鼠海马组织β-catenin表达情况比较:假手术组和实验组小鼠海马组织β-catenin阳性率分为(38.69±3.41)%、(28.97±3.28)%,模型组海马组织β-catenin阳性率为(7.86±1.32)%,明显低于假手术组(P<0.01),实验组β-catenin阳性率显著高于模型组(P<0.01)。见图3。
5.3组小鼠海马组织Axin、β-catenin和Wnt 1蛋白表达量比较:模型组小鼠的Axin蛋白表达明显高于假手术组,β-catenin和Wnt 1蛋白表达明显低于假手术组,差异有统计学意义(P<0.01)。实验组小鼠Axin蛋白表达明显低于模型组,β-catenin和Wnt 1蛋白表达明显高于模型组,差异有统计学意义(P<0.01)。实验组小鼠Axin、β-catenin和Wnt 1蛋白与假手术组比较差异无统计学意义(P>0.05)。见图4、表2。
6.3组小鼠GSK-3β和PP2A表达比较:模型组小鼠的GSK-3β水平明显高于假手术组,PP2A明显低于假手术组,差异均有统计学意义(P<0.01);实验组小鼠GSK-3β水平明显低于模型组,PP2A明显高于模型组,差异均有统计学意义(P<0.01)。见表3。

图1 3组小鼠海马组织凋亡情况(A:假手术组药物干预12 h后;B:模型组药物干预12 h后;C:实验组药物干预12 h后;D:假手术组药物干预14 d后;E:模型组药物干预14 d后;F:实验组药物干预14 d后;TUNEL法,×400)
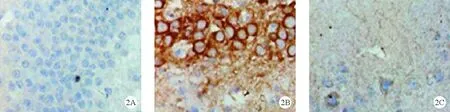
图2 3组小鼠海马组织Axin表达情况(A:假手术组;B:模型组;C:实验组;免疫组化法,×400)
讨 论
有研究表明,抑制AD患者的海马组织凋亡可有效缓解其病情[12]。本研究通过检测小鼠海马组织凋亡情况发现,相较于模型组,实验组海马组织凋亡率明显降低,说明槲皮素可减轻AD小鼠海马组织凋亡。
Axin是一种体轴发育抑制因子,在Wnt信号转导途径中起关键作用[13]。Axin主要通过Wnt信号转导途

图4 3组小鼠海马组织Axin、β-catenin、Wnt 1蛋白表达情况(A:假手术组;B:模型组;C:实验组)

表2 3组小鼠海马组织Axin、β-catenin、Wnt 1蛋白水平比较(n=6)

表3 3组小鼠GSK-3β和PP2A含量比较(n=6)
径调控体轴发育、细胞死亡、神经元分化等过程[14],与APC、GSK-3β、β-catenin结合形成复合体促使β-catenin降解并降低GSK-3β对tau蛋白的磷酸化[15]。槲皮素可通过结合Axin以提高PP2A活性,阻止AD中神经纤维缠结形成。Axin是β-catenin降解循环中重要的蛋白,不仅可与β-catenin结合,还可调节GSK-3β活性。Axin可以通过结合位点促进GSK-3β催化β-catenin,若Axin过多会导致Wnt通路异常活化损伤细胞[16]。正常胞质中存在少量β-catenin,如β-catenin含量过多会与APC、Axin、GSK-3β形成复合物,促进β-catenin磷酸化,磷酸化β-catenin会被泛素蛋白水解酶识别并降解。本研究结果显示,与模型组比较,使用槲皮素处理实验组小鼠后,其Axin含量显著降低,β-catenin显著升高,推测可能是通过影响海马组织Wnt信号通路变化,实现对AD小鼠神经损伤的改善作用。
GSK-3β是在蛋白合成、细胞增殖、细胞分化等方面发挥重要作用的丝氨酸苏氨酸类激酶[17]。GSK-3β与神经退行性病变密切相关,GSK-3β可使微管相关蛋白Tau蛋白磷酸化,Tau磷酸化引起微管蛋白不稳定,并聚集成神经纤维缠结,使神经元的可塑性发生改变,诱导神经元退行性变化,导致海马组织受损,造成AD病情加重。PP2A可使蛋白质脱磷酸,具有调节细胞凋亡、增生、分化的作用。PP2A会降低海马组织中Tau蛋白活性,使β-catenin过度磷酸化并降低AD患者海马组织中磷酸酶PP1和PP2水平,最终导致AD患者病情进一步恶化[18]。AD细胞模型人神经母细胞瘤细胞株(SK-N-SH细胞)磷酸酶PP2A和PP2B的活性显著降低,而蛋白激酶的活性则显著升高[19]。本实验结果显示,使用槲皮素调控Wnt信号通路后,AD小鼠大脑内的PP2A活性显著增加,GSK-3β活性显著降低,说明槲皮素可以通过调控Wnt信号通路使小鼠海马组织的酶活性和磷酸化趋于正常,有效缓解AD症状。
综上所述,槲皮素可以通过调控Wnt信号通路发挥缓解和治疗AD的作用,其作用机制可能与降低小鼠海马组织Axin表达、GSK-3β活性,上调β-catenin表达、升高PP2A活性有关。但因槲皮素调控Wnt信号通路涉及相关蛋白和酶种类较多,在后续的实验中可以研究其他蛋白和酶在槲皮素调控Wnt信号通路中的作用,进一步探讨槲皮素缓解AD的机制。
