心脏移植与肺移植后肾损伤
2021-03-27程虹卞维静
程虹 卞维静
肾损伤是胸部器官移植(心脏移植与肺移植)后的常见并发症,无论是在移植后的近期还是远期,均会引起其它并发症和死亡率的增加。既往研究发现,移植前心肺功能可以预测移植后急性肾损伤(AKI)的发生,因此,保障肺通气和优化右心功能是减少心脏或肺移植后AKI的关键。除此之外,移植术中及术后早期存在手术创伤及多种其他AKI危险因素,移植后钙调磷酸酶抑制剂(CNIs)的长期使用也使患者面临慢性肾损伤的风险,这些都是临床医生需要关注和重视的问题。
一、心脏移植后AKI
1.流行病学
心脏移植后AKI较常见,由于诊断标准不同,AKI的发生率为34.7%~76.0%[1]。García-Gigorro等[2]研究报道,310例接受心脏移植的患者在术后第1周有125例(40.3%)发生AKI,其中73例(23.5%)为全球肾脏病预后组织(KDIGO)-AKI 1期,18例(5.8%)为KDIGO-AKI 2期,34例(11.0%)为KDIGO-AKI 3期;有32例(10.3%)患者接受肾脏替代治疗(RRT);患者的总住院死亡率为8.7%(27/310)。按严重程度分层发现,未发生AKI、KDIGO-AKI 1期和KDIGO-AKI 2~3期患者死亡率分别为3.8%(7/185)、4.1%(3/73)及32.7%(17/52);而在术后的第1周,需要RRT的AKI患者住院死亡率为46.9%(15/32),不需要RRT的AKI患者住院死亡率为5.4%(5/93)。在91.3%(283/310)的出院患者中,平均随访时间为6.7年,最长17年,其中有78例死亡,AKI 2~3期患者的1年、5年和10年的死亡率分别为14.8%、30.2%和36.5%,与无AKI患者相比呈现非显著的长期生存率下降趋势。而需要RRT的AKI患者1年和10年死亡率分别为23.5%和42.6%,不需要RRT的AKI患者1年和10年的死亡率分别为7.4%和31.3%,二者相比也无显著差异。
2.危险因素
相关文献报道,在准备心脏移植的患者中,5%的肾小球滤过率(GFR)<30 ml/min,2%~3%为维持性透析治疗,20%~25%既往有糖尿病病史,40%~50%有高血压病史,这些都是术后发生AKI的危险因素[3]。移植前蛋白尿、既往AKI事件、暴露于肾毒性药物和静脉注射碘对比剂等因素也与心脏移植后AKI的发生密切相关。移植手术相关并发症的发生,包括心肺旁路的建立、缺血再灌注损伤、术后大出血、右心衰竭及早期启动CNIs的抗排异治疗等,都是心脏移植后早期发生AKI的主要危险因素[1]。见表1。
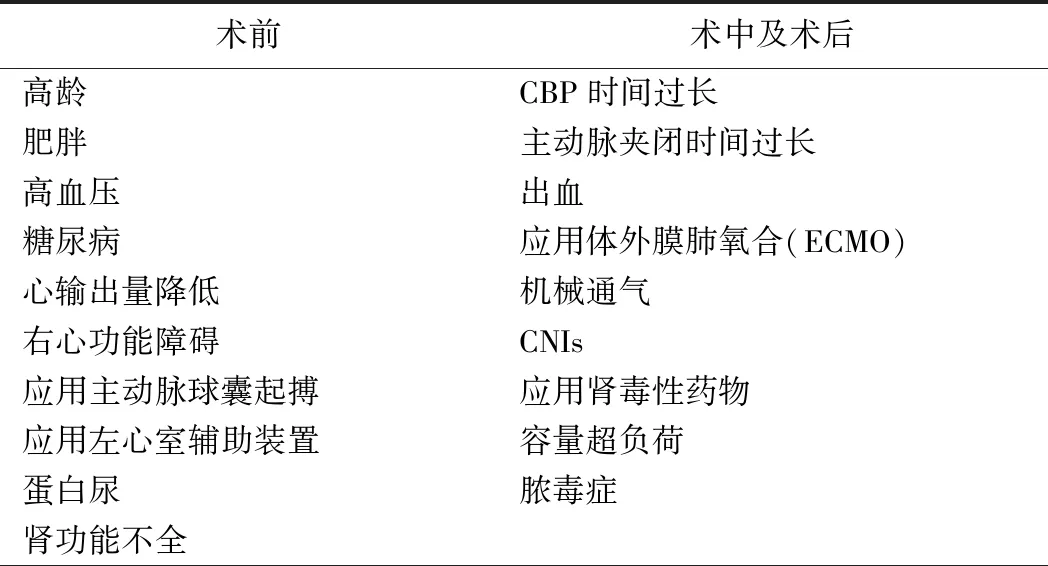
表1 心脏移植后相关肾损伤的危险因素[1]
García-Gigorro等[2]研究结果显示,心包填塞、欧洲心脏手术风险评估系统(EuroSCORE)评分增加、急性右心室衰竭(ARVF)及严重出血是心脏移植后AKI的独立危险因素。Guven等[4]研究结果发现,右房压升高,即肺动脉搏动指数[右心房压力与肺毛细血管楔压之比(PAPi)]降低是心脏移植后发生AKI的强预测因子。以上研究结果提示,反映心脏移植围术期患者的血流动力学状况的指标尤其是右心压力,对移植后AKI的影响较大。Jiang等[5]研究发现,体外循环心肺旁路(CBP)时间>265 min或尿量<1 700 ml更容易发生AKI。
3.发病机制
心脏移植患者术前发生心肾综合征(急性和慢性)的主要机制为左心室心输出量减少、右心室功能受损、中心静脉压升高和静脉淤血等血液动力学异常的综合作用导致术后AKI。术后血容量的绝对或相对不足、CNIs对肾脏血流动力学的影响、感染及失血等因素可导致急性肾小管坏死(ATN)及急性间质性肾炎(AIN)或血栓性微血管病(TMA),后者是CNIs相关AKI的常见病理改变[1]。
4.识别和诊断
(1)识别AKI的高危人群:可以根据患者移植术前和术中的相关危险因素来识别术后发生AKI的风险。在上述危险因素中,评估术前肾功能尤为重要,必要时可行肾活检,从而决定是否实施心肾联合移植[6]。
(2)诊断AKI:目前心脏移植后AKI的诊断除了2004年RIFLE[7]和2007年AKIN[8]诊断标准,大量研究是以2012年KDIGO的AKI临床实践指南中的诊断标准[9]为依据,但上述诊断标准皆以血清肌酐(SCr)的相对或绝对变化为基础,不能早期敏感地监测AKI的发生。
既往文献报道的几种生物标志物可预测AKI的发生,对AKI进行危险分层,但其特异性和适用性并未达到普遍被接受的水平。尿金属蛋白酶抑制因子2(TIMP-2)与尿胰岛素样生长因子结合蛋白7(IGFBP-7)的乘积可以提高心脏手术患者AKI的预测能力,如[TIMP-2]×[IGFBP-7]>0.3提示AKI高风险[10]。
目前环孢素和他克莫司应用后出现TMA所致AKI屡有报道。而TMA的一些非特异性临床表现,如贫血、血小板减少往往一过性出现,临床上易被忽视。如患者出现血乳酸脱氢酶升高及外周血破碎红细胞,也提示TMA的可能。同时应检查ADAMTS-13酶的活性,通常血栓性血小板减少性紫癜(TTP)患者ADAMTS-13酶的活性<10%,而在药物相关TMA的患者中其活性>10%。
5.预防和治疗
(1)改善血液动力学:若术前肾功能异常为可逆性的血液动力学异常所致,应给予相应措施,如改善心功能的药物治疗或机械循环支持,以缓解心功能及肾脏血供,可减少术后AKI的发生[11]。
(2)减少肾毒性药物的应用:①抗生素:移植后患者常因感染接受具有潜在肾毒性的抗菌药物治疗,如万古霉素、氨基糖苷类抗生素、两性霉素B等;抗病毒药物(阿昔洛韦、膦甲酸和西多福韦)所致AKI的风险也不容忽视。多项研究表明,万古霉素和哌拉西林-他唑巴坦联合用药存在AKI高风险;β-内酰胺类抗生素可引起AIN,一经发现应立即停用药物,必要时给予短程糖皮质激素治疗[12-13]。②碘对比剂:在应用碘对比剂前后充分水化预防AKI很重要,但碳酸氢钠或乙酰半胱氨酸用于预防对比剂肾病并未获益[14]。③CNIs:他克莫司和环孢素在内的CNIs可很好抑制排斥反应,但也具有肾毒性的风险,包括早期肾脏血流动力学改变所致AKI及长期服用致肾间质纤维化的风险。服药期间需要密切监测SCr变化及血药浓度。对于CNIs所致的TMA,血浆置换的治疗存在争议[15]。
(3)容量管理:对于移植患者的液体复苏不推荐应用羟乙基淀粉或胶体液。晶体液中,乳酸林格液和血浆电解质溶液有较低的AKI风险。ICU患者应避免容量超负荷,密切监测尿量[16]。
(4)RRT:①模式的选择:连续肾脏替代治疗(CRRT)和间歇性血液透析(IHD)对ICU患者预后的影响没有表现出明显的差异,可根据患者血流动力学状况进行选择。由于CRRT更容易进行容量及电解质的管理,对于术后严重的AKI患者,临床上更倾向于选择CRRT,而不是IHD。且对于使用ECMO的患者,由于其血流动力学不稳定,更适合选择CRRT。CRRT可通过使用在线血液过滤器或将标准的CRRT机器与ECMO的体外循环相连接。对于维持性腹膜透析(PD)患者,可选择自动化腹膜透析(APD)[17]。②营养管理:由于CRRT时的高分解代谢状态和氨基酸的流失,接受RRT的患者每天应该摄入25~35kcal/kg体重的热量,并补充至少1.5~1.8 g/kg的蛋白质或氨基酸。此外,还需要补充RRT过程中丢失的水溶性维生素和微量元素[18]。③药物剂量调整:在ICU很难准确估算AKI患者的GFR,一是因为重症患者肌肉含量较少,容易高估GFR;二是基于SCr的GFR推算公式应主要是针对慢性肾脏病患者,SCr处于相对稳定状态,可能不适用于AKI患者。因此,基于GFR的给药建议主要来自于稳定的CKD患者的数据研究,可能并不完全适用于AKI患者。接受CRRT患者的给药剂量可参考基于CRRT的肌酐清除率(一般为25~40 ml/min)和残余肾功能相结合;血液透析时使用高通量透析器的药物清除率比低通量透析器高25%~50%。但在临床用药管理中,尽可能根据实时监测的血药浓度进行药物剂量调整。[19]。
二、肺移植后AKI
1.流行病学
肺移植后AKI也较常见,发生率约为39%~69%,其中5%~13%的患者需要RRT[20]。术后AKI的发生与患者住院时间延长、短期和术后1年死亡率升高及CKD发生风险增加相关[21]。
2.危险因素和发病机制
肺移植后AKI的危险因素包括在移植前和移植时肺分配评分(LAS)升高、基线SCr水平升高、平均肺动脉压>35 mmHg、实施双肺移植、二次肺移植、术前使用ECMO或机械通气及CBP延长(表2)[20,22]。与心脏移植比较,肺移植患者在移植前的肾脏损害并不常见,合并严重肾功能不全(需要透析)的患者比例不足1%[23]。目前对于肺肾之间相互作用的病理生理机制尚不充分。研究表明,需要肺移植的患者术前因低氧和高碳酸血症可能会影响肾脏血流及水电解质代谢。与心脏移植一样,术后血容量的绝对或相对不足、CNIs对肾脏血流动力学的影响、感染及失血等因素将导致ATN及AIN或TMA,后者是CNIs相关AKI的常见病理改变[1]。除此之外,肺移植后原发性移植物功能障碍(PGD)的发生率可高达30%,这也与AKI的发生相关[24],且这些患者的治疗通常涉及液体限制、增加机械通气和利尿剂剂量,在此基础上更易遭受CNIs、碘对比剂和肾毒性药物的打击而出现AKI。

表2 肺移植相关肾损伤的危险因素[1]
3.诊断和防治
肺移植后AKI的诊断与上述心脏移植相关AKI的诊断方法相同。主要的原则是预防消化道出血、避免肾毒性药物、容量平衡管理和肾替代治疗,具体操作参照上述心脏移植后AKI的防治策略。
三、心脏移植和肺移植后慢性肾损伤
心脏或肺移植除了引起AKI外,在随后的几年中,慢性肾脏病(CKD)的风险也会增加,50%以上的患者术后1年会进展为CKD或终末期肾病(ESRD)。心脏移植后5年和10年需要进行长期透析或肾移植的患者比例分别为5%和10%~12%;肺移植后1年、5年和10年需长期透析患者的比例分别为3.8%、7.2%和7.9%[23,25],但这部分患者在实施肾移植后总体生存率和移植物生存率均低于单独实施肾移植,甚至二次肾移植的患者。
大量研究结果显示,高龄、女性、术前合并糖尿病、高血压、肾功能减低、术后肾衰竭、机械循环呼吸支持、巨细胞病毒(CMV)感染、贫血及CNIs使用等是心脏移植或肺移植后患者发展为CKD的危险因素[26]。其中CNIs在慢性肾功能损伤的发展中起核心作用。目前的治疗策略主要是使用最低剂量的CNIs或更换为CNIs的替代药物。随着雷帕霉素靶蛋白(mTOR,即丝氨酸-苏氨酸蛋白激酶)抑制剂(西罗莫司和依维莫司)的出现,许多研究者试图将其代替CNIs应用于心脏移植患者[27],但这些研究大多为小样本、非对照研究,还需要充分的证据支持[28]。
综上所述,心肺移植后肾损伤较为常见,且会增加患者的死亡率,围手术期存在多种AKI的危险因素导致AKI。此外,术后CNIs的使用还会对肾脏造成长期的慢性损伤。对避免移植后发生AKI及延缓CKD进展需要多学科包括移植科、肾内科、重症监护病房、传染病科、营养学科和药学科等医护之间的良好协作,密切随访,以便进行适当的ESRD前护理,并及时进行肾移植。
