结核性脑膜炎脑脊液分子检测技术概述
2021-03-25韩利军赵雪瑶
韩利军 赵雪瑶
结核性脑膜炎(tuberculous meningitis,TBM)是最常见的中枢神经系统结核病,由于无特异的临床表现及较低的实验室诊断敏感度,早期诊断TBM非常困难;而诊断不及时会延误抗结核治疗的时机,导致高病死率和高致残率[1]。因此,寻求切实有效的脑脊液检测手段,提高TBM的早期诊断率显得尤为重要。
近几年随着分子检测技术的快速发展,尤其是测序技术的问世,为TBM早期诊断带来了可能。笔者针对TBM脑脊液分子检测技术的应用现状、最新研究进展进行综述及评论,为指导结核病临床工作提供参考。
一、结核性脑膜炎脑脊液分子检测技术的应用现状
结核性脑膜炎分子检测技术是以临床标本(脑脊液)为检测对象,结核分枝杆菌特异基因为检测标志物,完成对标本中是否含有结核分枝杆菌特异基因的一系列检测过程[2]。结核分枝杆菌核酸扩增技术(nucleic acid amplification test,NAAT)问世已有30余年,通常以IS6110、MPB64、gyrB、rpoB等为靶标,通过聚合酶链反应(polymerase chain reaction,PCR)进行扩增和检测。近年来,结核分枝杆菌的分子检测技术不断推陈出新[3],目前临床使用的方法有荧光定量PCR技术,如实时荧光定量PCR技术、GeneXpert MTB/RIF(简称“GeneXpert”);等温(恒温)扩增技术,如环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)、交叉引物恒温扩增技术(CPA)、实时荧光核酸恒温扩增检测技术(SAT);探针-反向杂交技术,如线性探针技术、基因芯片法;熔解曲线技术,如探针熔解曲线技术。
1. GeneXpert:GeneXpert是由美国Cepheid公司开发的全自动一体化实时定量半巢式PCR,通过检测ropB基因来检测结核分枝杆菌及利福平耐药性[4]。研究显示,对于结核病患者的脑脊液,GeneXpert检测的敏感度为23%~52%;对于结核病并发HIV感染者的脑脊液,GeneXpert检测的敏感度为62%,特异度为87.5%~98%[5-12];如果对脑脊液样本进行离心,或提高样本量至6 ml以上,均可提高检测的敏感度[7-9]。对于有TBM症状体征的成人和儿童的脑脊液样本,WHO[13]对GeneXpert检测的推荐优先于涂片镜检和(或)培养。但在目前的临床工作中,由于脑脊液含菌量低及早期抗结核治疗药品的应用,降低了GeneXpert在TBM诊断中的敏感度[1, 14]。
2. GeneXpert MTB/RIF Ultra:GeneXpert MTB/RIF Ultra是在GeneXpert基础上开发的新的检测方法,其检测包含2个不同的靶点(IS6110和IS1081),并拥有比GeneXpert更大的DNA反应室(GeneXpert MTB/RIF Ultra中50 μl的PCR反应与GeneXpert中25 μl的PCR反应)。GeneXpert MTB/RIF Ultra还集成了全套核酸扩增和更快速的热循环,这促使其检测下限达到16 菌落形成单位(CFU)/ml,而GeneXpert为114 CFU/ml[13]。WHO[13]推荐,GeneXpert MTB/RIF Ultra用于脑脊液样本检测,可作为TBM的初始诊断,其可靠性更高。Kohli等[15]对6项关于GeneXpert MTB/RIF Ultra的研究(包含475例参与者)进行综述,指出GeneXpert MTB/RIF Ultra用于脑脊液检测的敏感度为89.4%,特异度为91.2%;而对于HIV感染人群,GeneXpert MTB/RIF Ultra检测的敏感度为95%,特异度为100%[9]。由此可见,GeneXpert MTB/RIF Ultra检测的敏感度较GeneXpert有所提高,但由于目前相关研究较少,还需大样本的临床观察来确认。同时,GeneXpert MTB/RIF Ultra的阴性预测值为84%(应≥99%),对于TBM诊断仍存在局限性,且对脑脊液所需的量更大(理想情况下为8~10 ml),虽然其检测阈值低,但部分患者大量引流脑脊液后容易出现低颅压综合征,因此在常规开展此项检查的过程中,会导致其敏感度降低。
3. LAMP:LAMP在等温条件下使用了具有链置换作用的BstDNA聚合酶,在6段特异靶核酸序列中设计4个引物序列进行扩增。LAMP的优点是不需要复杂的仪器,并且具有与痰涂片镜检相似的生物安全性[13]。一些研究显示,应用IS6110、MPB64作为LAMP的靶点检测脑脊液,敏感度为43.2%~82%,特异度为80%~100%;若采用多靶点联合检测,敏感度可达88%[16-20];刘威等[21]研究显示,用脑脊液标本检测结核分枝杆菌LAMP比荧光定量PCR的敏感度要高10倍[17]。LAMP也是WHO推荐的用于TBM的临床检测技术,但LAMP扩增的高效会产生非特异性扩增,存在一定的假阳性率[16]。
4. 探针熔解曲线技术:探针熔解曲线技术是通过检测特异性扩增产物与探针形成双链的解链温度,比较突变序列和野生型序列的温度差异获得靶基因序列信息[22]。其既可检测到结核分枝杆菌复合群,还可实现结核分枝杆菌对异烟肼、利福平、乙胺丁醇及氟喹诺酮类药品的耐药突变检测。目前该技术已广泛应用于痰液的检测,而关于脑脊液检测的相关数据较少。吴剑等[23]的研究显示,在170例脑脊液标本中,探针熔解曲线技术的阳性检出率与BACTAC MGIT 960快速培养法一致。探针熔解曲线技术多用于呼吸道标本的检测,对脑脊液标本的研究相对较少,但该方法能为TBM患者快速提供耐多药和广泛耐药的相关信息。
5. 线性探针技术:线性探针技术是利用生物素标记的引物特异扩增PCR产物,扩增产物与固定在尼龙膜上的特异寡核苷酸探针杂交,通过酶联免疫显色法显示结果,既能检测结核分枝杆菌也能检测其耐药性[3]。线性探针技术已经发展了2代,第一代可检测结核分枝杆菌及异烟肼、利福平耐药性,第二代在第一代的基础上还可检测氟喹诺酮类及二线注射类药品的耐药性[13]。WHO[13]推荐线性探针技术用于检测痰样本中的结核分枝杆菌和对氟喹诺酮类药品的耐药性,其他呼吸道样本(如支气管肺泡灌洗液和胃液)或肺外样本(组织样本、脑脊液或其他体液)尚未得到充分评估。Kaviyil和Ravikumar[24]的研究显示,脑脊液样本线性探针技术检测结核分枝杆菌的敏感度为96.15%,特异度为100.00%。而在印度的一项对238例疑似TBM患者的研究中,应用线性探针技术对脑脊液中的结核分枝杆菌进行检测,在通过微生物学确诊的TBM患者中,检测阳性率仅为55%[25]。虽然线性探针技术已广泛应用于痰液样本的检测,但对于脑脊液检测相关数据较少,这也可能是出现此类矛盾结果的原因。由于线性探针技术操作复杂,且对实验室环境要求较高,在其他分子检测技术蓬勃发展的今天,可能是限制其在TBM诊断中应用的原因。因此,对于线性探针技术在TBM诊断中的作用,仍需大样本的临床观察来确认。
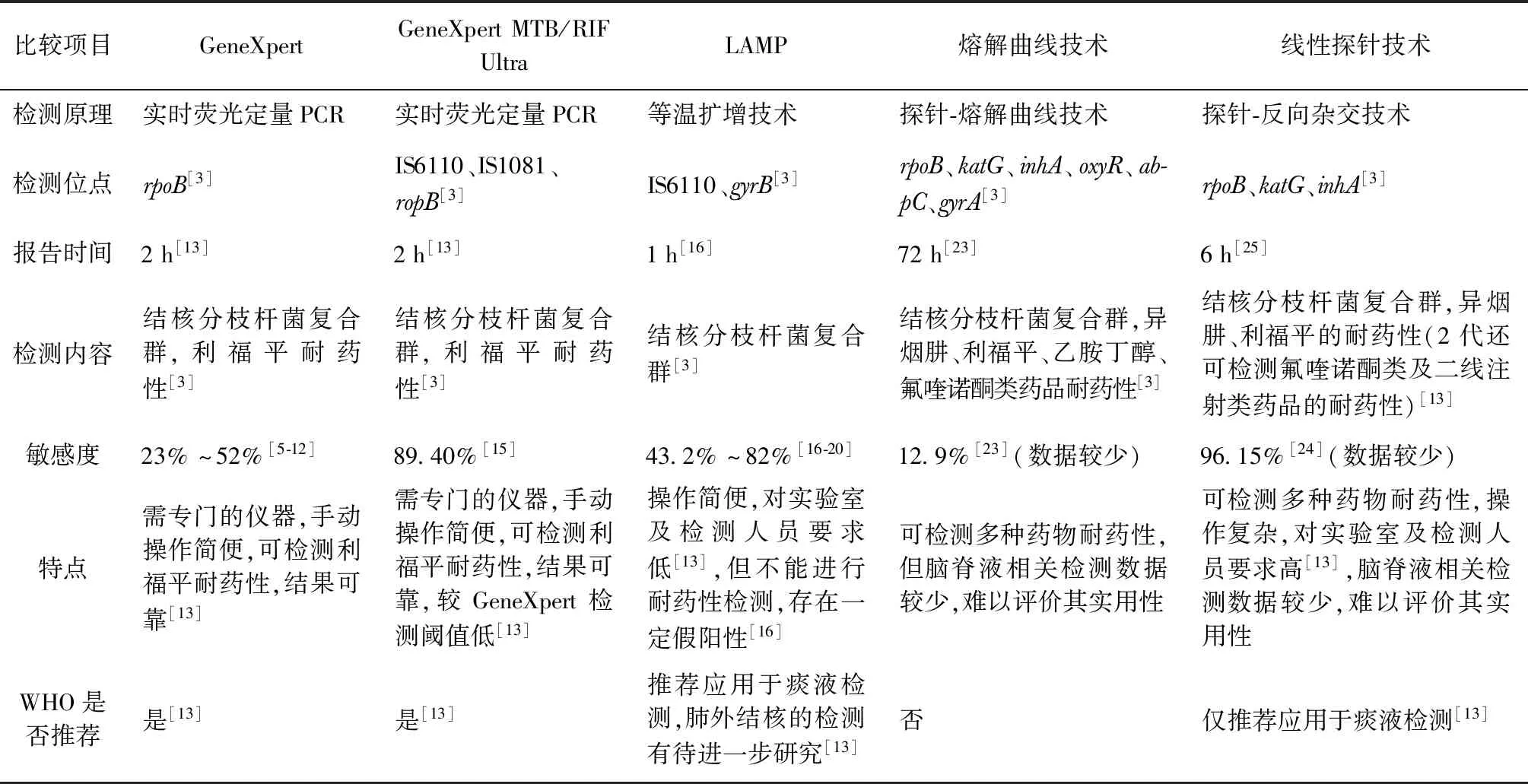
表1 脑脊液分子检测方法的比较
脑脊液分子检测方法的比较见表1。目前,对脑脊液分子检测技术的研究,仍首先推荐GeneXpert技术,虽然其敏感度不及线性探针技术,但由于其在检测结核分枝杆菌的同时可进行利福平耐药性的检测,可在2 h内报告检测结果,且目前在TBM检测中应用较广,相关数据较为可靠,因此仍作为首选的检测方法。而在检测技术欠发达的地区,可首选LAMP检测技术,虽然目前对于脑脊液的LAMP检测数据不及GeneXpert完善,但由于其操作简单,对实验室及操作人员要求较低,检测时间仅需1 h,因此较适合在基层开展。对于复治TBM或高度怀疑耐药的患者,可在进行GeneXpert检测的基础上,联合线性探针技术或熔解曲线技术进行检测,以缩短耐药检测时间,早期进行治疗。而由于脑脊液标本量的限制,首次腰椎穿刺留取脑脊液,应在满足常规及生化、细胞学检测的基础上,首先进行GeneXpert及结核分枝杆菌培养的检查,若条件允许,可继续留取标本进行其他分子检测,以提高检测敏感度。
二、结核性脑膜炎脑脊液分子检测技术最新研究
1.宏基因组测序技术(mNGS):mNGS是利用基因测序原理,检测样本中已存在的所有脱氧核糖核酸(DNA)或核糖核酸(RNA)信息,进而得到患者样本中致病微生物的信息[26]。目前,mNGS技术已广泛应用于临床,在既往的多项研究中指出,mNGS对病毒、真菌、细菌、寄生虫的检测,均取得了较好的成果,而对于罕见患者的病原学检测,也取得了一定的成果[27-29]。近年来,已有越来越多的研究将mNGS应用于TBM的初始诊断。Wang等[30]的研究显示,对23例结核性脑膜炎患者进行脑脊液病原学检测,mNGS方法检测出18例,检出率为78.26%,结合传统方法可以使检出率提高至95.65%。Xing等[31]的研究指出,mNGS检测TBM的敏感度高达84.44%,随后依次为GeneXpert(40%)、PCR(24.44%)、培养(22.22%)和涂片(0%)。但mNGS用于TBM检测研究的数据较少,尚需做进一步的深入研究。
2.Truenat MTB:Truenat MTB是一种基于芯片的NAAT,可使用实时微PCR技术检测结核分枝杆菌核酸,并进行利福平耐药性检测。首先使用Trueprep-MAG(一种基于纳米技术设备,可用电池驱动)进行痰液的处理,然后在Truelab-UNOTM分析仪(手持式电池驱动的热循环仪)上进行PCR扩增、分析报告结果[13, 32]。该方法目前仅应用于痰液的结核分枝杆菌检测,对于脑脊液的检测无相关研究数据。
3.数字聚合酶链反应技术(dPCR):dPCR是继终点PCR和实时PCR之后的第三代PCR技术,是一种无校正曲线的定量方法,可以绝对定量低丰度的结核分枝杆菌核酸。Li等[33]应用此技术,检测脑脊液结核分枝杆菌核酸IS6110诊断TBM,其敏感度为57.4%,特异度为97.0%,敏感度明显高于GeneXpert、实时荧光定量PCR、分枝杆菌培养和涂片检测。但数字PCR 检测TBM研究数据较少,还需进一步的深入研究。
4.其他技术:通过不同的标本处理方法提高分子检测技术的敏感度,也是目前研究的热点。Park等[34]采用同型双功能亚氨酸酯和微流控平台富集脑脊液中的结核分枝杆菌,然后再进行实时荧光定量PCR检测,可明显提高检测阳性率。
目前,新的分子检测技术主要通过改进标本处理方法及检测技术提高检测的敏感度。首先,脑脊液为体液样本,主要问题是含菌量较低、目的基因扩增量少和DNA提取过程易受外界影响等[14]。因此,改进结核分枝杆菌的富集方法是提高检测敏感度的第一步。其次,结核分枝杆菌作为胞内寄生菌,常规的处理方法容易遗漏结核分枝杆菌的检测,因此改进标本处理方法,高效提取单核细胞内的结核分枝杆菌应是提高检测敏感度的第二步。再次,结核分枝杆菌提取后,如何采取有效的破壁方案,高效提取核酸进行扩增,是提高检测敏感度的第三步。最后,mNGS作为测序技术,其主要优势在于可以对样本中全部的核酸进行检测,这种无偏性的检测,对于TBM与其他中枢神经感染性疾病的鉴别意义重大,因此对于临床中难以诊断的中枢神经系统感染性疾病,建议行mNGS检测,可能会对诊断有帮助。
现阶段面临的主要问题在于,新的检测方法在临床中的应用时间较短,仍需大样本的临床观察来确定其实用性。同时现有的分子检测技术,仍不能解决脑脊液检测阴性预测值低的问题,不能作为排除临床诊断的标准,还需要进一步研究与改进,才能更好地服务于临床。
三、展望
脑脊液作为体液样本有其特点,TBM患者多伴有颅内压增高或脑积液,过多的取材会加重患者病情,取材过少则会影响检测的敏感度,亟需高敏感度的分子检测技术;改进胞内寄生菌的提取及采取有效的破壁方案进行高效的核酸提取,可能是提高检测敏感度的有效方法,也是需要进一步研究的方向;目前临床中常用的分子检测技术,虽然可以用于脑脊液标本,但临床数据较少,仍需要积累临床数据,以筛选出最优的检测方法。检测TBM的新技术从实验室到应用于临床实际工作仍需要大样本的临床试验来支撑。但是,随着结核病实验室分子检测技术水平的提高,TBM的检测能力也会逐步提高,以更好地满足临床医生对TBM诊断的要求,提高TBM患者的治疗效果。
