脊髓损伤后肌肉萎缩组织中差异表达基因的生物信息学分析
2021-03-25黄为琰张文清郑诗豪
黄为琰,张文清,郑诗豪
(1.福建中医药大学中西医结合学院,福建 福州,350122;2.福建省立医院 神经外科,福建 福州,350001)
脊髓损伤是神经外科一类重症疾病,可分为创伤性和非创伤性脊髓损伤,前者较为常见,常由外部物理因素引起[1],后者常由肿瘤、缺血或先天性疾病引起[2]。脊髓损伤通过神经元损害、肌肉废用等途径引起骨骼肌萎缩[3-4]。目前已有学者对脊髓组织损伤后继发的线粒体功能障碍、氧化应激激活、肌肉蛋白质合成与降解等过程进行了相关研究[5-6],但其病理、生理的复杂性限制了该病的治疗进展。本研究对脊髓损伤后肌肉萎缩患者的肌肉组织进行生物信息学分析,并探讨该病的发病机制,以期为潜在治疗方法提供理论依据,现报告如下。
1 资料与方法
1.1 基因芯片的筛选
选择GEO数据库中GPL570[HG-U133_Plus_2]Affymetrix Human Genome U133 Plus 2.0 Array平台检测,编号为GSE21497的芯片进行分析。此芯片从招募的10位脊髓损伤肌肉萎缩的患者中获取骨骼肌样本,其中包括脊髓损伤患者男9例和女1例(6例为四肢瘫痪,4例为截瘫),平均年龄 44岁。入选标准:18岁以上患者;格拉斯哥昏迷评分大于 13分者;无肌肉挤压伤、低氧损伤、系统性败血症、全身性炎症者;自身免疫性疾病及恶性肿瘤者。分别在脊髓损伤后第2、5天使用5mm Berstrom活检针从10位患者的股外侧肌获取肌肉样本,取下后立即置入液氮中冻存,储存于-80℃待测。以患者第2天的股外侧肌样本的基因表达谱数据为对照组,以第5天样本的基因表达谱数据作为实验组。
1.2 芯片数据处理与差异基因提取
使用R软件中affyPLM、RColorBrewer包进行芯片数据分析,得出相对对数表达图,观察各组样本数据表达强度。然后调用R软件中affyPLM、affy包通过RMA算法对芯片进行背景校正。利用R软件中limma包,设置差异基因筛选条件:logFC>1或logFC<(-1),且adj.P.val<0.05。将提取的差异基因导入OmicShare(https://www.omicshare.com/)在线网站制作出火山图、热图。
1.3 差异基因富集分析
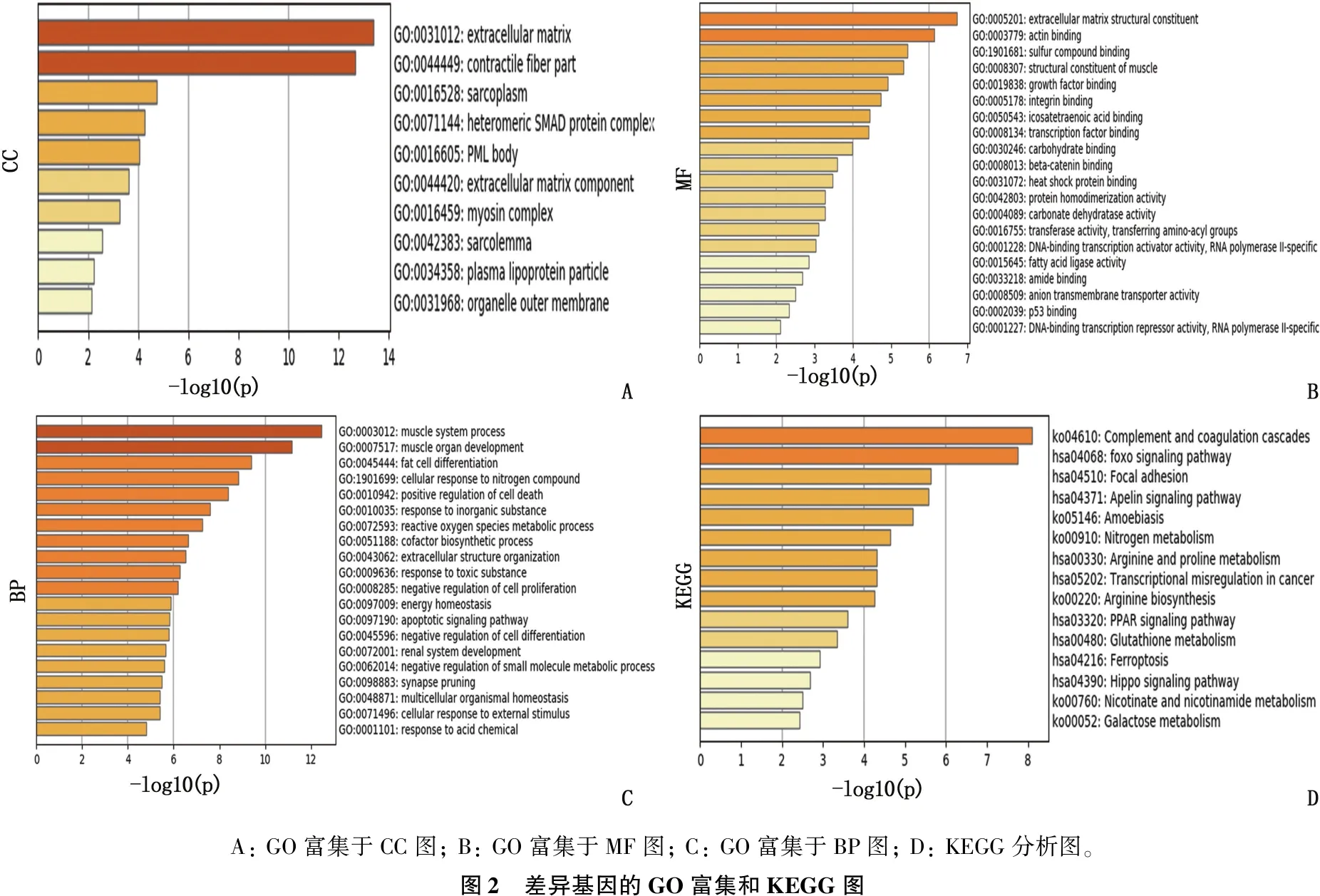
将筛选出的差异基因导入Metascape在线网站,进行GO分析、KEGG信号通路分析,以柱状图表现富集结果,获取基因相关的生物学过程(BP)、细胞组分(CC)、分子功能(MF)。
1.4 构建蛋白质互作用网络
将筛选出的差异基因导入Metascape在线网站,进行蛋白互作网络构建。利用MCODE算法检测出相互作用结果紧密的蛋白质模块中的关键差异基因。
2 结 果
2.1 脊髓损伤后肌肉萎缩患者肌肉组织中的差异基因
使用R软件得出相对对数表达图,每个样品的中心均较接近纵坐标0,结果表明样本平行试验一致性较强,见图1A。样本背景校正后,设置差异倍数大于2及校正后P值小于0.05,筛选出294个差异基因。2组样本中共有8个上调表达差异基因,286个下调表达差异基因,见表1。将差异基因导入OmicShare在线网站制作热图和火山图,见图1B、图1C。


表1 脊髓损伤肌肉萎缩患者第2、5天肌肉样本的差异基因
2.2 差异基因的GO、KEGG分析
GO富集中,CC中差异基因主要集中于肌纤维组分、肌质、异构SMAD蛋白复合体、肌球蛋白复合物、肌膜、细胞器外膜。分子MF中差异基因主要集中于肌肉的结构组分、肌动蛋白结合、生长因子结合、整联蛋白结合、碳水化合物结合、β-连环蛋白结合、热休克蛋白结合、碳酸脱水酶活性、脂肪酸连接酶活性、阴离子跨膜转运蛋白活性。BP中差异基因主要集中于肌肉器官发育过程、细胞衰亡的正向调控、细胞增殖、分化的负向调控、能量平衡、脂肪细胞分化、细胞对外部刺激的反应、对氮化合物的反应、对酸性化学物质的反应、活性氧代谢过程、辅因子生物合成、突触修剪等。见图2。
KEGG信号通路主要包括:补体系统信号通路、FoxO 信号通路、黏着斑信号通路、氮素代谢信号通路、精氨酸和脯氨酸代谢信号通路、过氧化物酶体增殖物激活受体信号通路、谷胱甘肽代谢信号通路、铁死亡信号代谢通路、烟酸和烟酰胺代谢信号通路、半乳糖代谢信号通路等。
2.3 蛋白质相互作用分析及关键差异基因获取
蛋白质互作用网络中,4个蛋白相互作用较丰富模块中的关键基因共有18个:TNNI1、TNNC1、TCAP、ACTN2、MYL3、MYL2、DNAJA4、DNAJB5、GYS1、UGP2、AKR1B10、GOT1、C1QA、C1QB、C1QC、CASQ2、DAXX、SLC2A4,见图3。
3 讨 论
脊髓损伤导致肌肉萎缩,亦使全身多系统继发严重功能障碍[6]。研究[7-8]表明,在脊髓损伤后6周内,骨骼肌平均横截面积比对照组低18%~46%,且身体总脂肪率增高。肌肉萎缩可加重胰岛素抵抗并促进糖尿病发展[9],同时下肢肌肉收缩力量减弱,引起循环血量不足,导致运动耐力降低、呼吸功能减弱等[10-11]。目前对于该病的研究仍以动物实验模型为主,本研究选择GEO数据库中编号为GSE21497的患者骨骼肌样本进行研究,更具客观意义。
通过分析筛选出294个差异基因,经GO分析富集于CC中的差异基因主要存在于肌质、肌膜、肌球蛋白复合物中;MF中差异基因主要参与肌肉构成以及β-连环蛋白、热休克蛋白等物质的结合过程;BP中差异基因主要参与肌肉发育、突触修剪、活性氧代谢等过程。研究[5]发现,肌肉蛋白质的合成和降解失衡、氧化应激反应、自噬等过程在该病的进程中起重要作用。CHEN Z等[12]发现,损伤的肌肉组织中FoxM1转录因子表达量下降,引起Wnt通路中β-连环蛋白信号过度激活,导致肌肉萎缩和再生不良。通过促进FoxM1转录可显著上调肌肉干细胞中Apc的表达,降低β-连环蛋白水平,拮抗肌肉损伤。CRISTOFANI R等[13]发现,小热休克蛋白B8分子通过介导错误折叠蛋白的自噬可缓解肌肉萎缩。

KEGG信号通路中差异基因主要集中在补体系统、FoxO信号通路、谷胱甘肽代谢等通路。研究[14]发现,肌肉损伤后使用重组趋化因子CCL5可促使补体系统C3a和C3aR信号表达增强,促进肌肉再生。FoxOs通路参与体内众多重要生物过程,如自噬、ROS解毒、DNA修复等[15-16]。学者[17]发现,抑制FoxO1、FoxO3、FoxO4基因的激活,可缓解自噬、蛋白降解导致的神经性肌肉萎缩。NINFALI C等[18]学者提出,ZEB1可抑制FoxO3转录活性,从而抑制肌肉萎缩基因Fbxo32和Trim63启动子的转录。ABDULLAH M等[19]通过建立犬肌肉营养不良模型发现,损伤后组织中胶原蛋白纤维化与肌肉萎缩在相关,而脯氨酸/精氨酸代谢途径可能是炎症相关胶原蛋白合成、肌纤维化的核心过程。
通过PPI分析及MCODE算法筛选出18个关键差异基因,其中部分基因已被报道与脊髓损伤后肌肉萎缩过程紧密相关。肌钙蛋白在骨骼肌的收缩过程中起重要作用,脊髓损伤后肌肉组织内源性肌浆网中 Ca2+含量降低约10%,与慢速骨骼肌型肌钙蛋白I 1 (TNNI1)的表达相关,通过上调骨骼肌中 TNNI1的表达,可增强脊髓损伤者康复运动的抗疲劳性,改善疾病预后[20-22]。肌肉特异性糖原合酶1(GYS1)缺失可导致葡萄糖代谢功能和运动能力受损[23],促进GYS1上调可提高肌肉收缩能力并减缓萎缩。补体级联反应在神经损伤区域被激活,保护神经免受感染、缓解损害,其具体机制尚未阐明[24-25]。研究[26]证实,C1q、C3、C5等补体在神经损伤后可调控神经再生。此外,肌源性转录因子MYOD1可协同E-box调控肌联蛋白帽(TCAP),促进对骨骼肌新陈代谢[27]。其余关键差异基因与肌肉萎缩的研究较匮乏,仍需进一步实验探索。
目前,治疗脊髓损伤后肌肉萎缩的方法包括手术、药物、基因工程等[28-31]。早期手术减压可缓解组织继发性缺氧、缺血,降低细胞损伤程度[32-33]。河豚毒素、苯妥英钠等钠通道阻滞剂可维持离子稳态平衡,缓解轴突病变[34-35]。促红细胞生成素上调SDF-1α与G蛋白偶联的CXCR4受体等趋化因子的表达,可募集骨髓间充质干细胞,增强组织抗凋亡能力,改善神经功能等[36-37]。甲泼尼龙等激素可上调抗炎因子、降低组织氧化应激反应、减轻水肿等[38]。学者[39-41]提出,激素治疗不仅在运动或神经功能恢复上与对照组无明显差异,还可能会加重感染、胃肠道出血等症状。胚胎干细胞移植和多能干细胞诱导可调节炎症反应,改变微环境,分泌营养因子,使神经再生[42-44]。
综上所述,本研究所筛选出的差异基因在脊髓损伤病程中涉及微环境变化、神经元变性坏死、肌肉组织纤维化、能量获取、线粒体功能障碍等重要过程。临床可对上述基因的相关机制进行深入研究,以为组织损伤后神经肌肉系统的生长、代谢、凋亡等方面的治疗提供理论依据,从而改善患者预后。
