磁性镍基氮掺杂多壁碳纳米管对双酚A的吸附性能及机理研究
2021-03-25王学东刘婷婷顾海东
孔 佳,王学东,刘婷婷,2,顾海东,2*
(1.苏州科技大学 环境科学与工程学院,江苏 苏州 215009;2.江苏省环境科学与工程重点实验室,江苏 苏州 215009)
双酚A(BPA)是一种典型的有机污染物,是生产环氧树脂和聚碳酸酯塑料不可或缺的添加剂,含有BPA的塑料广泛用作食品及饮料包装的内侧涂层[1]。近年来,在废水、地下水、地表水甚至饮用水中都检测到了BPA[2]。BPA具有一定的雌激素活性,结构与生物体内激素类似,具有内分泌干扰效应,对人体的生殖系统和免疫力系统有危害作用[3-4]。因此,水体中BPA的有效去除成为研究的热点。
目前,水体中BPA的去除方法主要有光催化降解法[5]、物理法(膜过滤和吸附法)[6]、生物降解法[7]、化学氧化法[8]等。相比于其他方法,吸附法具有操作简单,不易产生二次污染等优点。利用纳米材料进行吸附被认为是目前去除废水中BPA的有效途径之一。碳基纳米材料具有比表面积大、合成成本低等优点,是理想的吸附剂[9-10]。但传统碳基纳米材料在吸附完成后,往往需借助过滤、离心等繁琐步骤才能与废水分离。为了简化分离操作,提高分离效率,对吸附材料进行磁化和掺入氮、硼等杂原子改性处理成为研究热点。传统的磁性吸附材料多以Fe3O4作为磁核,但裸露的Fe3O4的磁性和理化性质不稳定[11],大大限制了其应用范围。为保证材料在拥有较强吸附性能的同时保持磁性稳定,Song等[12]通过煅烧镍基金属有机骨架制备了新型吸附剂Ni@C纳米复合材料,并将其用于罗丹明B的吸附研究,室温下10 min内的吸附率可达99%。Xu等[9]制备了氮掺杂多孔碳纳米结构吸附剂(N-dope FPC)用于水溶液中磺胺甲嘧啶的吸附,298 K下5 min即可达到吸附平衡,吸附容量达610 mg/g。研究表明,磁性金属镍的引入可简化吸附剂分离过程中的繁琐步骤,提升处理效率;同时,掺杂的氮原子为碳纳米管引入了空缺位,从而提高了吸附效率[13]。
目前,含镍的氮掺杂磁性碳纳米管状材料在BPA的吸附应用中少见报道。基于此,本实验以醋酸镍和双氰胺为前驱体,通过高温煅烧法一步制得了具有较大比表面积,较多缺陷位点及较强磁性的氮掺杂磁性多壁碳纳米管状材料Ni-NMCNTs,对Ni-NMCNTs的微观形貌及结构进行研究,并将其用于水中BPA的吸附。结合液相色谱/荧光检测法考察了不同反应条件对吸附性能的影响,并通过傅里叶变换红外光谱、X射线光电子能谱等测试对吸附机理进行了深入研究。
1 实验部分
1.1 主要试剂与仪器
双酚A(BPA)购于日本WAKO公司,四水合醋酸镍(Ni(CH3COO)2·4H2O)、N,N-二甲基甲酰胺(DMF)、色谱级乙腈均购于瑞士Adamas公司,双氰胺(C2H4N4)、调节pH值所用的氢氧化钠(NaOH)和盐酸(HCl)均购于上海阿拉丁试剂有限公司,配制BPA溶液所用的色谱级甲醇(CH3OH)购于上海沪试公司,清洗和合成材料所用的无水乙醇和硫酸均为分析纯,购于太仓周氏化学试剂有限公司。
KQ-500DE数控超声波清洗器(昆山市超声仪器有限公司),OTF-1200X管式炉(合肥科晶材料技术有限公司),DHG-9070A电热鼓风干燥箱(上海夕闻生物科技有限公司),B15-3多功能恒温恒速磁力搅拌器(上海司乐仪器有限公司),THZ-92A台式恒温振荡箱(上海跃进医疗器械有限公司),Quanta FEG250扫描电子显微镜、Tecnai G2F30 透射电子显微镜(美国FEI公司),Nicolet 6700傅里叶变换衰减全反射红外光谱仪、K-Alpha+型X射线光电子能谱仪(美国Thermo Fisher Scientific公司),Bruker D8 Advance X射线衍射仪(德国Bruker公司),MPMS XL-7磁滞回线测试仪(美国Quantum Design公司),V-Sorb 2800P 比表面积及孔径分析仪(北京金埃谱科技有限公司),LC-20AT高效液相色谱仪(日本岛津公司)。
1.2 Ni-NMCNTs的制备
称取0.209 g Ni(CH3COO)2·4H2O和1.009 g C2H4N4加入到约30 mL DMF中,将混合液于80 ℃,500 r/min下搅拌至蒸干,得到棕黄色前驱体粉末。将前驱体粉末在N2保护下,700 ℃高温煅烧2 h,冷却后得到的黑色粉末先用200 mL 1 mol/L H2SO4酸洗24 h,再用超纯水洗涤3次,最后于60 ℃下烘干,得到Ni-NMCNTs。
1.3 材料表征
利用扫描电子显微镜(SEM)和透射电子显微镜(TEM)观察Ni-NMCNTs的形貌特点;利用傅里叶变换红外光谱(FT-IR)研究材料的官能团;利用X射线衍射仪(XRD)和X射线光电子能谱技术(XPS)分别研究材料的晶格结构及化学成分;利用比表面积及孔径分析仪(BET)测试Ni-NMCNTs的比表面积和孔径分布;利用磁滞回线测试仪(VSM)测量吸附前后Ni-NMCNTs的磁性变化。
1.4 Ni-NMCNTs材料吸附BPA实验
在一系列含有100 mL BPA溶液(20 mg/L)的250 mL锥形瓶中分别加入20 mg Ni-NMCNTs,将锥形瓶置于25 ℃,振荡速度200 r/min的恒温振荡箱中,分别于10、30、60、90、120 min时各取1 mL溶液,采用磁铁将吸附剂与样品溶液分离。
通过高效液相色谱/荧光法测定BPA的浓度,色谱柱为安捷伦Eclipse XDB C18,柱温为30 ℃,流动相为50%乙腈和50%超纯水,流速为0.8 mL/min,激发波长为233 nm,发射波长为303 nm。
2 结果与讨论
2.1 材料的表征


图1 Ni-NMCNTs的SEM(A)和TEM(B)
根据吸附等温线计算得出Ni-NMCNTs吸附前后的比表面积分别为201.36 m2/g和171.94 m2/g(图3A),由孔径分布(BJH)模型(图3A内插图)计算得到Ni-NMCNTs的孔径主要集中于3.8 nm,累积孔体积为0.766 9 m3/g。表明该材料具有介孔结构及较大的比表面积和孔隙体积,可有效增加与BPA的接触面积,为吸附过程提供更多的活性位点[22]。VSM(图3B)测试结果显示,吸附前后Ni-NMCNTs材料的饱和磁通量分别为14.71、13.35 emu/g,表明Ni-NMCNTs具有明显的超顺磁性,且吸附前后磁性的变化很小,可保证完成吸附后将其快速分离。

图2 Ni-NMCNTs的结构表征
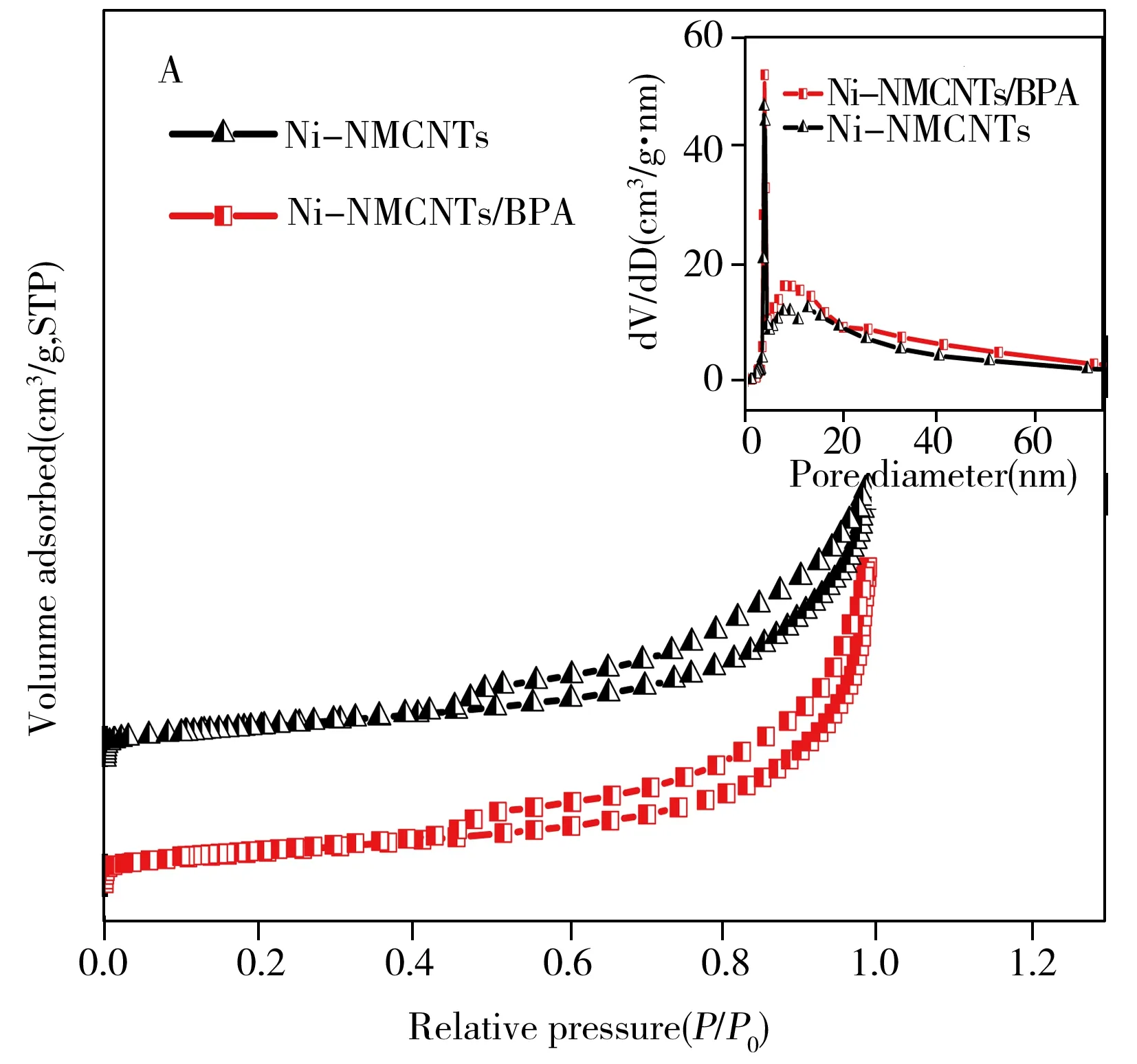
图3 Ni-NMCNTs的BET图(A)和VSM图(B)

图4 pH值对吸附BPA的影响
2.2 Ni-NMCNTs吸附性能的影响因素
2.2.1 pH值的影响在一系列100 mL BPA溶液(20 mg/L)中分别加入20 mg Ni-NMCNTs,用HCl(0.1 mol/L)或NaOH(0.1mol/L)调节pH值(2.0、4.0、6.0、8.0、10.0)。如图4所示,随着pH值的增加,吸附效率呈先上升后下降的趋势,酸性条件下BPA的吸附率普遍高于碱性条件,pH 6.0时Ni-NMCNTs对BPA的吸附率可达86.6%。这是因为,BPA在水溶液中的解离常数pKa为9.59~11.30,pH 2.0~6.0时,随着pH 值的升高,H+与BPA之间的相互竞争逐渐降低[23];而碱性条件下,溶液中的BPA主要以游离态的形式存在,容易被质子化形成阴离子,并在pH 8.0时发生一级电离形成HBPA-,pH 9.0时则发生二级电离形成BPA2-,与被Ni-NMCNTs吸附的BPA发生静电作用,从而导致吸附率下降[24-25]。因此,偏酸性条件更利于Ni-NMCNTs对BPA的吸附。
2.2.2 投加量的影响合理的吸附剂投加量是影响吸附效果的另一重要因素。配制100 mL BPA溶液(20 mg/L),向其中分别加入5、10、15、20、25、30 mg Ni-NMCNTs,研究吸附剂投加量对吸附实验的影响。结果显示,Ni-NMCNTs的投加量为5 mg时,BPA的吸附率为43.5%,投加量为20 mg时吸附率增至86.1%,将投加量继续增加至35 mg,吸附率变化不明显,保持在86.5%左右。这可能是由于随着吸附剂投加量的增加,吸附剂的活性位点相应增加,当投加量增至20 mg时吸附达到饱和,吸附率基本稳定[14]。因此,选择最佳投加量为20 mg进行后续研究。
2.3 吸附等温线
将20 mg Ni-NMCNTs复合材料分别投加到100 mL不同质量浓度(5、10、15、20、25、30 mg/L)的BPA溶液中,于恒温振荡箱中在不同温度(25、35、45 ℃)下以200 r/min振荡,经磁铁分离后,采用HPLC测定BPA的浓度。分别采用Langmuir(式1)和Freundlich(式2)等温吸附方程对实验数据进行线性拟合:
(1)
式中,Ce为吸附平衡浓度,mg/L;b为平衡时的吸附常数,L/mg;Qe为平衡时的吸附量,mg/g;Qm为理论最大吸附量,mg/g。
(2)
式中,Ce为吸附平衡浓度,mg/L;Qe为平衡时的吸附容量,mg/g;k为吸附常数,L/mg,n为温度相关的特征常数。
由图5可知,Ni-NMCNTs对BPA的吸附更符合Freundlich 等温吸附方程。25 ℃时的回归系数R2为0.997 9,理论最大吸附量为31.63 mg/g,表明表面吸附位点分布不均匀。由图6可知,随着温度的升高,Ni-NMCNTs对BPA的吸附量减小,这是由于BPA在水中的溶解度随着温度的升高而增加,而整个吸附过程为放热过程,温度的降低有利于Ni-NMCNTs对BPA的吸附[25]。因此,选择室温25 ℃进行吸附研究。

图5 Langmuir(A)和Freundlich(B)等温吸附拟合结果

图6 不同温度下Ni-NMCNTs对BPA的等温吸附曲线

图7 Ni-NMCNTs 对BPA的吸附动力学曲线
2.4 吸附动力学
选择准一级动力学方程和准二级动力学方程对吸附实验进行拟合。准一级动力学公式:
(3)
其中,qe为平衡时的吸附容量,mg/g;qe,exp为理论饱和吸附量,mg/g;qt为t时刻的吸附容量,mg/g;k1为吸附速率常数,g/(mg·min)。
(4)
其中,qt为t时刻的吸附容量,mg/g;k2为吸附速率常数,g/(mg·min)。


表1 吸附热力学参数
2.5 吸附热力学研究
在吸附等温线的基础上,计算了吸附过程的自由能(ΔG)、焓变(ΔH)、熵变(ΔS),结果如表1所示。ΔH为负值,表明整个吸附过程为放热过程;吸附热低于40 kJ/mol,可知吸附过程中发生氢键力作用。Ni-NMCNTs中的氮原子和含氧官能团可与BPA中的羟基之间形成氢键;同时,材料表面存在丰富的π电子,可与BPA结构中苯环上的π电子形成π-π共轭,表明在该吸附过程中存在物理吸附,与文献报道结论相符[25-26]。ΔG为负值,表明Ni-NMCNTs对BPA的吸附自发进行;ΔS为负值,表明Ni-NMCNTs对BPA的吸附随着吸附量的增加逐渐趋于稳定。
2.6 材料的重复利用
为了验证Ni-NMCNTs 的可重复使用性,将吸附后的材料回收并利用乙醇和超纯水交替洗涤3次,于60 ℃下烘干后继续用于BPA吸附实验。结果发现,每经一次循环后,吸附量和吸附率均有所下降,循环5次后的最大吸附量为73.48 mg/g,为初始最大吸附量的87.9%,吸附率从86.8%下降至79.4%,表明合成的Ni-NMCNTs吸附剂具有良好的可重复利用性。
3 结 论
本研究采用高温煅烧法制备了磁性镍基氮掺杂多壁碳纳米管材料(Ni-NMCNTs),并用于BPA的吸附研究。结果证明,酸性条件更有利于Ni-NMCNTs 对BPA的吸附,而Ni-NMCNTs中空的纳米结构和大的比表面积可增大其与溶液的接触面积,提高吸附率;氮元素的掺杂和材料中丰富的含氧官能团有助于形成氢键,增强π-π共轭效应,也有利于吸附效率提高。磁性金属镍的引入则使材料更利于分离并重复利用。动力学研究表明,Ni-NMCNTs对BPA的吸附更符合准二级动力学方程,即吸附过程主要为化学吸附。热力学研究表明,Ni-NMCNTs对BPA的吸附更符合Freundlich模型,整个吸附过程为放热过程且自发进行,吸附过程中存在物理吸附。
