一步法制备银溶胶用于临床嗜麦芽窄食单胞菌的表面增强拉曼光谱快速检测
2021-03-25陆偲倩张景皓黄天雄杜一平
陆偲倩,张景皓,黄天雄,赵 虎,杨 峰,贾 楠,杜一平*
(1.上海功能性材料化学重点实验室,华东理工大学 化学与分子工程学院,上海 200237;2.复旦大学 附属华东医院 检验科,上海 200040)
嗜麦芽窄食单胞菌是一种新型的条件致病菌,其外膜通透性较低,且可生产β-内酰胺酶,故对氨基糖苷或β-内酰胺等多种抗生素具有抗性[1-2]。近年来,随着广谱抗生素和免疫抑制剂的滥用以及侵入性医疗操作过程的增加,嗜麦芽窄食单胞菌已经成为临床上令人极其头疼的耐药致病菌之一。嗜麦芽窄食单胞菌的感染部位多种多样,包括下呼吸道感染、血流感染、尿路感染、皮肤软组织感染、心内膜炎以及各种术后造成的器官炎症感染[3-7]。其中,血流感染是最常见的一种。目前,血流感染的检测手段层出不穷,有传统的血培养法(包括衍生出的自动血培养检测系统)[8];有特异性强的生物标志物检测技术,如以白细胞介素6(IL-6)、内毒素等为特征媒介来检测致病菌的阳性率[9];还有新兴的分子生物学技术,如目前运用广泛的聚合酶链式反应(PCR)技术和质谱技术[10]。但血培养技术耗时长、灵敏度低,生物标志物技术应用范围狭窄,分子生物学技术所需仪器和试剂成本昂贵,操作繁琐,且可能存在一定的假阳性结果[11]。因此,亟需开发一种快速、简便且经济的检测方法来及时诊断和控制嗜麦芽窄食单胞菌的感染,并预防其进一步扩散。
表面增强拉曼散射(SERS)是一种高灵敏度、快速、无损、低成本的振动光谱检测技术,其利用贵金属纳米颗粒作为基底,并以无标记的方式将细菌细胞吸附到贵金属颗粒之间的“热点”表面[12]。由于贵金属纳米颗粒粗糙表面所产生的电磁场以及金属颗粒与所吸附物质之间的电荷转移作用,使得入射光的信号被特异性增强,从而辐射出“尖峰”状的拉曼散射信号[13]。大量文献表明,SERS被广泛用于肠道细菌鉴定、尿路感染检测和血清中细菌分类等研究,是研究带发色团的蛋白质和核酸的有力工具[11-12]。SERS的基底对检测结果的影响巨大,理想的基底需具有高灵敏度、均匀性好、再现性高(RSD(相对标准偏差)≤20%)、背景信号低等特性[14]。SERS基底的制备方法众多,其中通过化学还原法制备纳米颗粒溶胶是最常用的方法之一,但由于纳米颗粒之间的团聚,其使用寿命一般都很短。Chen等[15]通过一步法快速合成了银溶胶,避免了溶胶寿命短的缺陷,其即制即用的特点能够在现场检测中发挥巨大作用。本文将经过改进的一步法制备的银溶胶应用于嗜麦芽窄食单胞菌的快速检测,展示出良好的应用前景。
1 实验部分
1.1 试剂、样品与仪器
抗坏血酸、色氨酸、酪氨酸(上海笛柏生物科技有限公司),柠檬酸三钠(上海凌峰化学试剂有限公司),硝酸银(上海泰坦科技股份有限公司),罗丹明6G(R6G,阿拉丁试剂公司),苯丙氨酸(上海麦克林生化科技有限公司),氯化钠、腺嘌呤、胞嘧啶(上海百灵威化学技术有限公司),鸟嘌呤(上海毕得医药科技有限公司),胸腺嘧啶(南京健友生物化学有限公司)。上述试剂均为分析纯。
嗜麦芽窄食单胞菌标准菌株ATCC17666 1株由上海市临检中心提供,临床分离菌株10株由复旦大学附属华东医院提供,于2019年1月至3月期间收集,分离自华东医院门诊部及住院患者的感染体液样本。4例经过基质辅助激光解吸电离飞行时间质谱(Matrix-assisted laser desorption/ionization time-of-flight mass spectrometry,MALDI-TOF MS)菌种验证的阳性病人血液样本和2例阴性血液样本由华东医院收集并提供。
VERSA TREK血培养系统(美国赛默飞公司),配有需氧瓶和厌氧瓶;VITEK MS基质辅助激光解吸飞行时间质谱仪(法国生物梅里埃公司),配备48孔靶板;哥伦比亚血琼脂平板(上海科玛嘉微生物技术有限公司),普通分离胶促凝管(美国BD公司)。i-Raman拉曼光谱仪(美国B&W Tek 公司),配有二极管激光器(激发波长为785 nm,最大激发功率为300 mW)以及拉曼显微检测平台( 20×物镜),分辨率5 cm-1,扫描范围175~3 200 cm-1。高速离心机(上海力辰邦西仪器科技有限公司);S-3400N扫描电子显微镜(日本日立公司)。
1.2 银溶胶基底的制备
通过改进的文献[15]方法制备银溶胶:将抗坏血酸和柠檬酸三钠分别作为还原剂和稳定剂,还原硝酸银溶液制备银溶胶。为得到性能更好、更稳定的银溶胶,用50 ℃ 水浴法代替手握法进行加热。称取0.010 6 g抗坏血酸和0.058 8 g柠檬酸三钠定容于100 mL容量瓶中,并立刻取5 mL加入到10 mL 玻璃小瓶中(内径18.4 mm,高度65 mm),将玻璃小瓶置于50 ℃ 水浴锅中,搅拌加热,并向玻璃瓶内加入0.05 mL 0.1mol/L的AgNO3溶液,在不到10 min内,即可得到灰绿色的银溶胶,冷却至常温,避光保存以备下一步使用。
1.3 嗜麦芽窄食单胞菌菌悬液的制备
将嗜麦芽窄食单胞菌接种到哥伦比亚血琼脂平板上,并置于5% CO2、35 ℃孵育箱中培养18~24 h。选取单个菌落,采用VITEK MS质谱仪及配套试剂进行菌种鉴定,操作严格按照基质辅助激光解吸附质谱仪微生物鉴定操作标准进行[16]。将嗜麦芽窄食单胞菌标准菌株ATCC17666和10株临床菌株分别用DD H2O(无菌水)配制成浓度为1×108菌落形成单位(Colony forming unit,CFU)/mL的菌悬液,置于4 ℃冰箱中保存待用。
1.4 人体血流感染阳性样本中嗜麦芽窄食单胞菌的提取
将4例放置于5% CO2、35 ℃ 孵育箱中的阳性报警病人的血液样本取出,移取2.5 mL血液至5 mL普通分离胶促凝管中,以3 000 r/min离心10 min,弃去上清液,加入500 μL蒸馏水将分离胶上粘附的嗜麦芽菌体洗脱,并将充分混合的菌液转移至2 mL离心管中,以17 000 r/min离心2 min,弃去上清液,再加入500 μL蒸馏水重悬,离心2 min。重复上述步骤3次,最后加入200 μL蒸馏水定容备用。2例阴性血液样本按照上述操作后,作为空白对照组。最终的光谱检测过程与纯培养菌悬液的检测过程一致。
1.5 SERS光谱检测
取50 μL银溶胶加入2 mL离心管中,再分别加入50 μL菌悬液和25 μL 1%的NaCl溶液,振荡混合,取混合溶液50 μL于铝板上,待混合液滴自然干燥后,以100%的激光功率和10 s的积分时间进行SERS检测,每个样本采集5次。所有的原始数据使用BWSpec 4.03_24_C 2015光谱软件包进行平滑、基线校正和平均化。
2 结果与讨论
2.1 银溶胶的表征
2.1.1 银溶胶的粒径分布及与细菌的表面作用利用扫描电子显微镜(SEM)对银溶胶的粒径以及细菌与银溶胶作用后的表面形貌进行表征,结果如图1所示。银溶胶的粒径分布约在70~80 nm(图1A),纳米粒子之间存在一定程度的团聚,有利于“热点”的产生和相应SERS信号的收集。图1B中,细菌的细胞个体呈长1.5~2 μm,宽0.5 μm的短杆状。由插图的局部状态可知,菌体上方及周围分布着大量银纳米颗粒,使得其表面较为粗糙不平整。

图1 银溶胶(A,×1 μm)及细菌与银溶胶混合溶液(B,×20 μm)的SEM形貌图
2.1.2 银溶胶的SERS性能使用罗丹明6G(R6G)作为表征一步法银溶胶SERS性能的探针,向银溶胶中加入不同浓度的R6G后,得到的SERS光谱图如图2所示。结果表明,一步法制备的银溶胶具有良好的SERS增强性能,能够检测到明显SERS信号的R6G探针的浓度低至1.0×10-9mol/L。

图2 一步法银溶胶中加入不同浓度的R6G后的SERS光谱图
2.2 嗜麦芽菌的SERS谱图分析
为了探究嗜麦芽窄食单胞菌的生物结构信息,对其标准菌株(图3A)和临床菌株(图3B)分别进行SERS光谱检测,得到特征指纹谱图。由图可见,10个临床样本的谱峰一致性较高,且与标准菌株的谱图非常接近,反映了嗜麦芽窄食单胞菌表面蛋白质、核酸和脂质等的物质信息。由于病人体液环境不同,分离得到的菌株间存在一定差异,使得特征峰的拉曼位移出现小范围的波动。其中,730/732、959、1 049/1 051、1 331/1 332 cm-1处产生的高强度、尖锐的拉曼谱峰,可作为后续方法学验证的指示波段。
分别制备了浓度为0.01 mol/L的色氨酸、酪氨酸和苯丙氨酸3种会产生特征SERS信号的氨基酸溶液以及腺嘌呤、鸟嘌呤、胞嘧啶和胸腺嘧啶4种DNA碱基溶液作为细菌生物信息谱峰归属的确证标志物,最终得到对比谱图如图3C和图3D所示,结果与参考文献所记录的光谱信号基本一致[17-19]。
由图3C可知,839、878、1 549 cm-1处的拉曼谱峰对应于色氨酸,896、1 137 cm-1处对应于酪氨酸,而1 053 cm-1处则是3种氨基酸的共有峰,对应C—C骨架呼吸振动。1 206、1 246 cm-1处的拉曼谱峰分别对应于酪氨酸和苯丙氨酸,通过查阅文献,推测这两处峰反映了酰胺Ⅲ带的信号[19]。图3D中,628、734和1 333 cm-1处的拉曼谱峰对应于腺嘌呤,1 139、1 635 cm-1处的谱峰对应于胞嘧啶,660 cm-1处的谱峰则包含了鸟嘌呤、胞嘧啶和胸腺嘧啶3种碱基的结构信息。至于957 cm-1和1 053 cm-1处的谱峰,则是DNA碱基的共有峰。其中957 cm-1对应于碱基的脱氧核糖,1 053 cm-1对应于碱基的C—C骨架呼吸振动。1 373 cm-1处的微弱峰反映了碱基(T/A/G)的链振转状态。此外,指纹谱图上还有一些糖类和脂质的信息,但是与它们相关的特征峰信号并没有氨基酸和碱基那么强,根据文献[20-23]对其分别进行归属,18组拉曼特征峰的归属结果如表1所示。
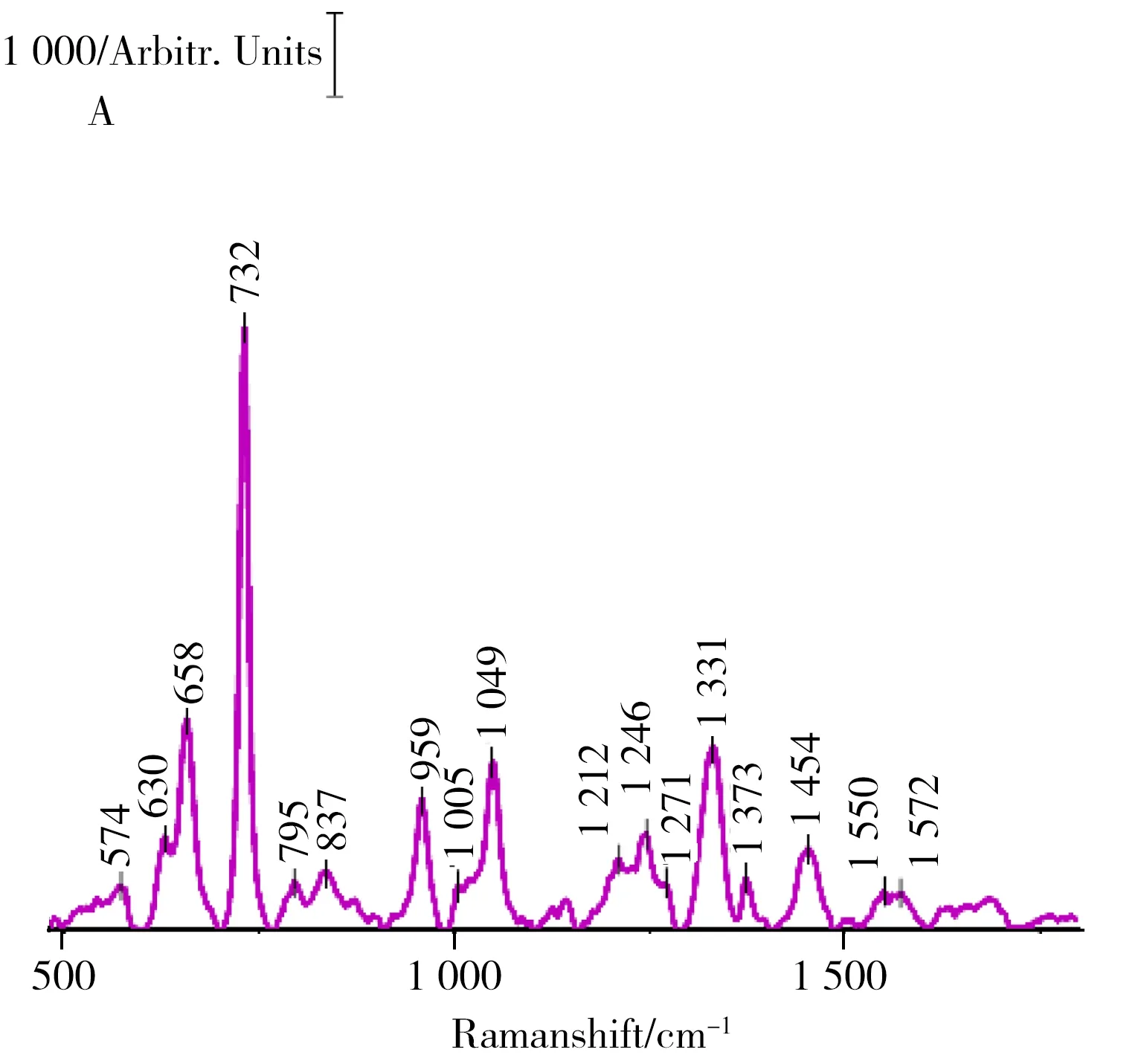
图3 嗜麦芽窄食单胞菌的SERS谱图

表1 嗜麦芽窄食单胞菌SERS谱峰归属表

图4 嗜麦芽窄食单胞菌标准菌株在不同浓度下的SERS谱图

图5 一步法银溶胶检测嗜麦芽窄食单胞菌方法重现性结果图
2.3 方法学验证
2.3.1 灵敏度在临床患者的体液样本中,致病的嗜麦芽窄食单胞菌的浓度往往较低。通过采集标准菌株在不同浓度下的SERS信号发现,当菌液的浓度下降至5×106CFU/mL时,可以观察到730、1 051 cm-1处的特征谱峰;而当浓度进一步下降至2×106CFU/mL时,只有1 051 cm-1处有极其微弱的光谱信号(图4)。因此认为,该方法所检测到的致病菌最低浓度为5×106CFU/mL。常用的病原体检测技术,如MALDI-TOF要求的最低检测浓度为105~106CFU/mL,甚至是107CFU/mL[24]。文献中也曾明确提到[25],只有在浓度≥105CFU/mL时,才能保证可靠的鉴定结果。因此,本方法基本能满足临床需要。
2.3.2 重现性在相同条件下制备了3批银溶胶基底,选择5株嗜麦芽窄食单胞菌临床样本作为检测对象,在相同仪器参数设置下采集拉曼信号,并将上述4组峰信号较强的特征峰730、959、1 051、1 333 cm-1作为指示峰,以评估重现性。结果如图5所示,其相对标准偏差(RSD)为6.8%~16%,基本满足实际分析的要求。
2.3.3 与传统银溶胶的比较本研究将采用传统方法——柠檬酸还原法[26]制备的银溶胶作为比较对象,得到的光谱对比图如图6所示。实验结果表明,传统法制备的银溶胶的SERS增强效果略优于一步法银溶胶,但是这两种基底所形成的嗜麦芽窄食单胞菌的光谱形状基本相同,且特征峰的相对强度差距不大。然而,一步法具有制备速度快、操作简单等独特优势,整个过程仅需10 min,传统的还原法则需60 min左右。因此,一步法银溶胶基底对临床的快速诊断具有更大的应用价值。
2.4 阳性血液样本中嗜麦芽窄食单胞菌的检测
采用4例阳性病人和2例阴性病人血液样本,进一步验证本文方法在临床检测上的可行性。如图7所示,从阳性血液样本中提取到的细菌展示出与纯培养菌株非常相似的拉曼信号,特别是在730、959、1 331 cm-1处,说明4个阳性样本的谱峰基本与纯培养菌株相吻合,阴性样本则没有明显的拉曼特征信号。
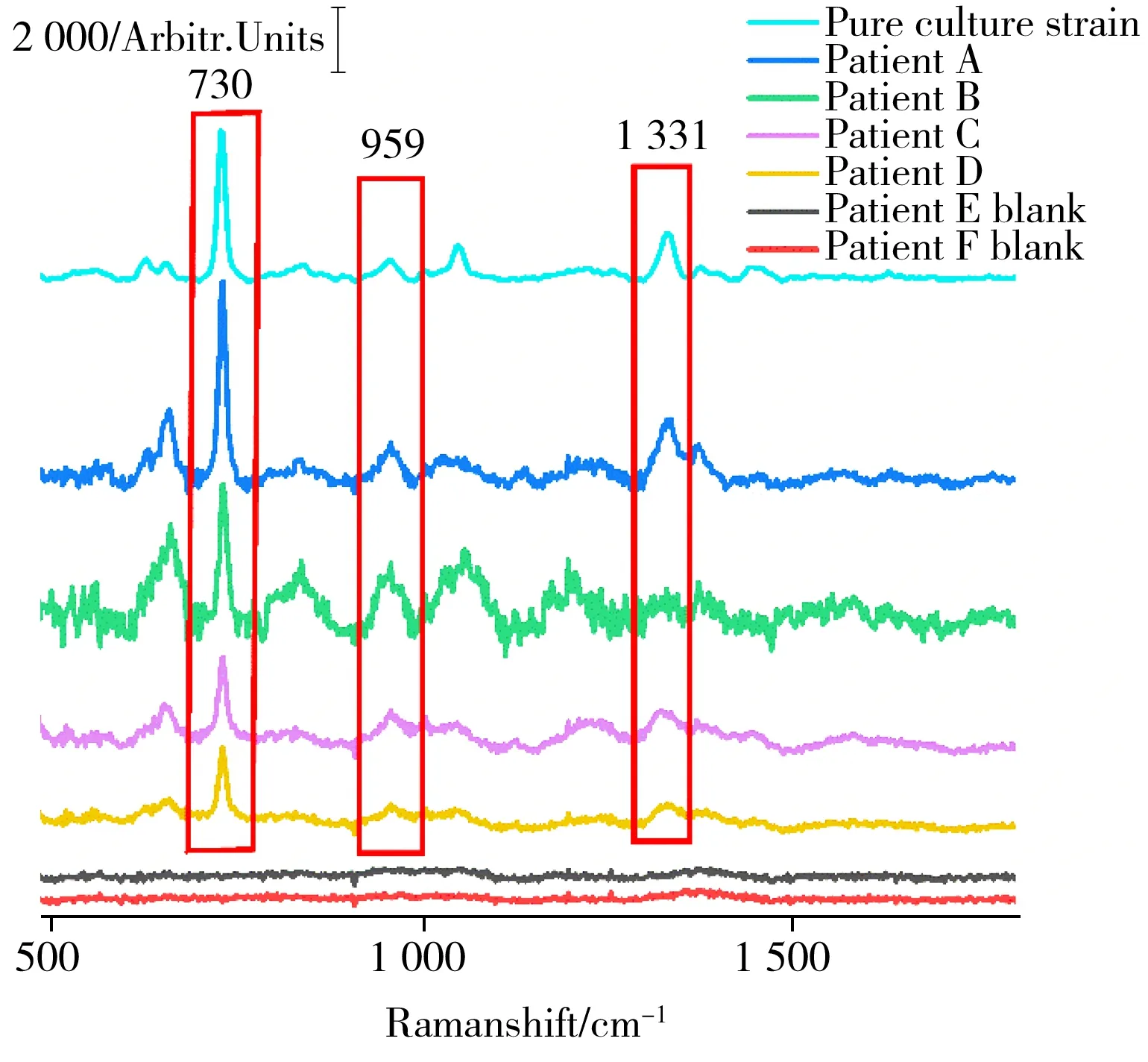
图7 阳性血液样本的SERS光谱图
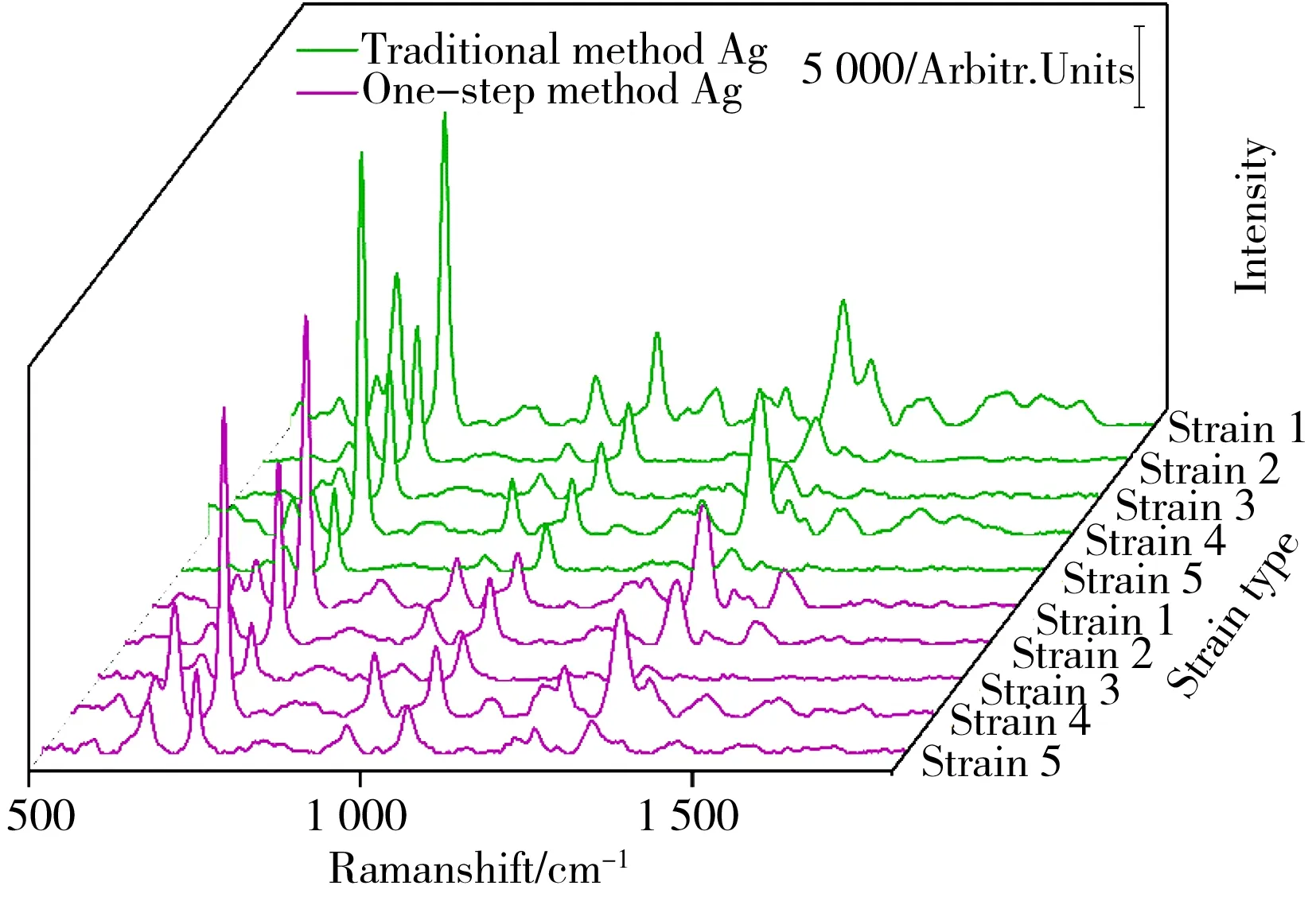
图6 嗜麦芽窄食单胞菌用一步法银溶胶与传统法银溶胶测试的SERS光谱对比图
3 结 论
本研究利用一步法快速合成的银溶胶为基底,对临床上常见的条件致病菌嗜麦芽窄食单胞菌进行SERS检测,得到的阳性血样中嗜麦芽窄食单胞菌的拉曼谱图与纯培养菌株相似,证明本方法有望作为检测病人体液中致病菌的临床手段。本方法耗时短、操作简便、仪器便携且成本较低,在医院及检验检疫中心进行现场快速诊断方面具有应用推广价值。