不同类型探针对免疫层析方法的分析灵敏度影响研究
2021-03-25马嘉琪姚晓琳刘思杰殷雪驰毕鹏飞王建龙张道宏
马嘉琪,姚晓琳,刘思杰,殷雪驰,毕鹏飞,王建龙,张道宏
(西北农林科技大学 食品科学与工程学院,陕西 杨凌 712100)
免疫层析法具有操作简单、快速、经济、不依赖仪器和专业人员等独特优势[1-3],广泛用于临床医学[4-5]、环境监测[6-7]及食品安全[8-9]等领域的现场快速监测。信号探针是免疫层析方法中最重要的组成之一,也是影响方法灵敏度的最重要因素之一。对于小分子化合物的免疫层析检测,采用竞争抑制原理。传统的免疫层析方法中信号探针指的是纳米材料标记的检测抗体,但其灵敏度不高,这是因为:①传统探针中,由于标记纳米材料而产生的空间位阻效应阻碍了检测抗体上部分抗原结合位点对抗原的结合作用,导致检测抗体对样品中游离小分子半抗原的浓度响应不够灵敏;②在基于传统探针的竞争抑制免疫层析分析中,分析反应的信号强度与所应用的检测抗体浓度呈正相关,为获得足够的信号强度,检测抗体的用量也随之增加,不利于竞争反应的进行[10-11];③与游离的抗体相比,标记了纳米材料的抗体生物活性和布朗运动受到抑制[12]。免疫层析方法中用以提供信号的纳米材料除最常用的胶体金[13-14]外,还有量子点[15-16]、磁性纳米材料[17-18]、碳纳米管[19]、石墨烯[20]、乳胶微球纳米材料[21]和纳米复合材料[22]等。与胶体金标记材料相比,磁性纳米材料(Fe3O4)具有优异的光学性质[23],还具有强烈磁性[24],可进行磁性分离,且合成方法简单,是一种理想的标记材料。
雌二醇是一种典型的天然雌性激素[25],是环境内分泌干扰性物质的重要组成部分。17β-雌二醇(17β-Estradiol,17β-E2)是与动物繁殖相关最具活性的天然性激素之一,被广泛用于畜禽养殖业以促进机体生长和提高生产性能[26]。但17β-雌二醇化学性质稳定,且在动物体内无特定的代谢系统,因此17β-雌二醇及其衍生物易通过食物链在生物体内蓄积。研究表明,从外界摄入过量的17β-雌二醇会使人体激素平衡发生紊乱[27],导致儿童性早熟[28],甚至影响女性生育并引发卵巢癌等疾病[29],同时也会增加男性患前列腺癌的风险,严重威胁消费者健康。因此,研究建立一种食品中17β-雌二醇的快速检测方法具有十分重要的意义。
本研究采用磁性纳米材料分别标记检测抗体和第二抗体,作为传统探针和间接探针,又将传统探针和间接探针按照一定比例组合成配对探针。为探究不同类型探针对免疫层析方法分析灵敏度的影响,以17β-雌二醇为检测目标物,分别建立了基于此3种探针的17β-雌二醇的竞争免疫层析分析方法,比较了三者的检测灵敏度,其中间接探针和配对探针的使用刷新了传统方法中信号探针必须是信号材料标记检测抗体所制备的认知,可为其他对灵敏度要求较高且追求简单的免疫层析方法提供借鉴。
1 实验部分
1.1 试剂与仪器
17β-雌二醇标准品、孕酮标准品、睾酮标准品、雌酮标准品、1-乙基-3-(3-二甲基氨基丙基)碳二酰亚胺(EDC)、正羟基琥珀酰亚胺(NHS)均购于Sigma-Aldrich化学试剂公司;牛血清白蛋白(BSA)、二甲基亚砜(DMSO)购自MP Biochina公司;17β-E2-BSA偶联物购自龙岩生物有限公司;17β-雌二醇单克隆抗体(17β-E2-mAb)为实验室自制;羊抗鼠IgG(H+L)多克隆抗体(pAb)购自洛阳宝通实验材料中心;醋酸钠、二水合柠檬酸三钠、四硼酸钠、蔗糖和六水合三氯化铁购自国药集团化学试剂有限公司;乙二醇购自成都科隆化学试剂有限公司;以上试剂均为分析纯,实验用水为超纯水。
UV-2550紫外可见分光光度计(日本岛津公司);Vetex70傅里叶变换近红外光谱仪(德国布鲁克公司);JEM-1230透射电子显微镜(日本JEOL公司);HGS510-2-D点膜仪(杭州峰航科技有限公司);HGS-201切条机(杭州峰航科技有限公司);DGG-9030B电热恒温鼓风干燥箱(上海森信仪器公司);EOS M2Canon数码相机(日本佳能公司);HC-3018R高速冷冻离心机(安徽中科中佳科学仪器有限公司);JT-D高速组织均质机(漯河市金田试验设备研究所);VORTEX GENIUS 3涡旋振荡器(德国IKA公司)。
1.2 Fe3O4磁性纳米材料(MNPs)的合成
采用一步水热法合成带有羧基的水溶性Fe3O4磁性纳米材料(MNPs),具体合成过程如下:将0.675 g的六水合三氯化铁和0.245 g二水合柠檬酸三钠溶于20 mL乙二醇中,磁力搅拌1 h,再加入1.2 g醋酸钠继续搅拌30 min,随后将混合物转入反应釜并置于200 ℃烘箱中加热10 h,待反应釜自然降温后打开,所得混合物用无水乙醇和超纯水分别清洗3次,最后放入60 ℃真空干燥箱中干燥,获得的棕色产物即为合成的MNPs,收集至离心管中,密封备用。
1.3 Fe3O4标记探针的制备
首先采用间接ELISA和间接竞争ELISA鉴定抗体的分析性能,然后采用EDC/NHS交联法将17β-E2-mAb和羊抗鼠pAb分别修饰在MNPs上。将MNPs材料用蒸馏水稀释成1 mg/mL的棕黄色溶液,按照每1 mL MNPs材料中加入1 mg EDC和0.6 g NHS的比例对MNPs进行活化,涡旋溶解,在37 ℃下于220 r/min摇床中孵育30 min。磁性分离活化的MNPs,用硼酸缓冲液清洗,除去多余的EDC和NHS。用0.02 mol/L硼酸溶液(pH 6.6)重悬清洗后的功能化MNPs材料。然后加入1 mg/mL的抗17β-E2单克隆抗体或羊抗鼠多克隆抗体溶液,将混合物在 37 ℃下孵育1 h,磁性分离,去除上清液。在磁性标记物中加入1 mL含1%BSA的pH 6.6硼酸缓冲液,37 ℃反应1 h,对MNPs表面的空余位点进行封闭。将封闭好的磁性纳米探针用硼酸缓冲溶液洗涤2次,再用含5%蔗糖、1% BSA的硼酸缓冲液重悬至原体积的1/10,置于4 ℃冰箱中备用。其中,MNPs标记的抗17β-E2单克隆抗体为传统探针,MNPs标记的羊抗鼠多克隆抗体为间接探针,由两者组成的混合探针为配对探针。
1.4 免疫层析试纸条的组装
试纸条由样品垫、硝酸纤维素膜(NC膜)和吸水垫组成,制备过程如下:首先将样品垫在封闭缓冲液中完全浸湿,于37 ℃下干燥过夜;再利用点膜仪将0.5 mg/mL的抗原17β-E2-BSA和1 mg/mL的羊抗鼠多克隆抗体溶液以0.5 μL/cm的速率分别均匀喷划在NC膜上,形成检测线(T线)和质控线(C线),室温下干燥30 min;之后将NC膜、样品垫和吸水垫依次贴至衬板上,不同部位之间互相重叠约2 mm,最后用切条机切成3 mm宽的试纸条,保存于干燥环境中备用。
1.5 不同探针类型的免疫层析方法分析性能鉴定
将17β-E2标准品用DMSO溶解并稀释至100 μg/mL作为储备液,再用0.01 mol/L磷酸盐缓冲液(PBS,pH 7.4)将储备液分别稀释成0.1~40 ng/mL系列质量浓度的待检溶液,每种免疫层析方法7个浓度,并以PBS为阴性空白对照。7个浓度样品溶液分别取100 μL加入1.5 mL PE管中,再加入适量传统探针溶液或抗17β-E2单克隆抗体及间接探针溶液或配对探针溶液,混合均匀,滴加至试纸条样品垫,免疫层析反应10 min后肉眼观察结果。每个浓度重复3次,最后对试纸条进行拍照记录,采用ImageJ软件分析T线的光密度值。
1.6 食品中17β-雌二醇的免疫层析检测
采用鸡肉和牛奶样品的添加回收实验对所建立的3种免疫层析法进行评估,首先进行样品前处理。鸡肉样品:取空白样品用高速组织均质机搅碎,精密称取1.0 g均质的鸡肉样品于9个离心管中,标记序号为0~8#,各其中添加适量17β-雌二醇标准溶液并使之终浓度为0.2、0.4、1、2、4、10、16、20 ng/g。在0#离心管中加入相同体积的PBS对照品溶液,涡旋,充分混匀,将9个离心管于4 ℃放置过夜。次日,分别在9个离心管中加入2 mL PBS,涡旋,充分与样品混合,超声5 min,于10 000 r/min离心5 min,收集上清液,待测。
牛奶样品:取18 mL牛奶于4 ℃条件下以12 000 r/min离心15 min,去除上层脂肪。取5 mL脱脂牛奶,加等体积PBS溶液稀释至10 mL,将稀释好的牛奶样品加入9个离心管中,每管1 mL,分别添加适量17β-雌二醇标准溶液,使其在牛奶中的终浓度为0.4、0.8、2、4、8、20、32、40 ng/mL,充分涡旋混匀,静置2 h,作为待检溶液。分别取100 μL鸡肉和牛奶待检溶液加入1.5 mL离心管中,将所选出的最佳17β-雌二醇试纸条插入混合溶液中,反应10 min,肉眼观察结果。每个浓度重复3次,最后对试纸条进行拍照记录。
2 结果与讨论
2.1 MNPs的合成鉴定
本研究所采用的MNPs标记材料为羧基化的Fe3O4,采用扫描电子显微镜(SEM)观察MNPs形貌(图1A),并采用傅里叶变换近红外光谱仪对其进行红外光谱扫描(图1B)。结果显示,制备的MNPs呈现粒径较均一的单分散球形,形貌较好;在540 cm-1处观察到Fe—O峰,在 1 654 cm-1和1 384 cm-1处的特征峰为羧基拉伸振动所致[30],3 377 cm-1处为—OH的特征峰[31]。表明羧基化的Fe3O4纳米材料合成成功,且稳定性较好。
2.2 抗17β-雌二醇抗体的性能分析
将17β-E2-BSA完全抗原包被在酶标板上,采用竞争酶联免疫吸附分析(ELISA)对不同质量浓度(0、0.05、0.15、0.5、1、2 ng/mL)17β-雌二醇标准溶液进行分析,并绘制竞争抑制曲线,以半数抑制浓度(IC50)来表示竞争ELISA的检测灵敏度。结果显示,抗体对17β-雌二醇标准品的灵敏度可达0.168 ng/mL(R2=0.998 1);为评估该抗体对17β-雌二醇检测的特异性,以20~50倍17β-雌二醇浓度的雌激素类孕酮(PRG)、睾酮(T)和雌酮(E1)为干扰物,3种干扰物标准品均采用0、2.5、5、10、20、40 ng/mL 6个浓度,17β-E2采用0、0.05、0.15、0.5、1、2 ng/mL 6个浓度,与17β-E2-BSA开展竞争反应。结果显示,抗体与3种高浓度雌激素干扰物基本不反应,交叉反应率均小于1%。因此,本研究中所用抗体对17β-雌二醇具有较高的灵敏度和特异性,作为核心试剂,高质量的抗体能够为后续17β-雌二醇免疫层析方法的建立奠定坚实的材料基础。

图2 MNPs、传统探针和间接探针的紫外扫描光谱图
2.3 探针的合成鉴定
利用紫外可见吸收光谱对MNPs材料、传统探针和间接探针进行表征(图2)。结果显示,单纯的MNPs在紫外可见区域未见吸收峰,但结合了17β-E2-mAb和pAb的2种探针(MNP-mAb和MNP-pAb)在280 nm处均出现了吸收峰,由此证明,传统探针和间接探针均已成功制备[32]。而配对探针由传统探针和间接探针组成,采用同样的标记方法,仅标记时的参数不同。
2.4 3种免疫层析分析方法的参数优化
实验优化了传统、配对和间接3种探针的主要参数,结果发现传统探针中17β-E2-mAb的最佳标记量为7 μg/mL;配对探针由MNP-pAb和MNP-mAb组成,17β-E2-mAb和pAb的最佳标记量均为5 μg/mL;间接探针中pAb的最佳标记量为14 μg/mL。将MNPs标记的抗体溶液浓缩10倍后用于免疫层析分析,每根试纸条上探针的用量设为2 μL,其中配对探针中MNP-pAb和MNP-mAb的最佳配比为3∶7,即MNP-pAb和MNP-mAb的最佳用量分别是0.6 μL和1.4 μL。基于传统探针、配对探针和间接探针的试纸条,每根试纸条上17β-E2-mAb的消耗量分别为140、70、10 ng,由此可见,基于配对探针和间接探针两种新型探针的免疫层析方法对抗17β-E2单克隆抗体的消耗量明显降低。小分子化合物的免疫层析检测采用竞争原理,有限量的检测抗体是竞争分析的核心要素,间接探针方法中对检测抗体消耗量的降低,不仅能够降低分析的成本,还有助于灵敏度的提高。
2.5 3种免疫层析方法的分析灵敏度
2.5.1 原理分析本研究设计的试纸条结构不同于传统试纸条,仅由样品垫、NC膜及吸水垫三部分组成(图3A),样品溶液和探针或抗体的混合溶液作为检测溶液,以弱阳性样品为例,研究了传统、间接、配对免疫层析试纸条的分析原理。由图可见,检测溶液滴加在传统探针试纸条上后(图3B),溶液中的游离17β-E2小分子首先与MNP-mAb传统探针结合,当溶液层析至检测线时,与小分子结合达到饱和的探针分子(MNP-mAb-17β-E2)由于不能再结合T线上的17β-E2-BSA抗原,继续向前层析泳动,到达C线,与包被在其上的羊抗鼠多抗结合而被截留在C线上显色;而未与游离17β-E2结合达到饱和或未与游离17β-E2结合的探针分子则在T线与固定在其上的17β-E2-BSA结合而被截留显色。检测溶液滴加在基于配对探针的试纸条上后(图3C),溶液中的游离17β-E2小分子首先与MNP-mAb结合,同时由于mAb和羊抗鼠多抗的特异性结合作用,MNP-mAb与MNP-pAb结合,使得向前层析泳动的溶液中至少包含MNP-mAb-17β-E2、MNP-pAb-MNP-mAb-17β-E2、MNP-pAb-MNP-mAb 3种复合物,同样的,与游离17β-E2小分子结合达到饱和的MNP-mAb-17β-E2或MNP-pAb-MNP-mAb-17β-E2复合物不能被T线截留,继续向前泳动,在质控线处,因复合物中暴露在外的mAb被C线上的pAb结合,复合物被截留而显色;而未与游离17β-E2达到饱和结合的复合物或未与游离17β-E2结合的MNP-mAb、MNP-pAb-MNP-mAb则与T线上的17β-E2-BSA结合显色;在此过程中,由于一个MNP-mAb探针可以结合多个MNP-pAb,而暴露在外的MNP-pAb又可以再与其他的MNP-mAb探针结合,从而形成复杂的网络结构,使得大量MNPs信号颗粒聚集,加深检测线的颜色,起到了信号放大的作用。当检测溶液滴加在基于间接探针的试纸条上时(图3D),溶液中的游离17β-E2小分子首先与游离mAb结合,同时由于一抗二抗的特异性结合作用,mAb又与MNP-pAb结合,使得溶液中至少存在MNP-pAb-mAb-17β-E2、MNP-pAb-mAb 2种复合物,其中MNP-pAb-mAb被T线上的17β-E2-BSA结合显色,而MNP-pAb-mAb-17β-E2复合物因不能再结合T线上的17β-E2-BSA,继续向前泳动。由于所采用羊抗鼠多克隆抗体为“H+L”型混合物,既能结合mAb分子的重链(H链),也能结合mAb分子的轻链(L链),当MNP-pAb-mAb-17β-E2复合物溶液达到C线后,mAb分子上未被结合的重链或轻链被C线上的pAb结合,从而使得MNP-pAb-mAb-17β-E2截留在C线上显色,在此过程中由于一个mAb可同时结合多个MNP-pAb探针,从而也具有信号放大作用。

图3 试纸条结构(A)及传统(B)、配对(C)、间接探针(D)免疫层析方法的分析原理示意图
2.5.2 分析性能采用间接探针、配对探针和传统探针3类试纸条分别对0~5、0~20、0~40 ng/mL的17β-E2标准溶液进行分析,以能够使试纸条的T线颜色明显比阴性对照浅时的最小17β-E2浓度作为可视化检出限(Visual limit of detection,vLOD),以能够使试纸条T线颜色完全消失时的最小17β-E2浓度为视觉截止值(Visual cut-off),结果见图4。由图可见,间接探针、配对探针、传统探针3种免疫层析方法的vLOD分别为0.2、0.5、1 ng/mL,视觉截止值分别为5、10、30 ng/mL。另外,基于间接探针和配对探针的免疫层析方法,在0~0.5 ng/mL范围内,其检测线的光学强度值与17β-雌二醇的浓度成反比,其相关系数和线性关系方程式见图4B和4D;对于基于传统探针的免疫层析方法,在0~1 ng/mL范围内,其检测线的光学强度值与17β-雌二醇的浓度成反比,相关系数和线性关系方程式见图4F。通过比较检出限可知,基于间接探针的免疫层析方法灵敏度最高,而基于传统探针的免疫层析方法灵敏度最低。另外,在竞争免疫分析中,检测抗体的使用量直接影响分析的灵敏度,抗体用量越少,则游离小分子目标物和固向化抗原对抗体分子上有限抗原结合位点的竞争越激烈,方法对目标化合物浓度的响应敏感度也越高,此结果与“2.4”所述抗17β-E2单克隆抗体的消耗量完全对应。配对探针比传统探针的灵敏度提高主要归因于两个方面:①由于一抗和二抗的结合作用,以及一个MNPs颗粒上能同时结合多个抗体,MNP-pAb、MNP-mAb两个探针互相结合形成网络结构,具有信号放大作用;②达到同样的信号强度,配对探针相比仅靠MNP-mAb提供信号的传统探针,能够降低MNP-mAb的用量,相应的降低检测抗体用量,激发更激烈的竞争反应。间接探针相比配对探针灵敏度的提高主要原因归因于mAb是游离的抗体分子,而游离抗体分子的使用至少有两个优势:①避免了因标记MNPs颗粒所带来的位阻效应,使17β-E2分子能够和mAb分子更好的结合;②在传统探针和配对探针中,因一个MNP颗粒上能够同时结合多个mAb分子,在检测溶液未达到T线前,已与17β-E2结合但未达到饱和的MNP-mAb探针可继续与T线上的17β-E2-BSA结合显色,从而降低了17β-E2的竞争效率。而在间接探针方案中,由于mAb处于游离状态,可最大程度地提高17β-E2的竞争效率,从而提高对17β-E2浓度的响应敏感性。其次,本研究采用的羊抗鼠多克隆抗体中既含有能结合mAb分子H链的pAb,也含有能结合mAb分子L链的pAb,一个mAb分子能同时结合多个MNP-pAb探针,使得间接探针亦具有一定的信号放大作用,显著提高了分析的敏感性。由此可见,与传统探针相比,配对探针更具优势;而与配对探针相比,间接探针更具优势,相应实验结果与原理分析中的理论分析具有一致性。
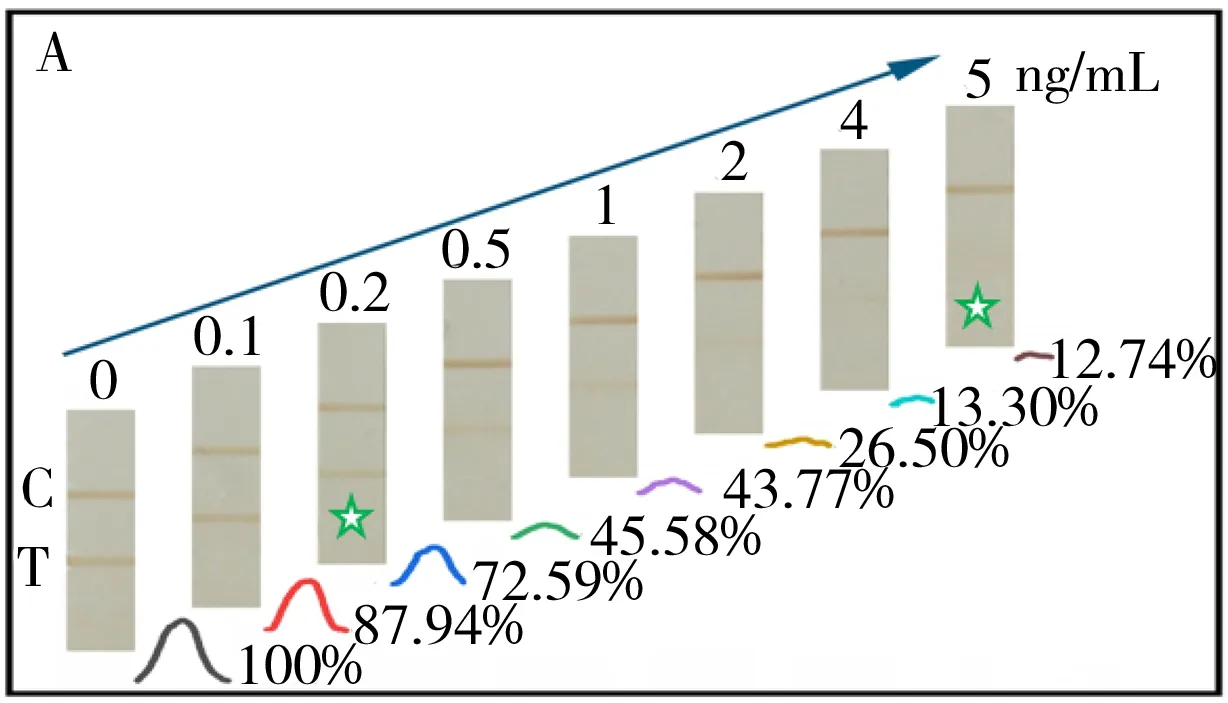
图4 基于间接(A、B)、配对(C、D)和传统探针(E、F)免疫层析方法的分析灵敏度结果及性能分析
2.6 食品中17β-雌二醇的检测
取100 μL处理好的鸡肉和牛奶样品溶液,采用间接探针免疫层析试纸条检测。结果显示,间接探针试纸条对牛奶和鸡肉样品检测溶液中17β-雌二醇的检出限分别为0.2 ng/mL和0.5 ng/g,与测定17β-雌二醇标准溶液的检出限(0.2 ng/mL)相当或略高,这是因为食品中复杂的基质效应(如蛋白质、血红蛋白、脂肪等)影响了试纸条的分析性能。经过换算,间接探针试纸条对牛奶和鸡肉样品中17β-雌二醇的检出限分别为0.4 ng/mL和1.0 ng/g(图5),符合国家出入境检验检疫行业标准SNT4892-2017[33]中对牛奶和鸡肉中17β-雌二醇的检出限要求(均为1.0 μg/kg,相当于1.0 ng/g),且间接探针试纸条具有普适性,只需更换检测抗体和目标物,即可将制备好的MNP-pAb探针应用于更多的检测体系中。
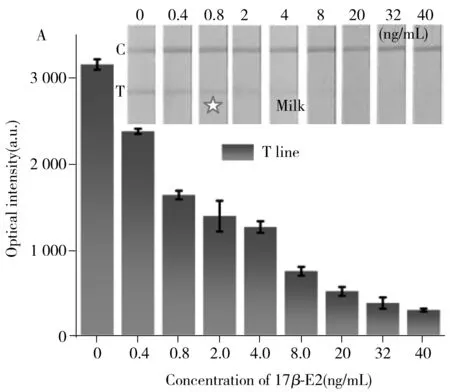
图5 间接探针免疫层析试纸条对牛奶(A)和鸡肉(B)中17β-雌二醇的检测结果
3 结 论
本研究采用磁性纳米材料标记检测抗体和第二抗体,制备了传统、间接和配对3种不同类型的探针,分别建立了17β-E2的免疫层析快速检测方法。结果显示,基于间接探针的免疫层析方法对17β-E2的检测灵敏度最高,其可视化检出限达0.2 ng/mL。此外,相比传统探针和配对探针,间接探针对检测抗体的消耗量最低。间接探针不但能够显著降低分析成本,提高灵敏度,还具有普适性,只需更换检测抗体和目标物,即可将制备好的MNP-pAb探针应用于更多的检测体系中。因此,间接探针免疫层析方法将具有巨大的推广潜力和应用前景。
