一种未知真菌性叶斑病发病烟叶真菌群落分析
2021-03-24向立刚汪汉成郑苹蔡刘体余知和
向立刚 汪汉成郑苹 蔡刘体 余知和

摘 要:为了解贵州省福泉市一未知烟草叶斑病的病原,采用Illumina Miseq高通量测序技术分析了健康与发病烟叶真菌群落结构与多样性差异。结果表明,烟叶发病后叶际真菌群落结构改变,丰富度与多样性降低。发病烟叶真菌群落Sobs指数、Ace指数、Chao1指数和Shannon指数整体低于健康烟叶,Simpson指数整体高于健康烟叶。差异显著性分析表明,健康烟叶组样品真菌群落数在纲(p=0.027)、目(p=0.035)、科(p=0.026)、属(p=0.021)、种(p=0.029)和OTU(p=0.038)水平均显著高于发病烟叶组样品。Students t 检验结果表明,Boeremia属、红酵母属Rhodotorula和Unclassified_c_Dothideomycetes属在健康烟叶与发病烟叶中相对丰度均存在显著性差异。其中发病烟叶中Boeremia为最优势菌属,健康烟叶中红酵母属为最优势菌属。推测该未知真菌性烟草叶斑病可能是由Boeremia属真菌导致。
关键词:烟草叶斑病;真菌病害;Illumina高通量测序;叶际真菌群落
Abstract: In order to identify the pathogen of an unknown fungal tobacco leaf spot disease in Fuquan City, Guizhou Province. Illumina Miseq high-throughput sequencing technology was used to analyze the differences of fungal community structure and diversity between healthy and diseased tobacco leaves. The results showed that after tobacco leaves were infected by this disease, the fungal community structure changed, and the fungal community richness and diversity decreased. Sobs index, Ace index, Chao1 index and Shannon index of the fungal community in diseased tobacco leaves were lower than that of healthy tobacco leaves, while Simpson index was higher than that of healthy tobacco leaves. Notability analysis showed that fungal community of healthy tobacco group was significantly higher than that of diseased tobacco group in class (p = 0.027), order (p = 0.035), family (p = 0.026), genus (p = 0.021), species (p = 0.029) and OTU (p = 0.038). The results of Students t test showded that the relative abundance of Boeremia, Rhodotorula and Unclassified_c_Dothideomycetes were significantly different in healthy and diseased tobacco leaves. Among them, Boeremia was the most dominant genus in the diseased tobacco leaves, and Rhodotorula was the most dominant genus in the healthy tobacco leaves. It is speculated that the unknown fungal leaf spot of tobacco may be caused by Boeremia.
Keywords: tobacco leaf spot disease; fungal diseases; illumina high-throughput sequencing; phyllosphere fungal community
作为一种以收获叶片为目的的经济作物,烟草叶斑类病害的防治在烟草病虫害防治中占据重要地位。每年因各类叶斑病害对烟草行业造成的经济损失高达数亿元。2019年7—8月,贵州省福泉市烟区大面积爆发一种烟草叶斑病,据不完全统计该病害为害面积高达80 hm2。病害发生初期叶片上首先出现黄褐色小斑点,随后发展成为圆形或者近圆形的褐色斑点[1],初期发病症状与烟草赤星病高度相似,但是发病后期无同心轮纹的特点又不同于赤星病。为进一步确定发病原因以采取针对性措施,有必要對其病原菌进行鉴定。
目前对于病原菌的鉴定较为常用的是以柯赫氏法则为核心的传统分离培养法[2-3],但其只适用于病原菌为可培养菌群且为一菌一病的病害鉴定,而不适合由不可培养病原菌或多种病原菌复合侵染引起的病害鉴定。目前可培养微生物只占自然界全部微生物的1%左右[4],而能够致病的可培养病原微生物比例则更低,因此传统分离培养法在不可培养致病菌的鉴定上缺乏优势。相较传统分离技术,高通量测序技术可直接鉴定出不同微生态环境中的绝大多数微生物,且试验周期更短。目前将高通量测序技术运用到植物病害微生态的研究也越来越多,如罗路云等[5]研究发现南瓜白粉病菌可以改变南瓜叶际细菌群落结构,随着南瓜白粉病病情等级的增加,其叶际细菌群落多样性指数呈先降后增的趋势。尹淑丽等[6]研究表明黄瓜喷施枯草芽孢杆菌发酵液可有效抑制黄瓜叶际真菌数量。刘畅等[7]发现烟株感赤星病后烟叶上主要优势真菌为赤星病病原菌链格孢属。此类研究表明叶斑类病害的出现往往伴随着叶片微生物群落失衡、有益菌丰度降低、病原菌大量增殖成为优势菌群等现象。通过分析发病叶片微生物丰度的增减,可推测与病原菌存在协同或拮抗作用的微生物群体,为病害的生物防治提供参考。
本研究运用高通量测序技术,旨在明确该叶斑病是否为链格孢真菌引起的烟草赤星病,并探明病害发生所引起的烟叶真菌群落结构变化情况以及健康与发病烟叶中据有统计学差异的生物学标识,以期为该病害的防治提供理论依据。
1 材料与方法
1.1 样品采集
2019年8月于贵州省福泉市严重爆发未知叶斑病的烟田进行采样(种植品种K326)。在烟田中随机选取3株发病严重的烟株,每株上采集典型发病叶片和未见症状的健康叶片各一片。用经75%酒精消毒的剪刀剪取叶片上的病斑,同时采集健康叶片相同部位的叶肉作为对照。发病组(XB)3个样本的编号分别为XB1、XB2和XB3,健康组(XJ)3个样本的编号分别为XJ1、XJ2和XJ3。
1.2 DNA提取及目标片段PCR扩增
称取0.5 g烟叶样品,采用植物组织DNA试剂盒(Qiagen, 69104)提取总DNA,具体步骤按其操作说明进行。提取出的DNA采用超微量分光光度计NanoDrop 2000检测其浓度与纯度。检测合格的DNA用于目标片段ITS1区的扩增,扩增引物为ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2R(5'-GCTGCGTTCTTCATCGATGC-3'),PCR扩增体系与反应程序参考向立刚等[8]的方法。扩增成功的样品送至上海美吉生物医药科技有限公司进行Illumina Miseq高通量测序,测序后的生物信息学分析均在美吉I-Sanger生信云平台(http://www.i-sanger.com/project/index.html)完成。
2 结 果
2.1 序列数据质控及OTU聚类分析
稀释曲线(Rarefaction curve)展示了不同样品间多样性的差异,用于检查测序结果是否合理。横坐标为该样本的测序Reads数。本试验中6个样本的稀释曲线在样本Reads数为30 000时就趋于平缓(图1),表明测序趋于饱和,测序深度覆盖到样品中绝大多数的物种,足以反映样品中真菌的实际组成情况。
本试验中6个样本共得到212 043条高质量序列片段,50 653 810个碱基,单一样本序列数在31 890~39 974条之间,序列平均长度为239 bp。发病烟叶3个样本共得到101 379条高质量序列片段,23 873 339个碱基,单一样本序列数在32 204~35 746条之间,序列平均长度为236 bp。健康烟叶3个样本共得到110 664条高质量序列片段,26 780 471个碱基,单一样本序列数在31 890~39 974条之间,序列平均长度为242 bp。
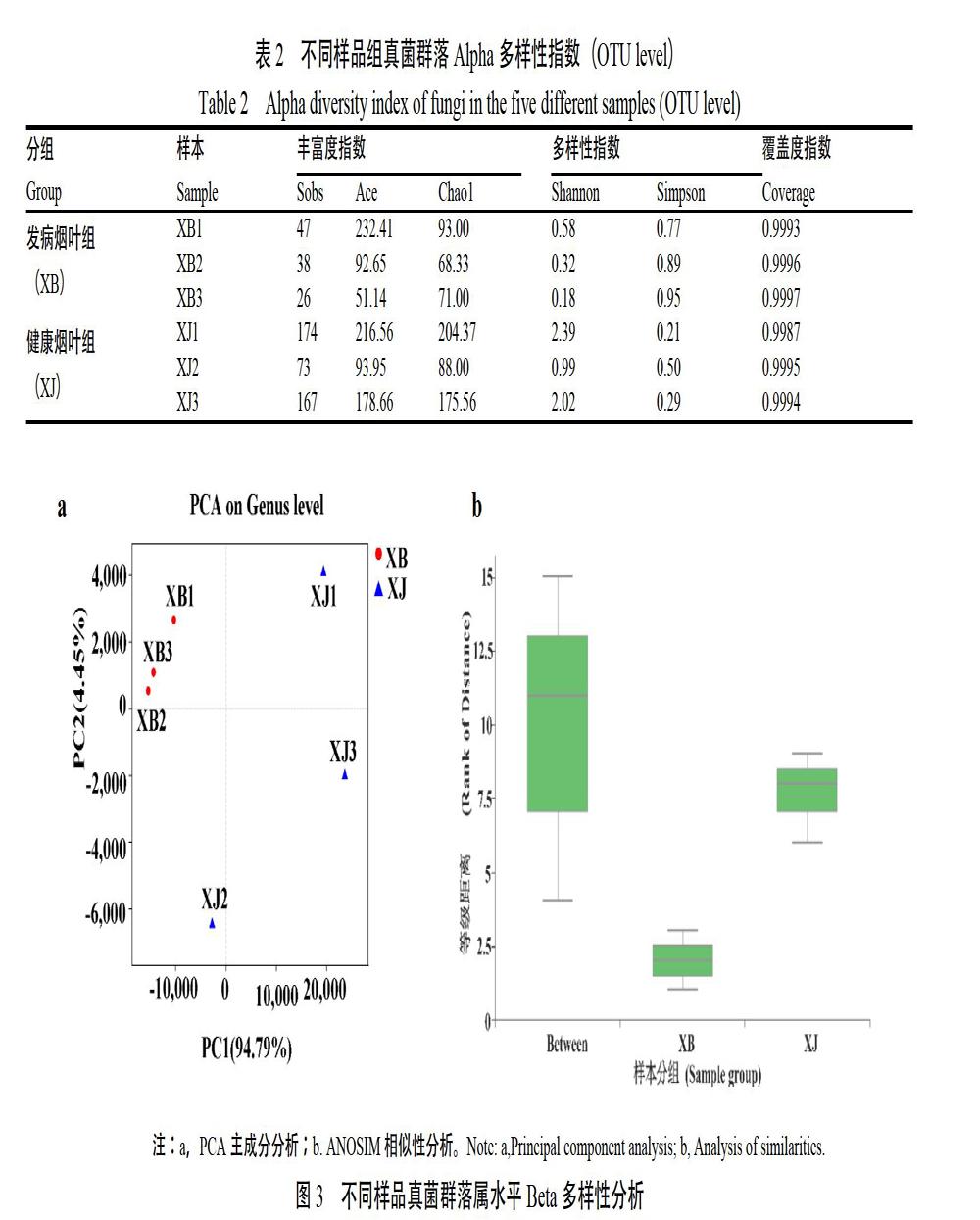
在97%的相似度水平对样品序列进行OTU聚类(表1),结果表明,发病烟叶样本共鉴定到真菌4个门,13个纲,22个目,31个科,43个属,52 个种,66个OTU;健康烟叶样本共鉴定到真菌5个门,23个纲,47个目,78个科,122个属,164个种,252个OTU。健康烟叶真菌群落数除门水平外(p=0.678),在纲(p=0.027)、目(p=0.035)、科(p=0.026)、属(p=0.021)、种(p=0.029)和OTU(p=0.038)水平上均显著高于发病烟叶。
2.2 真菌群落基本组成及多样性分析
2.2.1 群落基本组成分析 样本真菌群落组成结果表明(图2),发病烟叶组样本中Boeremia为最优势菌属,在XB1、XB2和XB3中的相对丰度分别为87.73%、94.48%和97.30%。XB1中相对丰度大于1%的物种还有Unclassified_f_Mycosphaerellaceae(6.53%)、红酵母属Rhodotorula(2.22%)和茎点霉属Phoma(1.52%);XB2中相对丰度大于1%的还有茎点霉属(1.73%)和链格孢属Alternaria(1.98%),XB3中Unclassified_f_Incertae_sedis_o_Pleosporales相对丰度为1.57%。健康烟叶组样本XJ1中相对丰度大于1%的物种有红酵母属(41.78%)、Unidentified_c_Exobasidiomycetes(11.14%)、掷孢酵母属Sporobolomyces(9.01%)、Unclassified_f_Incertae_sedis_o_Pleosporales(5.35%)、茎点霉属(5.61%)、Boeremia(5.06%)、Tilletiopsis(3.77%)、Unclassified_f_Davidiellaceae(3.25%)、Unclassified_f_Mycosphaerellaceae(2.66%)、Unclassified_c_Dothideomycetes(2.53%)、Stagonosporopsis(2.39%);XJ2中相對丰度大于1% 的物种有Boeremia(64.05%)、红酵母属(30.66%)、Unclassified_f_Incertae_sedis_o_Pleosporales(1.31%);XJ3中相对丰度大于1%的物种有:红酵母属(51.51%)、漆斑菌属Myrothecium(8.59%)、茎点霉属(8.45%)、掷孢酵母属(7.12%)、Unclassified_f_Davidiellaceae(4.39%)、Stagonosporopsis(3.59%)、Unclassified_f_Incertae_sedis_o_Pleosporales(3.31%)、Unidentified_c_Exobasidiomycetes(2.91%)、Unclassified_f_Mycosphaerellaceae(1.67%)、Unclassified_c_Dothideomycetes(1.51%)、高氏白粉菌属Golovinomyces(1.57%)。
2.2.2 Alpha多样性分析 各样本Alpha多样性指数见表2,健康烟叶组样本真菌的丰富度指数中Chao1指数(p=0.094)高于发病烟叶组样本,Sobs指数(p=0.038)显著高于发病烟叶组样本,Ace(p=0.597)指数中除发病烟叶XB1样本的指数高于同株的健康烟叶XJ1样本外,其余两样本的Ace指数均低于同株健康烟叶样本,此结果表明健康烟叶样本的真菌群落丰富度整体高于发病烟叶样本真菌群落。多样性指数中健康烟叶样本的Shannon指数均高于发病烟叶组(p=0.300),Simpson指数显著低于发病烟叶组(p=0.006),表明健康烟叶组真菌群落多样性高于发病烟叶组。
2.2.3 Beta多样性分析 属水平的主成分分析结果表明(图3a),导致两组样本间真菌群落结构产生差异的主要因素PC1和PC2分别占全部影响因素的94.79%和4.45%,健康烟叶样本与发病烟叶样本间真菌群落结构存在显著性差异。健康烟叶组内3个样本间样本距离较大,发病烟叶组内3个样本间样本距离较小。ANOSIM相似性分析结果与PCA分析结果一致(图3b),健康烟叶样本组内各样本间真菌群落结构差异较大,发病烟叶样本组内各样本间真菌群落结构差异较小,两组样本的组内差异均小于组间差异。
2.3 组间物种差异分析
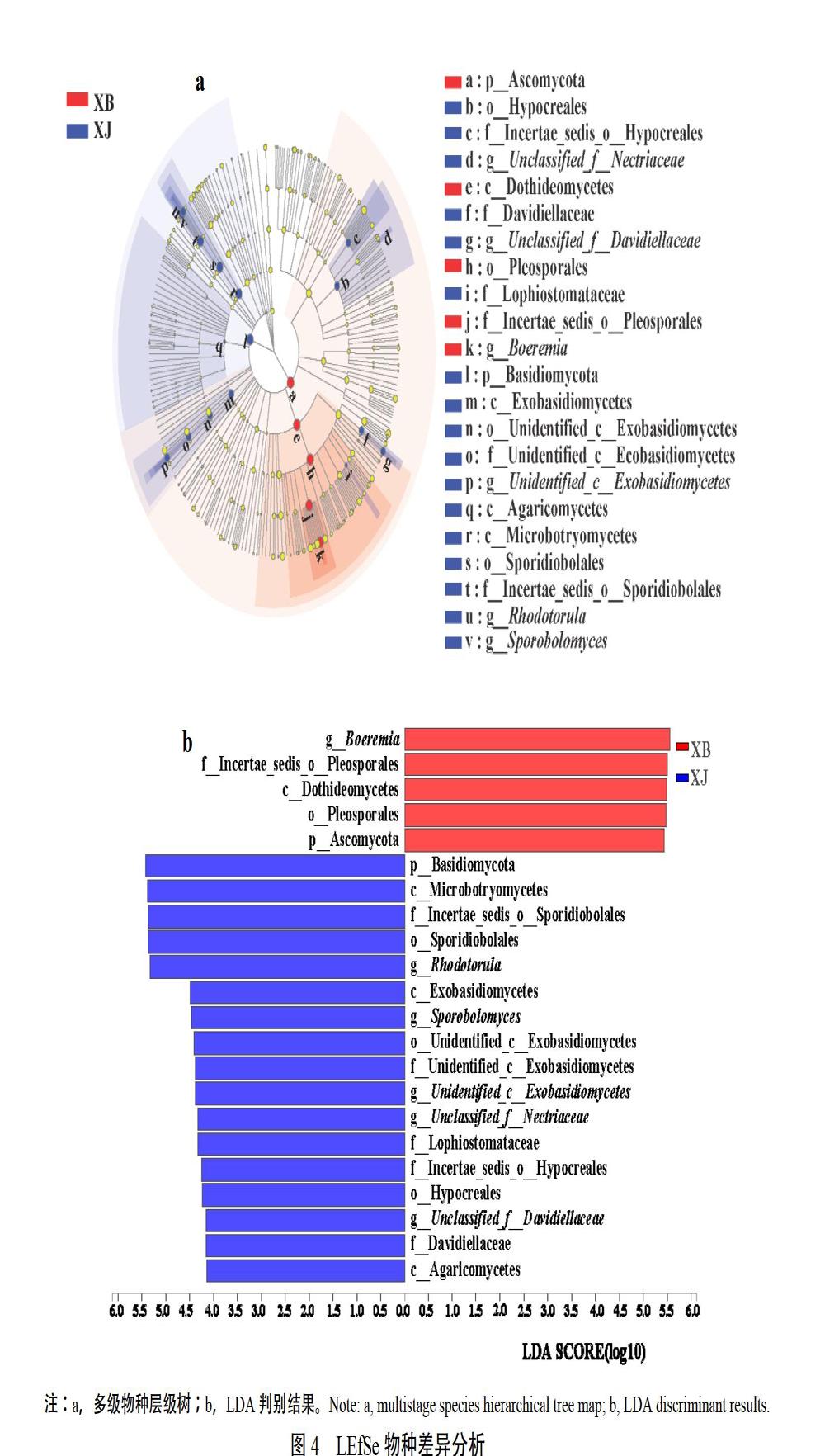
2.3.1 LEfSe物种差异分析 LEfSe是一种用于发现高维生物标识特征的软件,先使用non-parametric factorial Kruskal-Wallis sum-rank test(非参数因子克鲁斯卡尔—沃利斯秩和检验,K-W检验)检测 并找到具有显著丰度差异特征的类群,然后采用线性判别分析(LDA)来估算每个组分丰度对差异效果影响的大小。LEfSe物种差异判别分析结果表明,在LDA阈值为4的条件下,健康烟叶组与发病烟叶组样本共有22个不同分类水平的真菌存在显著性差异(图4)。其中发病烟叶组中Boeremia属、Incertae_sedis_o_Pleosporales科、座囊菌纲Dothideomycetes、假球壳目Pleosporales和子囊菌门Ascomycota,健康烟叶中担子菌门Basidiomycota、Microbotryomycetes纲、Incertae_sedis_o_ Sporidiobolales科、锁掷酵母目Sporidiobolales、红酵母属等,是导致发病烟叶与健康烟叶真菌群落产生差异的主要类群。
2.3.2 Students t检验 采用Students t检验对两组样品间真菌群落进行分析(图5),結果表明,Boremia作为发病烟叶上的优势菌属在健康与发病烟叶中的丰度存在显著性差异;Unclassified_c_ Dothideomycetes虽然在两组样本中相对丰度较低,但也存在显著性差异;健康烟叶中的优势菌属红酵母属在两组样本中的相对丰度则达到了极显著差异水平。
3 讨 论
叶斑类病害多由病原菌在叶际的定殖导致。研究表明植物病害会使病原菌富集,有益菌群数量急剧降低,最终导致植物体微生物群落结构失衡,多样性水平降低[9-12]。本研究中发病烟叶上真菌群落结构演变规律与前人研究结果一致。健康烟叶组样品真菌群落数除门水平外,在纲、目、科、属、种和OTU水平均显著高于发病烟叶组样品。Alpha多样性指数中健康烟叶样本的Sobs指数和Chao1指数显著高于发病烟叶样本,Simpson指数显著低于发病烟叶样本,Ace指数和Shannon指数高于发病烟叶样本但无显著性差异。Beta多样性分析结果表明,发病烟叶上真菌群落结构差异较小,健康烟叶真菌群落结构差异较大,且发病烟叶组群落差异小于健康烟叶组。
组间群落组成差异显著性检验中,Boeremia属、红酵母属和Unclassified_c_Dothideomycetes属在健康烟叶与发病烟叶中相对丰度均存在显著性差异。其中发病烟叶上最优势菌属均为Boeremia。研究表明,Boeremia可导致多种植物感病,如大豆茎点霉叶斑病[13],秋葵叶斑病和果斑病[14],婆婆纳叶斑病[15],薄荷黑茎根腐病[16]等,因此推测福泉市2019年爆发的烟草叶斑病是由Boeremia属真菌导致,而非链格孢属真菌引起的烟草赤星病。红酵母属在健康烟叶上为绝对优势菌属,其在健康叶上的相对丰度显著高于发病烟叶,且红酵母属真菌似乎与Boeremia属存在此消彼长的趋势,是红酵母属的消减导致Boeremia属相对丰度增加,还是Boeremia属的增加导致红酵母属相对丰度降低,或是红酵母属对Boeremia属存在拮抗作用,导致高丰度的红酵母属叶片对该叶斑病有抵御能力,目前尚不清楚,该问题将在后续研究中加以解决。Unclassified_c_Dothideomycetes菌属相对丰度同样也是健康烟叶中高于发病烟叶,且发病烟叶中的相对丰度小于1%,有可能起到了与红酵母属类似的作用,具体机制有待于进一步研究。
本研究中,健康烟叶XJ1和XJ2样本上也出现Boeremia,且在XJ2样本中为最优势菌属,但叶片却未出现类似发病烟叶上的病症。这进一步证明,病原菌富集只是导致植物发病的第一步,而当富集达到一定程度,致使微生物群落结构失衡、多样性水平降低,不足以对抗病原菌的破坏,才是叶片发病的最终原因。
除了Boeremia菌属外,健康烟叶与发病烟叶上也检测到了茎点霉属Phoma,该菌可导致茎点霉叶斑病[17];健康烟叶样本XJ3中检测出高氏白粉菌属Golovinomyces,其为烟草白粉病的主要病原菌[18],发病样品XB3中检测出赤星病病原链格孢属。此结 果表明,除导致烟叶发病的主要病原菌Boeremia外,其余可使烟叶致病的病原菌也可存在于叶片,可能因为病原菌数量未达到致病数量级,而叶片未表现出相应病症,因此在烟叶未发病前,对其进行x广谱性杀菌剂喷雾预防十分必要。
4 结 论
研究表明,新型叶斑病烟叶真菌群落丰富度与多样性均低于健康烟叶。发病烟叶中Boeremia为优势菌属,健康烟叶中红酵母属为优势菌属且组间差异显著,推测该叶斑病可能为Boeremia菌属引起的新型病害,而非链格孢菌引起的烟草赤星病。但目前尚未有Boeremia菌属在烟草上致病的报道。此结果将有助于烟农对症用药,并有效防控此新型叶斑病。本研究下一步将对病原菌进行分离和药剂筛选试验,以期筛选出能够高效防控该病害的药剂。
参考文献
[1]牛俊轲,卢宝慧,刘丽萍,等. 吉林省和黑龙江省烟草赤星病病原鉴定[J]. 中国烟草科学,2019,40(5):52-59.
NIU J K, LU B H, LIU L P, et al. Identification of the pathogens causing tobacco brown spot disease in Jilin and Heilongjiang Provinces [J]. Chinese Tobacco Science, 2019, 40(5): 52-59.
[2]陈江华,王轩轩,崔雪婧,等. 柑橘根霉软腐病的病原菌分离与鉴定[J]. 植物病理学报,2020,50(3):255-260.
CHEN J H, WANG X X, CUI X J. Identification of Rhizopus soft rot of citrus[J]. Acta Phytopathologica Sinica, 2020, 50(3): 255-260.
[3]马国胜, 高智谋. 烟草黑胫病菌对农田草本植物的寄主范围[J]. 植物保护学报,2011,38(5):477-478.
MA G S, GAO Z M. The host range of Phytophthora nicotianae var. nicotianae in field herbs[J]. Journal of Plant Protection, 2011, 38(5): 477-478.
[4]ALAIN K, QUERELLOU J. Cultivating the uncultured: limits, advances and future challenges[J]. Extremophiles, 2009, 13(4): 583-594.
[5]罗路云,张卓,金德才,等. 南瓜白粉病不同病情等级下叶际细菌群落结构和多樣性[J]. 植物病理学报,2017,47(5):688-695.
LUO L Y, ZHANG Z, JIN D C, et al. Phyllosphere bacterial diversities and community structures on pumkin with different severities of powdery mildew [J]. Acta Phytopathologica Sinica, 2017, 47(5): 688-695.
[6]尹淑丽,孙劲冲,刘倩倩,等. 枯草芽孢杆菌BSD-2对黄瓜叶际微生物数量及菌群结构的影响[J]. 微生物学通报,2016(12):2635-2643.
YIN S L, SUN J C, LIU Q Q, et al. Effects of Bacillus subtilis BSD-2 on cucumber phyllosphere microorganism community [J]. Microbiology China, 2016, (12): 2635-2643.
[7]刘畅,汪汉成,谢红炼,等. 感赤星病烟叶的真菌群落结构分析[J]. 贵州农业科学,2019,47(7):54-59.
LIU C, WANG H C, XIE H L, et al. Fungal community structure analysis of tobacco leaf infected with brown spot disease [J]. Guizhou Agricultural Sciences, 2019, 47(7): 54-59.
[8]向立刚,汪汉成,郭珍妮,等. 黑胫病感染对烟草茎秆及根际土壤真菌群落结构的影响[J]. 菌物学报,2019(12):2099-2111.
XIANG L G, WANG H C, GUO Z N, et al. The influence of black shank disease infection on fungal community structure of rhizosphere soil and stem of tobacco plants [J]. Mycosystema, 2019(12): 2099-2111.
[9]贺纪正,李晶,郑袁明. 土壤生态系统微生物多样性-稳定性关系的思考[J]. 生物多样性,2013,21(4): 412-421.
HE J Z, LI J, ZHENG Y M. Thoughts on the microbial diversity - stability relationship in soil ecosystems[J]. Biodiversity Science, 2013, 21(4): 412-421.
[10]张笑宇,段宏群,芦阿虔,等.健康烟田与易感黑胫病烟田烟株不同生长时期根际土壤微生物区系变化规律[J]. 河南农业科学,2018,47(3):63-69
ZHANG X Y, DUAN H Q, LU A Q et al. Variation of rhizosphere soil microbial flora in healthy and black shank-susceptible tobacco fields at different growth stages[J]. Journal of Henan Agricultural Sciences, 2018, 47(3): 63-69.
[11]施河麗,向必坤,谭军,等. 烟草青枯病发病烟株根际土壤细菌群落分析[J]. 中国烟草学报,2018,24(5):57-65.
SHI H L, XIANG B K, TAN J, et al. Analysis of bacterial community in rhizosphere soil of bacterial wilt diseased tobacco plant [J]. Acta Tabacaria Sinica, 2018, 24(5): 57-65.
[12]陈乾丽,李忠,汪汉成,等. 烤后不同霉变程度烟叶叶际真菌群落组成与多样性分析[J]. 微生物学报,2019,59(12):2401-2409.
CHEN Q L, LI Z, WANG H C, et al. Fungal composition and diversity of tobacco phyllosphere from cured tobacco leaves[J]. Acta Microbiologica Sinica, 2019, 59(12): 2401-2409.
[13]王梦奇,白庆荣,王大川,等. 吉林省大豆茎点霉叶斑病病原鉴定[J]. 大豆科学,2019,38(3):428-433,454.
WANG M Q, BAI Q R, WANG D C, et al. Pathogen identification of soybean leaf spot caused by Boeremia exigua var. exigua in Jilin province [J]. Soybean Science, 2019, 38(3): 428-433, 454.
[14]ZHAO Q, XIE X W, SHI Y X, et al. Boeremia leaf and fruit spot of okra caused by Boeremia exigua in China [J]. Canadian Journal of Plant Pathology, 2016, 38(3): 395-399.
[15]MICHEL V V, DAEPP M, WOUDENBERG J H C, et al. First report of Boeremia exigua var. exigua causing stem and leaf spot on Common Speedwell in Switzerland[J]. Plant Disease, 2018, 102(2): 440-440.
[16]ZIMOWSKA B, KR?L E D, FURMA?CZYK A, et al. Molecular characterization of Boeremia strasseri the causal agent of black stems and rhizomes rot of peppermint[J]. Journal of Plant Pathology, 2018, 100: 13-24.
[17]江燕,桑维钧,曾尔玲,等. 烟草茎点病在在贵州省的发生及病原鉴定[J]. 江苏农业科学,2018,46(10):92-95.
JIANG Y, SANG W J, ZENG E L, et al. Identification of pathogenic fungus causing tobacco black spot stalk in Guizhou Province[J]. Jiangsu agricultural sciences, 2018, 46(10): 92-95.
[18]COLE J S. Powdery mildew of tobacco (Erysiphe cichoracearum DC.) [J]. Annals of Applied Biology, 1964, 54(3): 291-301.
