万寿菊-烟草轮作调理植烟土壤细菌群落结构的作用
2021-03-24黎妍妍冯吉王林付裕李锡宏
黎妍妍 冯吉 王林 付裕 李锡宏


摘 要:基于大田试验和Illumina Hiseq扩增子测序技术,分析了万寿菊-烟草轮作对植烟土壤细菌群落多样性和结构的影响,旨在为缓解烟草连作障碍提供理论依据。结果表明,万寿菊-烟草轮作可提高烟株根际土壤细菌群落Sobs、Shannon和Chao 1等多样性和丰富度指数;提升土壤中酸杆菌门(Acidobacteria)和拟杆菌门(Bacteroidetes)的相对丰度;促使生防菌(Pseudomonas)、功能菌(Candidatus_Solibacter、Bryobacter和Bradyrhizobium)、降解菌(Massilia、Novosphingobium和Ramlibacter)和根际促生菌(Flavisolibacter)等菌属比例上升,有利于改善土壤微生态环境、缓解连作障碍。
关键词:万寿菊;轮作;细菌群落;多样性
Abstract: The research aims to provide a theoretical basis for alleviating the obstacles of tobacco continuous cropping. Field experiments and amplicon sequencing based on Illumina Hiseq were conducted to explore the effects of marigold-tobacco rotation on the diversity and structure of bacterial communities in tobacco rhizosphere soil. The results showed that marigold-tobacco rotation could greatly improve the Sobs, Shannon, Chao 1 indexes of soil bacterial communities. And, marigold-tobacco rotation can also improve the relative abundance of Acidobacteria and Bacteroidetes, and increase the proportion of biocontrol bacterium genera (Pseudomonas), functional bacteria genera (Candidatus_Solibacter, Bryobacter and Bradyrhizobium), degrading bacteria genera (Massilia, Novosphingobium and Ramlibacter) and plant growth promoting rhizobacteria (Flavisolibacter). In conclusion, marigold-tobacco rotation is strongly conducive to the improvement of soil microecological environment and alleviation of the obstacles of tobacco continuous cropping.
Keywords: marigold; rotation; bacterial community; diversity
烟草是我国重要的经济作物,属茄科忌连作的作物。然而,目前连作是我国烟草的主要种植制度,烟草连作面积占总种植面积的30%~60%[1]。长期连作可导致土壤养分失衡[2]和肥料利用率下降[3];化感物质(或潜在化感物质)增多[4];根际微生态失调,土壤中与营养元素循环相关的微生物数量降低,而病原微生物数量增加[5-6];由此形成连作障碍,即使在正常管理情况下也会出现烟草生育状况变差、产量和品质降低、病虫害发生加重等问题。
万寿菊(Tagetes erecta L.)为菊科万寿菊属植物,多用于色素提取。近年来的研究表明,万寿菊与烟草、大豆等作物轮作可有效降低土壤中线虫的数量,提升线虫多样性指数,有利于线虫群落结构的平衡[7-8];万寿菊-当归轮作对土壤真菌群落组成具有显著影响[9];万寿菊-烟草套作可提高根际土壤细菌群落多样性[10]。因此,万寿菊的不同利用方式在调控土壤微生态方面具有明显的积极作用。然而,能否通过万寿菊-烟草轮作来调理植烟土壤细菌群落结构,缓解烟草连作障碍,却鲜有报道。本研究通过在连作数年的烟田进行万寿菊-烟草轮作,分析评价土壤细菌群落结构的变化,以期为寻求缓解或克服烟草连作障碍的方法提供理论依据。
1 材料與方法
1.1 田间试验设置
试验于2016—2018年在湖北省恩施州宣恩县椒园镇凉风村进行。试验地烟草连作15年,种植烟草品种为云烟87。试验包括2个处理,3次重复,共6个小区。处理1:烟草连作(C);处理2:万寿菊-烟草轮作(R),即2016—2017年种植万寿菊、2018年种植烟草。烟草行株距为1.2 m×0.55 m,每小区种植烤烟100株,4月25日移栽。
1.2 土壤样品采集
2018年,处理1和处理2中烟草移栽后50 d、100 d时,采用5点取样法采集烟株根际土壤样品(与根系结合较紧密的土壤,在4 mm内),分别记作C_50、R_50、C_100和R_100。每个处理3个重复,共计12个土样。采集后的土样置于干冰中带回实验室,保存于–80 ℃冰箱,用于DNA提取。
1.3 土壤细菌群落分析
1.3.1 DNA提取及PCR扩增 采用FastDNA Spin Kit试剂盒(MP Biomedicals, USA)提取土样总DNA。以样品DNA为模板,采用引物515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对细菌16S rDNA V4可变区进行PCR扩增。扩增体系(30 ?L)包括:15 ?L Phusion Master Mix Buffer(2×)、3 ?L引物(2 μmol/L)、10 ?L DNA(1 ng/μL)模板和2 ?L ddH2O。反应程序:98 ℃ 1 min;98 ℃ 10 s,50 ℃ 30 s,72 ℃ 30 s(30个循环);72 ℃ 5 min(Bio-rad T100梯度PCR仪)。PCR产物经检测合格后进行文库构建,在Illumina Hiseq PE250测序平台进行测序(诺禾致源生物信息科技有限公司)。
1.3.2 OTU聚类与物种注释 以97%的一致性将所有样品的有效序列聚类成为OTU(Operational Taxonomic Units)。对OTU代表序列进行物种注释,用Mothur方法与SILVA的SSUrRNA数据库进行物种的注释分析。
1.4 数据处理
利用R软件(V 2.15.3)绘制稀释曲线图。利用Qiime软件(V 1.9.1)计算Sobs、Chao1丰富度指数和Shannon多样性指数。用SPSS 22.0中的Student's t-test分析细菌群落丰富度和多样性指数、物种相对丰度等在烟草连作田和轮作田土壤间的差异(p<0.05水平)。在属水平上,采用LEfSe(LDA Effect Size)多级物种差异判别分析(LDA值=3)检测连作田和轮作田土壤中具有显著丰度差异的菌属。
2 结 果
2.1 数据质控
对烟草连作田和轮作田土壤细菌群落进行了数据质控与分析。结果表明(表1),4组样品的有效序列数均在80 000条以上,平均序列长度在253~254 bp之间。在97%一致性的OTU分类水平下,获得C_50、R_50、C_100和R_100的细菌OTU数量均在5000个以上,其中烟草移栽后50 d和100 d轮作田(R)土壤细菌群落OTU数量分别较烟草连作田(C)高1.26%和5.67%。
2.2 土壤细菌群落多样性和丰富度分析
烟草连作田和轮作田土壤细菌群落多样性和丰富度指数见表2。结果表明,烟草移栽后50 d,轮作田(R_50)土壤细菌群落Sobs、Shannon和Chao 1指数分别较连作田(C_50)增加0.12%、0.41%和2.41%;烟草移栽后100 d,轮作田(R_100)土壤细菌群落Sobs、Shannon和Chao 1指数分别较连作田(C_100)增加5.41%、4.00%和13.02%,其中shannon(p=0.025)和Chao 1指数(p=0.049)在R_100和C_100间存在显著差异。以上结果表明,万寿菊-烟草轮作可提高土壤细菌群落的多样性和丰富度。
2.3 土壤细菌门水平的组成及差异分析
对相对丰度高于1%的土壤细菌门进行了分析(表3)。结果表明,烟草连作田和轮作田烟草移栽后50 d时根际土壤高于1%的细菌门的相对丰度分别共占96.39%和95.20%;烟草移栽后100 d时分别共占96.82%和95.32%。变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、芽单胞菌门(Gemmatimonadetes)、厚壁菌门(Firmicutes)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidetes)、硝化螺旋菌门(Nitrospirae)、疣微菌门(Verrucomicrobia)和浮霉菌门(Planctomycetes)的相对丰度在C_50、R_50、C_100和R_100中均高于1%;此外,奇古菌门(Thaumarchaeota)在C_50和C_100中的相对丰度也高于1%。Students t-test差异分析结果表明,烟草移栽后50 d时,轮作田(R_50)土壤中酸杆菌门和拟杆菌门的相对丰度显著高于连作田(C_50);烟草移栽后100 d时,轮作田(R_100)土壤中奇古菌门的相对丰度显著低于连作田(C_100)。
2.4 土壤细菌属水平的组成及差异分析
2.4.1 土壤细菌属水平的组成 对相对丰度高于1%的土壤细菌属进行了分析(图1)。结果表明,烟草移栽后50 d时,烟草连作田(C_50)和轮作田(R_50)土壤中鞘氨醇单胞菌(Sphingomonas)、Pseudarthrobacter、乳杆菌属(Lactobacillus)、芽单胞菌属(Gemmatimonas)、H16、RB41和Bryobacter的相对丰度均高于1%;此外,unidentified_Gemmatimonadaceae和水恒杆菌属(Mizugakiibacter)的相对丰度在C_50中高于1%,但在R_50中低于1%;马赛菌属(Massilia)的相对丰度在R_50中高于1%,但在C_50中低于1%。烟草移栽后100 d时,烟草连作田(C_100)和轮作田(R_100)土壤中鞘氨醇单胞菌属(Sphingomonas)、Pseudarthrobacter、芽单胞菌属(Gemmatimonas)、H16、马赛菌属(Massilia)和Ramlibacter的相对丰度均高于1%;此外,慢生根瘤菌(Bradyrhizobium)的相对丰度在R_100中高于1%,但在C_100中低于1%。
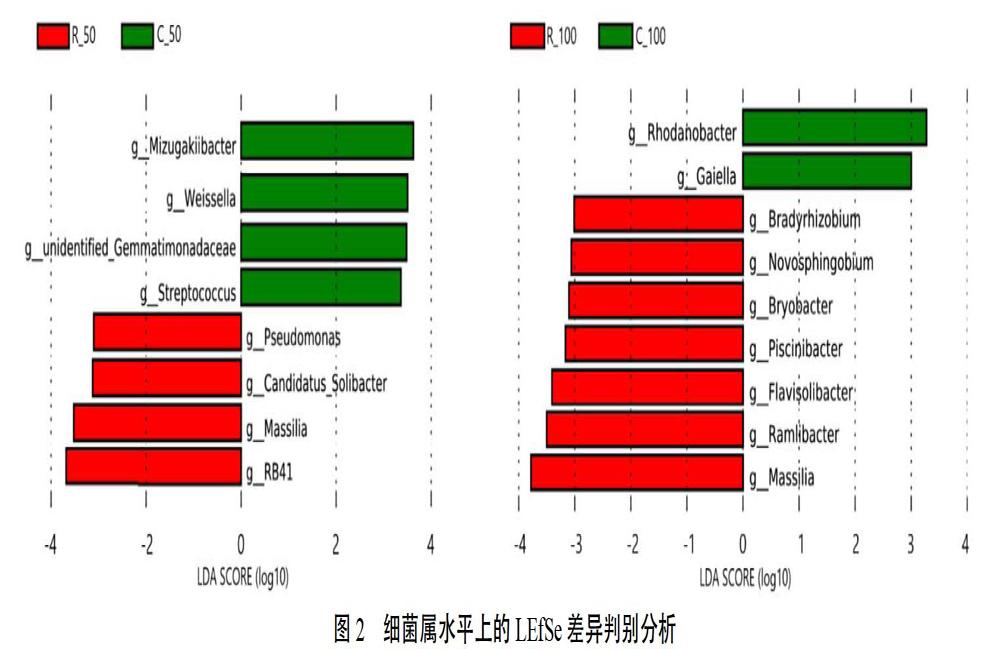
2.4.2 细菌属水平上的LEfSe多级物种差异判别分析 在细菌属水平上,对烟草连作田和轮作田土壤细菌群落进行了LEfSe物种差异判别分析(图2)。结果表明,烟草移栽后50 d时,烟草连作田(C_50)和轮作田(R_50)根际土壤共有8个细菌属存在显著性差异,其中C_50中水恒杆菌属(Mizugakiibacter)、魏斯氏菌属(Weissella)、unidentified_Gemmatimonadaceae和鏈球菌属(Streptococcus);R_50中假单胞菌(Pseudomonas)、Candidatus_Solibacter、马赛菌属(Massilia)和RB41是烟草连作田和轮作田土壤细菌群落差异的主要类群。烟草移栽后100 d时,烟草连作田(C_100)和轮作田(R_100)根际土壤共有9个细菌属存在显著性差异,其中C_100中Rhodanobacter和Gaiella;R_100中慢生根瘤菌(Bradyrhizobium)、新鞘氨醇杆菌(Novosphingobium)、Bryobacter、水库杆菌属(Piscinibacter)、黄色土源菌(Flavisolibacter)、Ramlibacter和马赛菌属(Massilia)是烟草连作田和轮作田土壤细菌群落差异的主要类群。
3 讨 论
土壤微生态是有效评价土壤健康状况的重要指标[11]。在引起烤烟连作障碍的诸多因素中,根际微生态失调是主要因素[12]。因此,调理根际土壤微生态是解决烟草连作障碍的关键。
研究表明,微生物群落多样性可反映其响应胁迫的能力,群落多样性和丰富度指数越高,其响应胁迫的修复能力也越强[13]。在细菌、真菌等微生物群落中,细菌群落多样性通常被认为是恢复生态功能进而维持生态系统平衡的重要指标[14]。本研究中,万寿菊-烟草轮作可明显提高烟株根际土壤细菌群落Sobs、Shannon和Chao 1等多样性和丰富度指数。因此,万寿菊-烟草轮作可提高土壤细菌群落响应胁迫的修复能力,有助于恢复微生态平衡。
研究表明,当种植模式等外界环境发生变化时,土壤微生物迅速响应,导致微生物丰度、组成等发生动态变化[15]。本研究也得到类似结论,万寿菊-烟草轮作田土壤中酸杆菌门和拟杆菌门的相对丰度显著升高。酸杆菌主要参与铁循环和单碳化合物代谢,对植物残体降解具有重要作用[16];而拟杆菌门的相对丰度在施用炭化稻壳复合土壤调理剂的土壤中也显著升高[17]。因此,万寿菊-烟草轮作有利于植物残体降解,保持土壤生产力的稳定,其作用可能与施用炭化稻壳相当。
一些重要的细菌属在植物生长、物质转化、降解有害物质等方面具有重要作用。Pseudomonas是已明确的生防菌,具有促进植物生长、改善植物养分吸收状况的作用,同时可有效防治多种作物土传病害[18];Pseudomonas数量减少可能是导致连作土壤微生物群落发生变化的原因[19]。Candidatus_Solibacter、Bryobacter和Bradyrhizobium是与土壤中物质转化有关的功能菌,分别具有分解有机质、促进土壤碳循环和固氮的作用,在番茄等作物有机种植和轮作田块的土壤中这3种菌属的相对丰度显著升高[20-22]。Massilia、Novosphingobium和Ramlibacter可降解多环芳烃[23-25],其中,Massilia通过产生对土壤病原真菌以及线虫具有显著防治作用的二甲基二硫醚,对土壤具有熏蒸作用[26]。Flavisolibacter为根际促生菌,可促进根系发育[27]。烟草-万寿菊轮作后,烟株根际土壤中这些菌属的相对丰度显著升高,有利于改善土壤微生态环境,促进烟株生长发育,缓解连作障碍。
4 结 论
本研究分析了万寿菊-烟草轮作在调理植烟土壤细菌群落结构中的作用,为万寿菊综合利用提供了思路。万寿菊-烟草轮作可提高烟株根际土壤细菌群落多样性和丰富度,提升土壤响应胁迫的修复能力。在万寿菊-烟草轮作土壤中,酸杆菌门和拟杆菌门的相对丰度升高,生防菌(Pseudomonas)、功能菌(Candidatus_Solibacter、Bryobacter和Bradyrhizobium)、降解菌(Massilia、Novosphingobium和Ramlibacter)和根际促生菌(Flavisolibacter)等菌属的比例上升。因此,万寿菊-烟草轮作对改善土壤微生态环境、缓解连作障碍具有积极作用。
参考文献
[1]张仕祥,过伟民,李辉信,等. 烟草连作障碍研究进展[J]. 土壤,2015,47(5):823-829.
ZHANG S X, GUO W M, LI H X, et al. Research progresses on continuous cropping obstacles of tobacco[J]. Soils, 2015,47(5):823-829.
[2]SOLYMOSI K, BERTRAND M. Soil metals, chloroplasts, and secure crop production: a review[J]. Agronomy for Sustainable Development, 2012, 32(1): 245-272.
[3]李天福,冉邦定,陈萍. 云南烤烟经济合理施肥建议[J]. 云南农业科技,1999(2):29-30.
LI T F, RAN B D, CHEN P. Suggestions of economic and rational fertilization for flue-cured tobacco in Yunnan[J]. Yunnan Agricultural Science and Technology, 1999(2): 29-30.
[4]陈冬梅,黄锦文,柯文辉,等. 连作烟草根际土壤化感潜力评价及化感物质鉴定[J]. 中国烟草学报,2012,18(1):46-52.
CHEN D M, HUANG J W, KE W H, et al. Allelopathic evaluation of continuous cropping tobacco rhizospheric soil and allelochemical identification[J]. Acta Tabacaria Sinica, 2012, 18(1): 46-52.
[5]朱金峰,樊祖清,陳启龙,等. 不同连作年限对烟草根际土壤微生物区系的影响[J]. 北方农业学报,2019,47(1):42-48.
ZHU J F, FAN Z Q, CHEN Q L, et al. Effects of continuous cropping years on soil microbial flora in the tobacco rhizosphere[J]. Journal of Northern Agriculture, 2019, 47(1): 42-48.
[6]杨宇虹,陈冬梅,晋艳,等. 连作烟草对土壤微生物区系影响的T-RFLP分析[J]. 中国烟草学报,2012,18(1):40-45.
YANG Y H, CHEN D M, JIN Y, et al. T-RFLP analysis of soil microbial diversity after continuous tobacco cropping[J]. Acta Tabacaria Sinica, 2012, 18(1): 40-45.
[7]吴文涛,董莹,王晓强,等. 万寿菊-烟草轮作对土壤线虫群落的影响[J]. 西南农业学报,2019,32(2):342-348.
WU W T, DONG Y, WANG X Q, et al. Effects of marigold-tobacco rotation on soil nematode community composition[J]. Southwest China Journal of Agricultural Sciences, 2019, 32(2): 342-348.
[8]于佰双,段玉玺,王家军,等. 轮作植物对大豆胞囊线虫抑制作用的研究[J]. 大豆科学,2009,28(2):256-259.
YU B S, DUAN Y X, WANG J J, et al. Rotation crop evaluation for management of the soybean cyst nematode[J]. Soybean Science, 2009, 28(2): 256-259.
[9]魏环宇,管丽蓉,王扬,等. 万寿菊当归多样性种植对土壤真菌多样性的影响[J]. 植物保护,2015,41(5):69-74.
WEI H Y, GUAN L R, WANG Y, et al. Effects of marigold diversified cropping with angelica on fungal community in soils[J]. Plant Protection, 2015, 41(5): 69-74.
[10]夏体渊,陈泽斌,苏源,等. 万寿菊-烟草套作体系中不同生长期烟草根际土壤微生物多样性研究[J]. 西南农业学报,2018,31(4):680-686.
XIA T Y, CHEN Z B, SU Y, et al. Microbial diversity of tobacco rhizosphere soil in different growth stages of marigold-tobacco intercropping system[J]. Southwest China Journal of Agricultural Sciences, 2018, 31(4): 680-686.
[11]張明艳,张继光,申国明,等. 烟田土壤微生物群落结构及功能微生物的研究现状与展望[J]. 中国农业科技导报,2014(5):115-122.
ZHANG M Y, ZHANG J G, SHEN G M, et al. Present research status and prospects of microbial communities structure and functional microorganisms in tobacco-planting soil[J]. Journal of
Agricultural Science and Technology, 2014(5): 115-122.
[12]石秋环,焦枫,耿伟,等. 烤烟连作土壤环境中的障碍因子研究综述[J]. 中国烟草学报,2009,15(6):81-84.
SHI H Q, JIAO F, GENG W, et al. An overview on research into factors hindering continuous cropping in flue-cured tobacco[J]. Acta Tabacaria Sinica, 2009, 15(6): 81-84.
[13]贺纪正,李晶,郑袁明. 土壤生态系统微生物多样性-稳定性关系的思考[J]. 生物多样性,2013,21(4):411-420.
HE J Z, LI J, ZHENG Y M. Thoughts on the microbial diversity-stability relationship in soil ecosystems [J]. Biodiversity Science, 2013, 21(4): 411-420.
[14]AVIDANO L, GAMALERO E, COSSA G P, et al. Characterization of soil health in an Italian polluted site by using microorganisms as bioindicators [J]. Applied Soil Ecology, 2005, 30: 21-33.
[15]MOHAMMADI K. Soil Microbial Activity and Biomass as Influenced by Tillage and Fertilization in Wheat Production[J]. American-Eurasian J Agric & Environ Sci, 2011, 10: 330-337.
[16]王光华,刘俊杰,于镇华,等. 土壤酸杆菌门细菌生态学研究进展[J]. 生物技术通报,2016,32(2):14-20.
WANG G H, LIU J J, YU Z H, et al. Research progress of Acidobacteria ecology in soils[J]. Biotechnology Bulletin, 2016, 32(2): 14-20.
[17]张殊慧,谢国强,韩晓日,等. 炭化稻壳复合土壤调理剂改善土壤环境提高山药产量[J]. 农业工程学报,2016,32(15):150-156.
ZHANG S H, XIE G Q, HAN X R, et al. Composite soil conditioner with carbonized rice husk improving soil environment and increasing yam yield[J]. Transactions of the Chinese Society of Agricultural Engineering, 2016, 32(15): 150-156.
[18]李兴龙,李彦忠. 土传病害生物防治研究进展[J]. 草业学报,2015,24(3):204-212.
LI X L, LI Y Z. Research advances in biological control of soil-borne disease[J]. Acta Prataculturae Sinica, 2015, 24(3): 204-212.
[19]葛晓颖,孙志刚,李涛,等. 设施番茄连作障碍与土壤芽孢杆菌和假单胞菌及微生物群落的关系分析[J]. 农业环境科学学报, 2016,35(2):514-523.
GE X Y, SUN Z G, LI T, et al. Soil Pseudomonas spp., Bacillus spp., and microbial communities under tomato continuous cropping in greenhouse production[J]. Journal of Agro-Environment Science, 2016, 35(2): 514-523.
[20]李威,程智慧,孟焕文,等. 轮作不同蔬菜对大棚番茄连作基质中微生物与酶及后茬番茄的影响[J]. 园艺学报,2012,39(1):73-80.
LI W, CHENG Z H, MENG H W, et al. Effect of rotating different vegetables on micro-biomass and enzyme in tomato continuous cropped substrate and afterculture tomato under plastic tunnel cultivation[J]. Acta Horticulturae Sinica, 2012, 39(1): 73-80.
[21]杜思瑶,于淼,刘芳华,等. 设施种植模式对土壤细菌多样性及群落结构的影响[J]. 中国生态农业学报,2017,25(11):1615-1625.
DU S Y, Yu M, Liu F H, et al. Effect of facility management regimes on soil bacterial diversity and community structure[J]. Chinese Journal of Eco-Agriculture, 2017, 25(11): 1615-1625.
[22]劉杭. 黑土区典型作物轮作和连作对土壤微生物群落结构的影响[D]. 长春:中国科学院东北地理与农业生态研究所,2019.
LIU H. Impact of soil microbial community structure on rotation cropping and continuous cropping systems of typical crops in black soil [D]. Changchun: Northeast institute of geography and agroecology, Chinese academy of sciences, 2019.
[23]LOU J, GU H P, WANG H Z, et al. Complete genome sequence of Massilia sp. WG5, an efficient phenanthrene-degrading bacterium from soil [J]. Journal of Biotechnology, 2016, 218: 49-50.
[24]高淑梅. 抑制水稻主要病原菌的药剂混配及多环芳香烃的生物降解研究[D]. 北京:中国农业大学,2014.
GAO S M. Chemicals mixed to prevent rice from seed-borne fungi and bacteria disease and the biodegradation research of PAHs[D]. Beijing: China Agricultural University, 2014.
[25]SUN H H, NARIHIRO T, MA X Y, et al. Diverse aromatic-degrading bacteria present in a highly enriched autotrophic nitrifying sludge [J]. Science of the Total Environment, 2019, 666: 245-251.
[26]FENG G D, YANG S Z, LI H P, et al. Massilia putida sp. nov., a dimethyl disulfide-producing bacterium isolated from wolfram mine tailing[J]. International Journal of Systematic and Evolutionary Microbiology, 2016, 66(1): 50-55.
[27]金桃,冯强,万景旺,等. 五种根际促生菌在改善植物的农艺性状方面的应用:CN201510541017.2[P]. 2017-03-08.
JIN T, FENG Q, WAN J W, et al. Application of five kinds of plant growth promoting rhizobacteria in improving agronomic characters of plants: CN201510541017.2[P]. 2017-03-08.
