苯并咪唑离子液体的合成及其催化尼泊金甲酯的合成
2021-03-24刘玉婷邹倩尹大伟
刘玉婷,邹倩,尹大伟
(陕西科技大学 化学与化工学院 教育部轻化工助剂化学与技术重点实验室,西安 710021)
近年来,基于环保理念,从源头上减少或消除化学工业对环境的危害,使绿色有机合成得到了足够的重视。在有机化合物的合成中,绿色合成方法的设计和选择、 绿色试剂、溶剂及催化剂的使用、副产品及产品的处理等的绿色化是目前有机合成的主要目标。离子液体作为新型溶剂及催化剂,本身是一种低熔点的有机盐,具有很多优异特性[1],例如低毒性、低蒸气压、高堆积密度、宽液相线范围、离子电导率具有较高的热稳定性、低腐蚀性和易处理性等。苯并咪唑离子液体作为咪唑离子液体的衍生物[2],因此具有咪唑离子液体的多种优良性质,例如对空气和水不敏感、熔点低、稳定性高等。尼泊金酯具有化学稳定性高、不挥发、抗菌、成本低且无气味等优势。由于其优越的抗真菌和抗微生物特性,常用于化妆品[3]、食品和饮料中作为防腐剂[4]。酯化反应通常采用浓硫酸催化,但浓硫酸存在腐蚀设备、催化产率低、产物分离困难、后处理较复杂、有大量废酸产生等缺点,因此为了解决传统方法产生的环境污染、经济成本高、不利于工业生产的问题,人们开始尝试使用绿色催化剂,如离子液体、酶、壳聚糖等催化酯化反应。特别是离子液体催化反应,不仅效率高、产品纯度高,而且催化剂可以回收再利用,降低了反应成本。本课题组近年来一直在探索高效绿色合成尼泊金酯的方法[5-9]。本文中首先合成了8种苯并咪唑离子液体,并通过FT-IR、1H NMR、13C NMR
对其结构进行了表征,并对其溶解性、吸水性、pH、电导率、SEM、TGA等进行了系统分析,同时重点考察了离子液体催化合成尼泊金甲酯,并优化了反应条件。

图1 苯并咪唑离子液体的合成

图2 尼泊金甲酯的合成
1 实验部分
1.1 试剂及仪器
红外光谱采用德国Bruker公司的VECTOR-22傅立叶红外光谱仪测定(KBr压片);核磁共振采用德国Bruker公司的ADVANCE Ⅲ 400 MHz核磁共振仪测定(以DMSO-d6为溶剂,以TMS为内标);熔点采用北京泰克仪器有限公司的X-4型数字显示显微熔点仪测定(温度计未经校正);电导率采用DDS-11A 型电导率仪(电导电极为 DDS-1型铂电极)测定;热重分析采用美国TA公司的TGA Q500型热重分析仪测定;场发射扫描电镜(SEM)采用日本Hitachi公司的S4800型场发射扫描电镜仪测定。
所用试剂均为市售分析纯。N-苄基苯并咪唑按文献[10]的方法合成。
1.2 N-苄基苯并咪唑离子液体的合成
在干燥的100 mL三口烧瓶中,加入0.208 g(1 mmol)N-苄基苯并咪唑、30 mL无水乙醇,搅拌至全溶。冰浴下缓慢滴加酸,然后室温反应8 h,至反应完全(TLC监测)。蒸除溶剂,残余物用乙醚洗涤、抽滤、干燥得白色固体。用无水乙醇重结晶得到N-苄基苯并咪唑离子液体纯品。
N-苄基苯并咪唑硫酸氢盐(IL1):白色固体,产率88.6%, m.p.195~197 ℃(194.8~195.2 ℃[11])。IR(KBr)ν:3108(ν=C-H), 1613(νC=N), 1548, 1442(ν苯环骨架),1312(νC-N), 758 (γ1,2-Ph-H);1H NMR (400 MHz, DMSO-d6)δ: 9.84 (s, 1H,N-CH), 7.91 (d, J=7.56 Hz,2H, Ar-H),7.50(m,7H,Ar-H),5.74(s,2H,N-CH2);13C NMR(101 MHz,DMSO-d6)δ:142.01,134.49,130.85, 129.02,128.66,128.23,126.49,126.06,115.36,113.51,49.93。
N-苄基苯并咪唑氟硼酸盐(IL2):白色固体,产率85.9%,m.p.106~108 ℃(108~110 ℃[12]。IR(KBr)ν:3141(ν=C-H), 1622(νC=N), 1553, 1440(ν苯环骨架),1371(νC-N),753(γ1,2-Ph-H);1H NMR (400 MHz,DMSO-d6)δ: 9.77 (s, 1H,N-CH),7.89(d,J=7.50 Hz,2H, Ar-H), 7.49 (m, 7H, Ar-H),5.76(s,2H,N-CH2);13C NMR(101 MHz,DMSO-d6)δ:141.70,134.15,131.05,128.91,128.56,128.06,126.48,126.09,115.03,113.35,49.76。
N-苄基苯并咪唑对甲苯磺酸盐(IL3):白色固体,产率82.4%,m.p.113~115 ℃。IR(KBr)ν 3104(ν=C-H),1609(νC=N),1540,1440(ν苯环骨架), 1371(νC-N), 753 (γ1,2-Ph-H);1H NMR (400 MHz,DMSO-d6)δ: 9.80 (s, 1H,N-CH), 7.87 (d, J=7.11 Hz,2H, Ar-H), 7.41 (m, 9H, Ar-H), 7.10 (s, 2H, Ar-H),5.76(s,2H, N-CH2), 2.27 (s, 3H, -CH3);13C NMR(101 MHz,DMSO-d6)δ:145.18,142.00,138.12,134.36,131.58,130.80,128.96,128.59,128.28,128.20,126.37,126.04,125.56,115.32,113.44,49.60,20.94。
苄基苯并咪唑磷酸二氢盐(IL4):白色固体,产率88.1%,m.p.146~148 ℃。IR(KBr)ν:3104(ν=C-H), 1722(νC=N), 1553, 1446(ν苯环骨架), 1302(νC-N), 753 (γ1,2-Ph-H);1H NMR (400 MHz,DMSO-d6)δ:8.50(s, 1H,N-CH), 7.68 (d, J=7.58 Hz,2H, Ar-H),7.27 (m, 7H, Ar-H), 5.51 (s, 2H, N-CH2);13C NMR(101 MHz,DMSO-d6)δ:144.14,136.69,133.44,128.88,127.99,127.53,123.00,122.32,119.19,111.12,47.99。
N-苄基苯并咪唑盐酸盐(IL5):白色固体,产率80.2%,m.p.136~138 ℃。IR(KBr)ν:3058(ν=C-H), 1626(νC=N), 1556, 1451(ν苯环骨架), 1302(νC-N), 761 (γ1,2-Ph-H);1H NMR(400 MHz,DMSO-d6)δ: 9.29 (s, 1H,N-CH), 7.71 (d, J=7.46 Hz,2H, Ar-H),7.35 (m, 7H, Ar-H), 5.67 (s, 2H, N-CH2);13C NMR(DMSO-d6,101 MHz)δ:143.16,135.93,132.37,129.01,128.35,128.02,124.46,124.25,117.4,112.36,48.83。
N-苄基苯并咪唑三氟乙酸盐(IL6):淡黄色黏状固体,产率78.6%,m.p.107~109 ℃。IR(KBr)ν:3110(ν=C-H), 1790(νC=O), 1671(νC=N), 1546(ν苯环骨架), 1371(νC-N), 715 (γ1,2-Ph-H);1H NMR (400 MHz,DMSO-d6)δ: 9.75 (s, 1H,N-CH), 7.90 (d, J=7.68 Hz,2H,Ar-H), 7.39 (m, 7H, Ar-H), 5.76 (s, 2H, N-CH2);13C NMR(101 MHz,DMSO-d6)δ:141.97,134.46,130.90,128.78,128.36,127.91,125.85,125.53,115.44,113.05,49.34。
N-苄基苯并咪唑甲磺酸盐(IL7):淡黄色黏状固体,产率75.9%,m.p.70~72 ℃。IR(KBr)ν:3097(ν=C-H),1630(νC=N),1553,1442(ν苯环骨架),1312(νC-N),758(γ1,2-Ph-H);1H NMR(400 MHz,DMSO-d6,)δ:9.89 (s, 1H,N-CH), 7.89 (d, J=7.24 Hz,2H, Ar-H), 7.34 (m, 7H, Ar-H), 5.79 (s,2H, N-CH2), 2.42 (s, 3H, -CH3);13C NMR(101 MHz,DMSO-d6)δ:141.98,134.48,131.20,130.77,129.11,128.76,128.34,126.66,126.35,115.21,113.66,49.62。
N-苄基苯并咪唑硝酸盐(IL8):白色固体,产率81.5%,m.p.97~99 ℃。IR(KBr)ν:3097(ν=C-H), 1615(νC=N), 1546, 1459(ν苯环骨架), 1378(νC-N), 740 (γ1,2-Ph-H);1H NMR(400 MHz,DMSO-d6)δ: 9.63 (s, 1H,N-CH),7.84 (d,J=7.47 Hz, 2H, Ar-H), 7.41 (m, 7H, Ar-H),5.74 (s, 2H, N-CH2);13C NMR(101 MHz,DMSO-d6)δ:142.37,134.77,131.20,128.95,128.50,128.06,125.80,125.60,115.83,113.09,49.19。
1.3 尼泊金甲酯的合成
在干燥的100 mL三口烧瓶中,加入1.381 g(10 mmol)对羟基苯甲酸和4.143 g(30 mmol)甲醇搅拌至全溶,再加入15%的苯并咪唑离子液体(相对于酸的物质的量)。缓慢升温回流反应6 h,TLC监测至反应结束。减压蒸除溶剂,剩余物用乙醚洗涤,抽滤,滤饼即苯并咪唑离子液体,可循环使用多次;滤液旋干,用无水乙醇重结晶得到纯品,m.p.122~124 ℃(126~128 ℃)。IR(KBr)ν:3410(νO-H),3072(νPh-H),2878(νC-H),1728(νC=O),1615,1433(ν-苯环),1202(νC-O-C),828(γ1,4-Ph-H)。
2 结果与讨论
2.1 离子液体的溶解性
分别以乙酸乙酯、甲醇、乙醇、乙醚、苯、甲苯、氯仿、二氯甲烷、水、正已烷、乙腈及丙酮为溶剂,考察离子液体的溶解性。溶解度标准根据《中国药典》易溶、溶解、略溶、微溶、几乎不溶或不溶来描述其溶解性能[13]。离子液体的溶解性结果见表1。

表1 离子液体的溶解性Table 1 The solubility of ionic liquid

续 表
由表1可知,离子液体(IL1-8)在乙酸乙酯、甲醇、乙醇、氯仿、二氯甲烷、乙腈、丙酮里溶解而在乙醚、苯、甲苯、正已烷中不溶。IL1、IL3、IL4、IL6、IL7在水中溶解而IL2、IL5、IL8在水中微溶。离子液体在乙醚、苯、甲苯、正己烷中不溶,可能与溶剂的极性有关,一般溶剂的极性越大,化合物在其中的溶解性越好。
2.2 离子液体的吸水性
将离子液体(IL1-8)放在烘箱中干燥24 h后分别取0.01 g放在表面皿上,并平整地铺开,在室温下每隔2 h分别称其质量,共放置24 h,计算其吸水率。离子液体(IL1-8)吸水性结果见表2。

表2 离子液体的吸水性Table 2 The hygroscopicity of ionic liquid
由表2可知,所有离子液体(IL1-8)都有较好的吸水性。离子液体IL7(N-苄基苯并咪唑甲磺酸盐)吸水性最好,而离子液体IL4(N-苄基苯并咪唑磷酸二氢盐)吸水性最差。
2.3 离子液体的pH值
将能溶于水的离子液体IL1、IL3、IL4、IL6、IL7配成不同浓度的水溶液,然后测其pH值,其pH结果见表3(因IL2、IL5、IL8微溶于水,因此无法测其pH)。
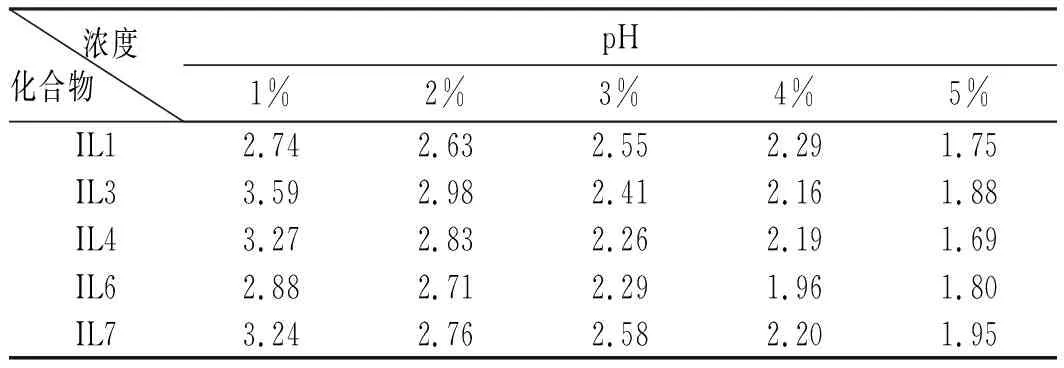
表3 离子液体的pH值Table 3 The pH values of ionic liquid
由表3可知,5种测试的离子液体都有较强的酸性。同一种离子液体,pH值随着质量分数的增大而减小。IL1(N-苄基苯并咪唑硫酸氢盐)的pH值最小,pH值可能与阴离子有关,HSO4-电离出H+浓度大,因此酸性高。
2.4 离子液体的电导率
电导率是离子液体的一个重要参数。分别以水、无水乙醇为溶剂把离子液体配成10~5 mol/L的溶液,测定不同温度下的电导率,在水中的电导率见表4(由于IL2、IL5、IL8微溶于水,因此无法测其在水中的电导率);在无水乙醇中的电导率见表5。

表4 离子液体在水中的电导率Table 4 The electrical conductivity of ionic liquid in water

表5 离子液体在乙醇中的电导率Table 5 The electrical conductivity of ionic liquid in ethanol
由表4和表5可知,离子液体的电导率随着温度的升高而增大,在水中的电导率远远大于在乙醇中的电导率。IL3(N-苄基苯并咪唑对甲苯磺酸盐)在水中的电导率最小,IL4(苄基苯并咪唑磷酸二氢盐)在水中的电导率最大,这可能和阴离子空间构型有关。IL7(苄基苯并咪唑甲磺酸盐)在乙醇中的电导率最大,而IL5(N-苄基苯并咪唑盐酸盐)的最小。IL1(N-苄基苯并咪唑硫酸氢盐)与IL2(苄基苯并咪唑氟硼酸盐),IL4(苄基苯并咪唑磷酸二氢盐)与IL5(N-苄基苯并咪唑盐酸盐)的电导率接近。
2.5 离子液体的热重分析
用TGA Q500型热重分析仪测试离子液体(IL1~L18)的热稳定性,在氮气保护下,以升温速率10 ℃/min测定了8种离子液体的热稳定性,结果见图3。

图3 离子液体的TGA图
由图3可知,离子液体(IL1~L18)的分解温度都大于250 ℃,说明离子液体比较稳定。IL7(苄基苯并咪唑甲磺酸盐)最先出现质量损失。离子液体在刚开始逐渐升温的过程中有一个较长的恒重过程,但是在255~300 ℃左右,有明显的质量损失,这是失去了结晶水的缘故。在320~370 ℃,有特别明显的质量损失,可能是苯并咪唑环、阴离子的结构遭到破坏。
2.6 离子液体的场发射扫描电镜(SEM)数据分析
用S4800型场发射扫描电镜(SEM),放大一定倍数,观测离子液体(IL1-8)的表面形貌,结果见图4。


图4 离子液体的SEM图
由图4可知,IL1、IL2、IL5分别放大22000,12000,15000倍观察到的形态是规则的,表面均匀且光滑,由棒组成,直径分别是20,40,5 μm。而IL3、IL4、IL6、IL7、IL8分别放大10000,11000,15000,20000,22000倍后观察到其表面是堆积颗粒的形态,表面积较大,可能具有优异的催化活性,直径分别为50,40,30,20,20 μm。
2.7 离子液体催化合成尼泊金甲酯
以离子液体IL1(N-苄基苯并咪唑硫酸氢盐)为催化剂,考察其催化尼泊金甲酯合成的效果。在单因素实验的基础上,通过正交实验,考察反应温度、反应时间、催化剂用量、原料摩尔比对尼泊金甲酯产率的影响。正交实验因素水平见表6,正交实验结果见表7。

表6 正交实验因素水平表Table 6 The factors and levels of orthogonal experiment

表7 正交实验与结果Table 7 The results of orthogonal experiment
由表7可知,各因素对尼泊金甲酯产率影响的主次顺序为反应温度>反应时间>对羟基苯甲酸和甲醇的摩尔比>催化剂用量。各因素的较优水平组合为A3B3C3D2,即合成尼泊金甲酯的最佳反应条件:对羟基苯甲酸和甲醇的摩尔比为 1∶3,回流反应6 h ,催化剂用量n=15%n对羟基苯甲酸。
为了考察正交实验得出的最佳反应条件的合理性,以最佳反应条件合成尼泊金甲酯,结果见表8。
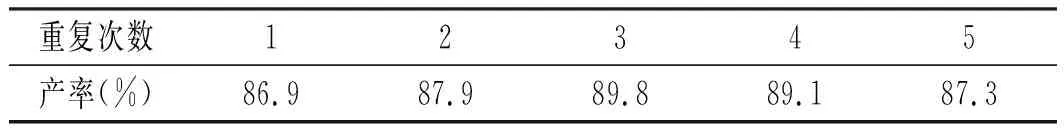
表8 最佳反应条件的重复Table 8 The repetition of optimal reaction conditions
由表8可知,最佳反应条件重复5次 ,尼泊金甲酯的产率均比正交表里的数据高。
2.8 离子液体的重复使用
为了考察离子液体的重复使用性,在最佳反应条件下,以IL1(N-苄基苯并咪唑硫酸氢盐)催化合成尼泊金甲酯,循环使用5次,考察催化剂的重复使用对尼泊金甲酯产率的影响,结果见表9。

表9 离子液体的重复使用性Table 9 The reusability of ionic liquid
由表9可知,随着重复使用次数的增多,产率降低,但是降低幅度不大,说明离子液体作为催化剂的重复使用效果良好。
3 结论
本文提供了一种绿色、经济、高效、低成本合成尼泊金甲酯的方法。首先合成了8种苯并咪唑离子液体,并将其用于催化尼泊金甲酯的合成,同时优化了反应条件,得出最佳反应条件为:对羟基苯甲酸和甲醇的摩尔比1∶3,回流反应时间6 h,催化剂用量n=15%n对羟基苯甲酸,产率高达86%以上,为尼泊金甲酯的绿色合成提供了理论依据。
