塞来昔布对脑出血模型大鼠TLR4/NF-κB信号通路及GLT-1表达的影响
2021-03-24权天龙
张 浩,权天龙
脑出血是常见的急性脑病之一。在过去10年内,全球脑卒中9%~27%是由脑出血引起的。脑出血病人常预后不良,疾病初期病人生存率较低[1]。脑出血病变部位血液迅速压迫脑实质,导致血肿和脑部血液循环障碍、血肿周围形成水肿、血脑屏障损伤在内的继发性脑损伤[2]。有研究表明,炎症反应在继发性脑损伤中发挥关键作用,参与脑出血后继发性脑水肿及脑组织损害过程[3]。脑出血后炎症反应主要发生在白细胞和小胶质细胞,这些细胞释放核转录因子-κB(NF-κB)等多种毒性因子,进一步加重脑损伤[4]。目前治疗脑出血的内科手段为使用药物减轻脑水肿、降血压、预防脑疝形成等,外科以清除脑血肿为主要方法[5]。目前治疗急性期脑出血可快速起效,但恢复期仍需针对性加强抗炎治疗帮助神经系统的保护和恢复。塞来昔布主要用于缓解骨关节炎症状和急性疼痛,也可用于癌症的治疗[6]。有研究表明,塞来昔布能有效减轻脑出血病人脑水肿[7]。关于塞米昔布在脑出血恢复期抗炎抗神经毒性机制的研究较少。本研究以雄性SD大鼠为研究对象,将大鼠头部置入导管注射股动脉血建立脑出血模型,腹腔注射塞来昔布和Toll样受体4(TLR4)抑制剂(TAK-242)进行干预,通过观察大鼠神经功能损伤和检测TLR4、NF-κB、谷氨酸转运体1(GLT-1)水平,探讨塞来昔布对脑出血模型大鼠TLR4/NF-κB信号通路及GLT-1的影响。
1 材料与方法
1.1 实验动物 雄性SPF级SD大鼠90只,体重(230±20)g,鼠房模拟昼夜交替(12 h/12 h),温度(24±2)℃,相对湿度37%~47%。动物自由饮水、进食,定期更换垫料。
1.2 实验药品及试剂 塞来昔布(美国辉瑞制药有限公司生产,货号:20180510,规格:每片200 mg),TAK-242(美国MCE公司生产,货号:HY-11109),兔抗TLR4多克隆抗体、兔抗NF-κB p105/p50单克隆抗体、兔抗GLT-1单克隆抗体和兔抗GAPDH单克隆抗体均购自英国Abcam公司,货号分别为:ab217274、ab32360、ab205247、ab181602,HRP标记的羊抗兔二抗(武汉博士德生物工程有限公司生产,货号:BA1054)。
1.3 实验方法
1.3.1 动物分组与给药 将90只雄性SPF级SD大鼠分为假手术组、模型组、低剂量组、中剂量组、高剂量组和抑制剂组,造模成功后向大鼠腹腔注射给药,低剂量组、中剂量组、高剂量组分别腹腔注射塞来昔布50 mg/(kg·d)、100 mg/(kg·d)、200 mg/(kg·d)[8],抑制剂组以3 mg/(kg·d)注射TAK-242[9],连续给药2周后进行神经功能评分及后续实验。
1.3.2 动物造模 为保证动物造模成功和一致性,采用大鼠右侧尾状核置入套管注射股动脉血方法构建脑出血模型[10]。SD大鼠以3%戊巴比妥钠(1.2 mL/kg)腹腔注射麻醉,待针刺大鼠四肢无明显搔爬反应,将头部固定在数显脑立体定位仪上。打开大鼠头皮找到前囟,以前囟为原点,定位右侧尾状核(A 2.0,L3.0)。颅骨钻打开此点约1.5 mm2面积颅骨,向尾状核置入套管,医用脑胶封闭伤口。周围颅骨打入自攻螺丝,牙科水泥固定套管。待牙科水泥凝固后,从定位仪上取下大鼠,待其苏醒后静养1周用于造模。
麻醉大鼠,使用头皮针采集大鼠股动脉血0.4 mL待用,拧开套管帽拔出套管内芯,微量进样器连接套管内管吸取50 μL大鼠自体股动脉血,将套管内管插入套管完成注射,停留2 min再拔出内管,套管内芯插入套管,拧上套管帽。假手术组以50 μL生理盐水代替。造模完成后第1天给药,无法自主进食的大鼠进行辅助灌胃。
1.3.3 样本采集 对所有大鼠进行神经评分测试。测试后进行腹腔麻醉,使用解剖针将四肢固定在蜡盘上。每组选5只大鼠,用手术剪打开胸腔,眼科剪刀剪开心包膜暴露心脏后灌入生理盐水,直至右心房流出清水样液体,继续灌入4%多聚甲醛,颈部和四肢僵硬1 min后停止灌流,取出右脑组织于4 ℃条件下4%多聚甲醛中固定24 h用于免疫组化实验。其余10只大鼠直接取右脑组织,保存-80 ℃冰箱中待用,采用实时荧光定量聚含酶链式反应(RT-PCR)和免疫印迹法(Western Blotting)检测。
1.3.4 大鼠神经功能评分测定 各组大鼠结束给药12 h后进行神经功能评分测定,参照改良Bederson评分法[11]。5分法:评分<1分,无明显神经功能损伤;评分1~<2分,轻度损伤,提尾悬空时无法顺利伸展左前肢;评分2~<3分,中度损伤,前行时向左打弯;评分3~<4分,中重度损伤,站立不稳并左侧;评分4~<5分,重度损伤,不能自发行走、意识不清。
1.3.5 免疫组织化学法检测大鼠脑组织GLT-1表达 采用0.2 mol/L磷酸缓冲盐溶液(PBS)将免疫组化提取的脑组织清洗干净,使用手术刀片冠状切面截取导管针前后约2 mm脑组织,脱水、透蜡、包埋,之后石蜡组织切片,切片厚度约6 μm。切片脱蜡至水,对切片进行微波抗原修复。5%牛血清白蛋白(BSA)封闭,加兔抗鼠GLT-1单克隆抗体(1∶1 000)4 ℃条件下过夜,再加二抗37 ℃孵育1 h后,使用DAB试剂盒显色,显色过程控制显色本底水平。冲洗掉DAB残留后用水溶性封片剂封片,拍照获得切片图像。使用Image J 15.1软件分析图像阳性区域积分光密度。
1.3.6 RT-PCR检测大鼠脑组织TLR4、NF-κB、GLT-1 mRNA表达 从-80 ℃冰箱中取每个部分组织,采用总RNA提取试剂盒提取总RNA,紫外分光光度计法测定RNA含量、纯度后,再使用cDNA试剂盒合成cDNA。以GADPH为参比基因,分析各组mRNA含量,采用2-ΔΔCq法。引物由上海生工生物工程股份有限公司设计,引物序列见表1。
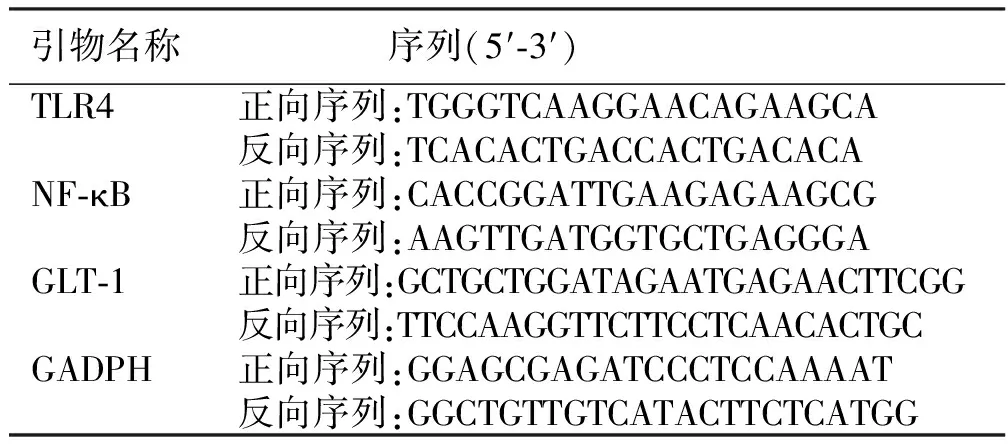
表1 RT-PCR引物序列
1.3.7 Western Blotting检测大鼠脑组织TLR4、NF-κB、GLT-1蛋白表达量 取1.3.6剩余组织在冰盒上研磨,加蛋白提取液后于冰块上静置1 h。4 ℃条件下高速离心15 min,使用BCA试剂盒检测总蛋白含量和纯度。待符合要求后进行凝胶电泳。电泳结束后切下目的条带,转膜仪将目的蛋白转移到NC膜上。5%小牛血清封闭,分别加入对应的一抗二抗进行孵育(一抗稀释比例:TLR4 1∶200、NF-κB 1∶200、GLT-1 1∶500,二抗稀释比例:1∶2 000)。显色后使用凝胶成像仪曝光拍照,根据条带分析各组蛋白表达。
1.4 统计学处理 采用SPSS 21.0统计软件进行分析,计量资料以均数±标准差(x±s)表示,同时保留两位小数,各组间比较采用单因素方差分析(One-Way ANOVA),两两组间比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠神经功能评分比较 与假手术组比较,模型组神经功能评分升高(P<0.05);与模型组比较,抑制剂组和低剂量组、中剂量组、高剂量组神经功能评分降低(P<0.05);与抑制剂组、低剂量组比较,中剂量组、高剂量组神经功能评分降低(P<0.05)。详见表2。

表2 各组大鼠神经功能评分比较(x±s) 单位:分
2.2 免疫组化检测大鼠脑组织GLT-1表达 与假手术组比较,模型组GLT-1积分光密度升高(P<0.05);与模型组比较,抑制剂组和低剂量组、中剂量组、高剂量组GLT-1积分光密度降低(P<0.05);与抑制剂组比较,低剂量组、中剂量组GLT-1积分光密度升高(P<0.05),高剂量组GLT-1积分光密度降低(P<0.05);与低剂量组比较,高剂量组GLT-1积分光密度降低(P<0.05);与中剂量组比较,高剂量组GLT-1积分光密度降低(P<0.05)。详见图1、表3。
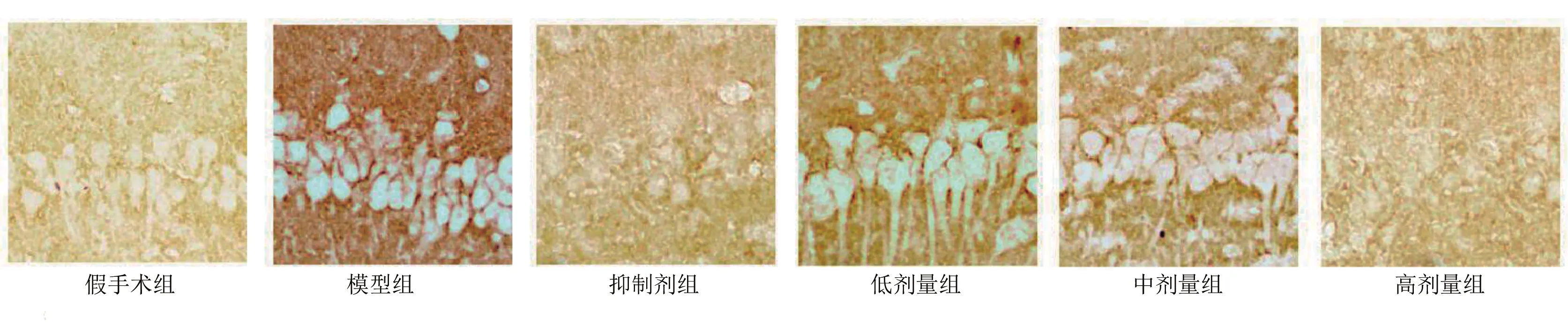
图1 各组大鼠脑组织GLT-1免疫组化图像(×200)

表3 各组大鼠脑组织GLT-1积分光密度比较(x±s)
2.3 RT-PCR检测大鼠脑组织TLR4、NF-κB、GLT-1 mRNA表达 与假手术组比较,模型组TLR4、NF-κB、GLT-1 mRNA表达均升高(P<0.05);与模型组比较,抑制剂组和低剂量组、中剂量组、高剂量组TLR4、NF-κB、GLT-1 mRNA表达均降低(P<0.05);与抑制剂组比较,低剂量组、中剂量组、高剂量组TLR4 mRNA表达均升高,低剂量组、中剂量组GLT-1 mRNA表达升高,低剂量组NF-κB mRNA表达升高(P<0.05);与低剂量组比较,中剂量组、高剂量组TLR4、NF-κB、GLT-1 mRNA表达均降低(P<0.05);与中剂量组比较,高剂量组TLR4、NF-κB、GLT-1 mRNA表达均降低(P<0.05)。详见表4。
表4 各组大鼠脑组织TLR4、NF-κB、GLT-1的mRNA表达比较
2.4 Western Blotting检测大鼠脑组织TLR4、NF-κB、GLT-1蛋白表达 与假手术组比较,模型组TLR4、NF-κB、GLT-1蛋白表达量均升高(P<0.05);与模型组比较,抑制剂组和低剂量组、中剂量组、高剂量组TLR4、NF-κB、GLT-1蛋白表达量均降低(P<0.05);与抑制剂组比较,低剂量组、中剂量组、高剂量组TLR4均升高(P<0.05),低剂量组、中剂量组NF-κB均升高(P<0.05),低剂量组GLT-1蛋白表达量升高(P<0.05);与低剂量组比较,中剂量组、高剂量组NF-κB蛋白表达量降低,高剂量组TLR4和GLT-1蛋白表达量均降低(P<0.05);与中剂量组比较,高剂量组TLR4、NF-κB蛋白表达量均降低(P<0.05)。详见图2,表5。
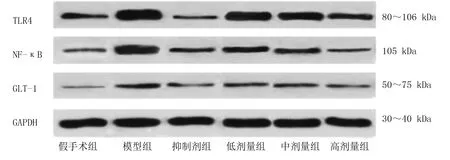
图2 各组大鼠脑组织TLR4、NF-κB、GLT-1蛋白表达电泳图
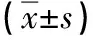
表5 各组大鼠脑组织TLR4、NF-κB、GLT-1蛋白表达比较
3 讨 论
谷氨酸是中枢神经系统中含量最多的兴奋性氨基酸[12]。有研究发现,清除谷氨酸转运体主要依靠星型胶质细胞膜上GLT-1和谷氨酸-胱氨酸转运体[13],两者通过摄取谷氨酸维持突触间隙谷氨酸浓度处于低水平。GLT-1是含量丰富的谷氨酸转运体,前脑中超过90%的谷氨酸转运是通过GLT-1完成[14]。Zhou等[15]研究表明,通过下调NF-κB/GLT-1信号通路抑制GLT-1过表达,进而减轻脑出血小鼠星形胶质细胞驱动的谷氨酸神经毒性。因此,抑制GLT-1过表达有利于减轻大鼠脑出血后谷氨酸神经毒性。TLR4是一种跨膜识别蛋白,广泛分布于血小板、白细胞、巨噬细胞和中枢神经系统中的小胶质细胞、星形胶质细胞和神经元中。TLR4在免疫识别、炎症调节等各个方面发挥重要作用[16]。TLR4受体复合物与NF-κB关键调节因子结合,促使NF-κB抑制蛋白激酶磷酸化,引起NF-κB核转位,使肿瘤坏死因子、白细胞介素-β、白细胞介素-6等促炎因子过表达,从而加重炎症反应[17]。因此,抑制TLR4/NF-κB通路可减轻脑出血部位炎症反应。
本研究结果显示,模型组神经功能评分、TLR4 mRNA及蛋白表达、NF-κB mRNA及蛋白表达均高于假手术组。Teng等[18]发现,小鼠脑出血模型建立后6~72 h 内TLR4 mRNA和NF-κB蛋白表达不断增加,并长期维持较高水平。与模型组结果相符,说明动物造模成功。TAK-242可抑制TLR4表达,而抑制剂组TLR4水平低于假手术组。与模型组比较,抑制剂组NF-κB水平降低,这可能是TLR4在TLR4/NF-κB通路中的下调作用引起。
塞来昔布属于非甾体消炎药,是一种常见的选择性环氧酶2抑制剂。有研究表明,塞来昔布可能通过抑制NF-κB进而抑制环氧酶2表达[19]。各剂量组NF-κB较模型组显著下降,且随剂量增大呈下降趋势。相关研究发现,塞来昔布干预癫痫模型大鼠后,血清、脑皮质和海马中TLR4 mRNA均降低,说明塞来昔布可能对TLR4有下调作用。低剂量组、中剂量组、高剂量组TLR4 mRNA和蛋白表达量与剂量呈负相关[20]。Gupta等[21]研究表明,脑外伤时NF-κB对GLT-1基因表达有上调作用。与模型组比较,抑制剂组、低剂量组、中剂量组、高剂量组GLT-1均降低。NF-κB是除了TLR3外其他TLRs的共同下游分子[22]。抑制剂组TLR4水平最低,抑制剂组NF-κB和GLT-1蛋白和mRNA表达量与高剂量组比较均差异无统计学意义,说明通过TLR4/NF-κB通路抑制TLR4间接下调GLT-1作用有限。这可能是由于抑制TLR4过程中,其他TLRs活化补偿NF-κB下调。塞来昔布可下调NF-κB水平,一方面下游肿瘤坏死因子、白细胞介素-β等促炎因子降低有利于减轻神经元损伤、凋亡,另一方面抑制GLT-1过表达有利于控制脑出血后谷氨酸神经损害。从神经功能评分结果来看,塞来昔布能显著改善脑出血后大鼠神经功能。
综上所述,塞来昔布通过下调脑出血大鼠TLR4/NF-κB通路发挥抗炎作用保护脑组织,同时调控GLT-1过表达进而减轻谷氨酸神经毒性。
