塞来昔布对去卵巢骨质疏松症的保护机制研究
2022-07-11阿尖措王德元
王 彧,阿尖措,王德元
(青海红十字医院骨科二病区,青海 西宁 810000)
骨重塑是由成骨细胞介导的骨形成与破骨细胞介导的骨吸收所形成的动态平衡[1]。绝经后骨质疏松症是一种与衰老有关的常见病,主要发生于绝经后妇女,由于雌激素缺乏导致骨量减少及骨组织结构变化,易出现病理性骨折,严重影响患者的生活质量[2]。针对骨吸收和骨形成介导的骨重塑是治疗绝经后骨质疏松症的重要策略。目前,临床上抑制骨吸收的药物主要有雌激素、二膦酸盐、降钙素等,但这些药物通常具有潜在的副作用,对于绝经后骨质疏松症的治疗并不理想,故临床迫切需要寻找新的治疗药物[3-4]。
破骨细胞是一种造血干细胞/多核巨细胞的单核细胞,其刺激和分化主要由核因子-κB(nuclear factor-κB,NF-κB)配体(receptor activator of NF-κB ligand,RANKL)的受体激活剂调节。RANKL主要通过各种信号通路(如NF-κB、AKT、MAPK和JNK)促进破骨细胞的分化,是一种调节骨代谢的重要细胞因子[5-6]。有研究发现,活化T-细胞核因子1(nuclear factor of activated T-cells cytoplasmic 1,NFATc1)是RANKL介导的破骨细胞分化的关键转录因子[7]。NFATc1可以诱导与破骨细胞分化有关的各种基因的转录,如组织蛋白酶K(cathepsin K,CTSK)、抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRACP)和降钙素受体(calcitonin receptor,CTR)等[7]。
塞来昔布是一种高度选择性的环氧化酶-2(cyclooxygenase-2,COX-2)抑制剂,可通过减少前列腺素的形成来发挥抗炎和镇痛作用[8]。塞来昔布是唯一获得美国食品药品监督管理局批准的COX-2抑制剂,临床用于缓解骨关节炎和成人类风湿关节炎的症状和体征,或治疗成人急性疼痛。有研究发现,塞来昔布灌胃可以调节大鼠骨代谢稳态[9]。但塞来昔布对骨代谢调节的具体作用和机制尚不清楚,因此,本研究探讨塞来昔布对骨代谢稳态的影响及其对骨质疏松症的保护作用,以期为临床提供参考。
1 材料与方法
1.1 试剂、细胞与动物
塞来昔布购自湖北鑫润德化工有限公司;胎牛血清(fetal bovine serum,FBS)、α-极限必需培养基(α-minimum essential medium,α-MEM)均购自美国Hyclone公司;巨噬细胞集落刺激因子(macrophage colony stimulating factor,M-CSF)购自美国Sigma公司;p-NF-κB、NF-κB、活化T细胞核因子(nuclear factor of activated T-cells,NFAT)、GAPDH和辣根素过氧化酶(horseradish peroxidase,HRP)标记抗兔抗体均购自美国CST公司。RAW264.7和MC3T3-E1细胞均购自美国典型培养物保藏中心,并培养于含10%FBS和100 U/mL青霉素/链霉素的α-MEM中。SPF级雌性C57BL/6J小鼠[生产许可证号:SCXK(青)2021-0003]30只,购自青海省实验动物中心,饲养于SPF级动物房,所有动物实验均经过我院伦理委员会批准(20210318086)。
1.2 细胞培养
小鼠骨髓来源巨噬细胞(bone marrow-derived macrophages,BMDM)分离于C57BL/6小鼠的股骨和胫骨骨髓,培养于α-MEM(含10%FBS、2 mmol/L L-谷氨酰胺和100 U/mL青霉素/链霉素)中,并添加M-CSF。
1.3 细胞活力检测
将BMDM培养于96孔板(6×103个/孔)中,加入M-CSF(25 ng/mL)培养,然后用不同浓度(0 μmol/L、2 μmol/L、4 μmol/L、8 μmol/L、10 μmol/L和20 μmol/L)的塞来昔布处理5 d。于第5天加入CCK-8并避光孵育2 h,然后用酶标仪于450 nm处测量吸光度值,计算细胞活力。
1.4 破骨细胞形成检测
将BMDM培养于24孔板(8×104个/孔)中,随机分为对照组、RANKL组、RANKL+8 μmol/L组、RANKL+10 μmol/L组和RANKL+20 μmol/L组,对照组加入α-MEM培养基,其余各组加入含RANKL(50 ng/mL)的α-MEM培养基;RANKL+8 μmol/L组、RANKL+10 μmol/L组和RANKL+20 μmol/L组再分别加入不同浓度(8 μmol/L、10 μmol/L和20 μmol/L)的塞来昔布干预。每2 d更换一次培养液,第5天固定细胞并进行TRACP染色,拍照观察破骨细胞生成情况(破骨细胞具有3个以上的细胞核)。
1.5 实时聚合酶链反应(real time polymerase chain reaction,RT-PCR)
将BMDM培养于6孔板(1×105个/孔)中,给予M-CSF(25 ng/mL)和RANKL(50 ng/mL)处理,然后加入不同浓度(8 μmol/L、10 μmol/L和20 μmol/L)的塞来昔布干预5 d。将MC3T3-E1细胞培养于6孔板(1.5×105个/孔)中,随机分为对照组、8 μmol/L组、10 μmol/L组和20 μmol/L组,分别加入α-MEM培养基以及8 μmol/L、10 μmol/L和20 μmol/L的塞来昔布干预48 h。根据说明书用Trizol裂解液提取细胞总RNA,按照说明书用逆转录试剂盒将1 μg RNA逆转录成cDNA。根据说明书采用SYBR染料试剂盒进行荧光定量,AB StepOne plus RT-PCR system仪器于95 ℃预变性5 min,95 ℃变性10 s,60 ℃延伸30 s,共40个循环,最后根据2-ΔΔCt法计算目的基因的相对表达量,以β-actin作为内参。引物均由上海生工生物工程有限公司合成和提供,引物序列见表1。

表1 RT-PCR引物序列
1.6 荧光素酶报告基因试验
根据说明书将稳定转染NF-κB和NFAT荧光素酶报告基因的RAW264.7细胞培养于48孔板中,随机分为对照组、RANKL组、RANKL+8 μmol/L组、RANKL+10 μmol/L组和RANKL+20 μmol/L组。对照组加入α-MEM培养基进行处理;RANKL组加入RANKL(50 ng/mL)处理24 h;RANKL+8 μmol/L组、RANKL+10 μmol/L组和RANKL+20 μmol/L组预先用不同浓度(8 μmol/L、10 μmol/L和20 μmol/L)的塞来昔布处理1 h,然后加入RANKL(50 ng/mL)处理24 h,检测NF-κB和NFAT活性。
1.7 Western blot
将稳定转染NF-κB和NFAT荧光素酶报告基因的RAW264.7细胞按照1.6步骤处理,采用Western blot检测细胞中p-NF-κB、NF-κB、NFAT的表达水平。细胞裂解后提取细胞总蛋白,采用SDS-PAGE凝胶电泳分离样品,然后转移到PVDF膜上。室温下将膜于5%脱脂牛奶中封闭1 h,然后将其与一抗(p-NF-κB、NF-κB、NFAT和GAPDH,按1∶1 000稀释)于4 ℃摇晃孵育过夜,与二抗(HRP标记抗兔抗体,按1∶10 000稀释)于室温孵育2 h,然后用ECL试剂曝光显影。
1.8 去卵巢骨质疏松症小鼠模型构建及放射学分析
雌性C57BL/6J小鼠30只随机分为对照组、模型组、塞来昔布低剂量(12.5 mg/kg)组、塞来昔布中剂量(25 mg/kg)组和塞来昔布高剂量(50 mg/kg)组,每组6只。参考文献[10]用10%水合氯醛麻醉小鼠,并切除卵巢,术后1周对照组和模型组灌胃0.9%生理盐水,塞来昔布低剂量组灌胃12.5 mg/kg塞来昔布,塞来昔布中剂量组灌胃25 mg/kg塞来昔布,塞来昔布高剂量组灌胃50 mg/kg塞来昔布,每天1次,连续6周。对小鼠进行安乐死,分离胫骨,固定在4%多聚甲醛中24 h。采用微计算机断层扫描(micro-CT,Skycan,比利时)进行放射学分析,每个像素的电压、电流和分辨率分别设置为50 kV、400 μA和8.88 μm,定量计算骨体积/总体积(bone volume/tissue volume,BV/TV)值、骨小梁分离度(trabecular bone separation,Tb.Sp)和骨小梁数目(trabecular bone number,Tb.N)。
1.9 统计学处理
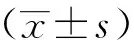
2 结果
2.1 塞来昔布对BMDM细胞活力和破骨细胞形成的影响
BMDM细胞活力检测结果显示,与对照组(0 μmol/L)比较,不同浓度(2 μmol/L、4 μmol/L、8 μmol/L、10 μmol/L和20 μmol/L)的塞来昔布处理5 d不影响细胞活力,因此选取最高的3个浓度(8 μmol/L、10 μmol/L和20 μmol/L)用于后续研究,见图1a。TRACP染色结果显示,与对照组比较,RANKL可诱导BMDM生成破骨细胞;但相较于RNAKL组,RANKL+8 μmol/L组、RANKL+10 μmol/L组和RANKL+20 μmol/L组的破骨细胞生成明显减少,见图1b~f。
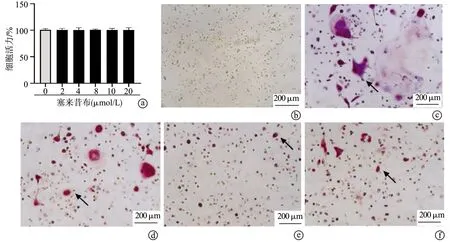
a:BMDM细胞活力;b:对照组;c:RANKL组;d:RANKL+8 μmol/L组;e:RANKL+10 μmol/L组;f:RANKL+20 μmol/L组 黑色箭头:破骨细胞图1 塞来昔布对BMDM细胞活力和破骨细胞形成的影响
2.2 塞来昔布抑制RANKL诱导破骨细胞相关基因的表达
与对照组比较,RANKL组细胞中NFATc1、TRACP、CTSK和CTR mRNA水平显著增加(P<0.001);与RANKL组比较,RANKL+10 μmol/L组和RANKL+20 μmol/L组细胞中NFATc1、TRACP、CTSK和CTR mRNA水平显著下降(P<0.001),RANKL+8 μmol/L组中细胞TRACP、CTSK和CTR mRNA水平显著下降(P<0.001),见图2。
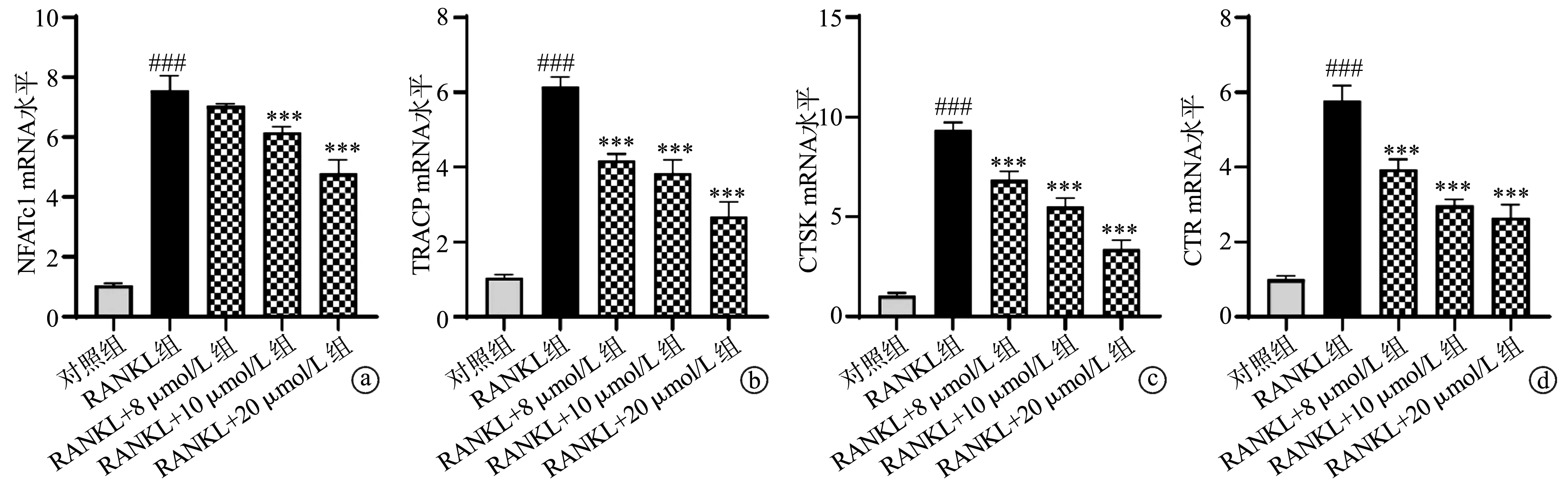
a:BMDM细胞中NFATc1 mRNA水平;b:BMDM细胞中TRACP mRNA水平;c:BMDM细胞中CTSK mRNA水平;d:BMDM细胞中CTR mRNA水平 ###:与对照组比较,P<0.001;***:与RNAKL组比较,P<0.001图2 塞来昔布对破骨细胞相关基因表达的影响
2.3 塞来昔布抑制RANKL诱导NF-κB和NFAT的表达
荧光素酶报告基因试验结果显示,与对照组比较,RANKL组细胞中NF-κB和NFAT活性明显增强(P<0.001);但相较于RANKL组,RANKL+8 μmol/L组、RANKL+10 μmol/L组和RANKL+20 μmol/L组细胞中NF-κB和NFAT活性明显降低(P<0.001),见图3a、b。Western blot结果显示,与对照组比较,RANKL组细胞中p-NF-κB和NFAT蛋白表达明显增强;但相较于RANKL组,RANKL+8 μmol/L组、RANKL+10 μmol/L组和RANKL+20 μmol/L组细胞中p-NF-κB和NFAT蛋白表达明显降低,见图3c。

a:RAW264.7细胞中NF-κB活性;b:RAW264.7细胞中NFAT活性;c:RAW264.7细胞中p-NF-κB和NFAT的蛋白表达 ###:与对照组比较,P<0.001;**:与RANKL组比较,P<0.01;***:与RANKL组比较,P<0.001图3 塞来昔布对NF-κB和NFAT活性和表达的影响
2.4 塞来昔布对成骨细胞增殖和成骨相关基因表达的影响
细胞活力检测结果显示,与对照组比较,用不同浓度(8 μmol/L、10 μmol/L和20 μmol/L)的塞来昔布处理MC3T3-E1细胞可以明显促进细胞增殖,见图4a。与对照组比较,10 μmol/L组和20 μmol/L组细胞中BMP-2、Runx2和ALP mRNA表达水平均升高(P<0.001),8 μmol/L组仅ALP mRNA表达水平升高(P<0.01),见图4b~d。
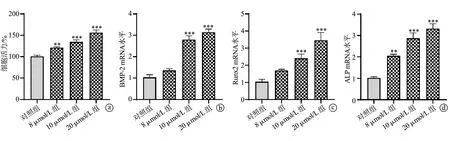
a:MC3T3-E1细胞活力;b:MC3T3-E1细胞中BMP-2 mRNA水平;c:MC3T3-E1细胞中Runx2 mRNA水平;d:MC3T3-E1细胞中ALP mRNA水平 **:与对照组比较,P<0.01;***:与对照组比较,P<0.001图4 塞来昔布对成骨细胞增殖和成骨相关基因表达的影响
2.5 塞来昔布对去卵巢小鼠骨丢失的影响
体内实验结果显示,与对照组比较,模型组小鼠BV/TV和Tb.N显著减小(P<0.001),Tb.Sp显著增加(P<0.001);但与模型组比较,塞来昔布低剂量组、塞来昔布中剂量组和塞来昔布高剂量组小鼠BV/TV和Tb.N显著增加(P<0.01),Tb.Sp显著减小(P<0.01),见图5。
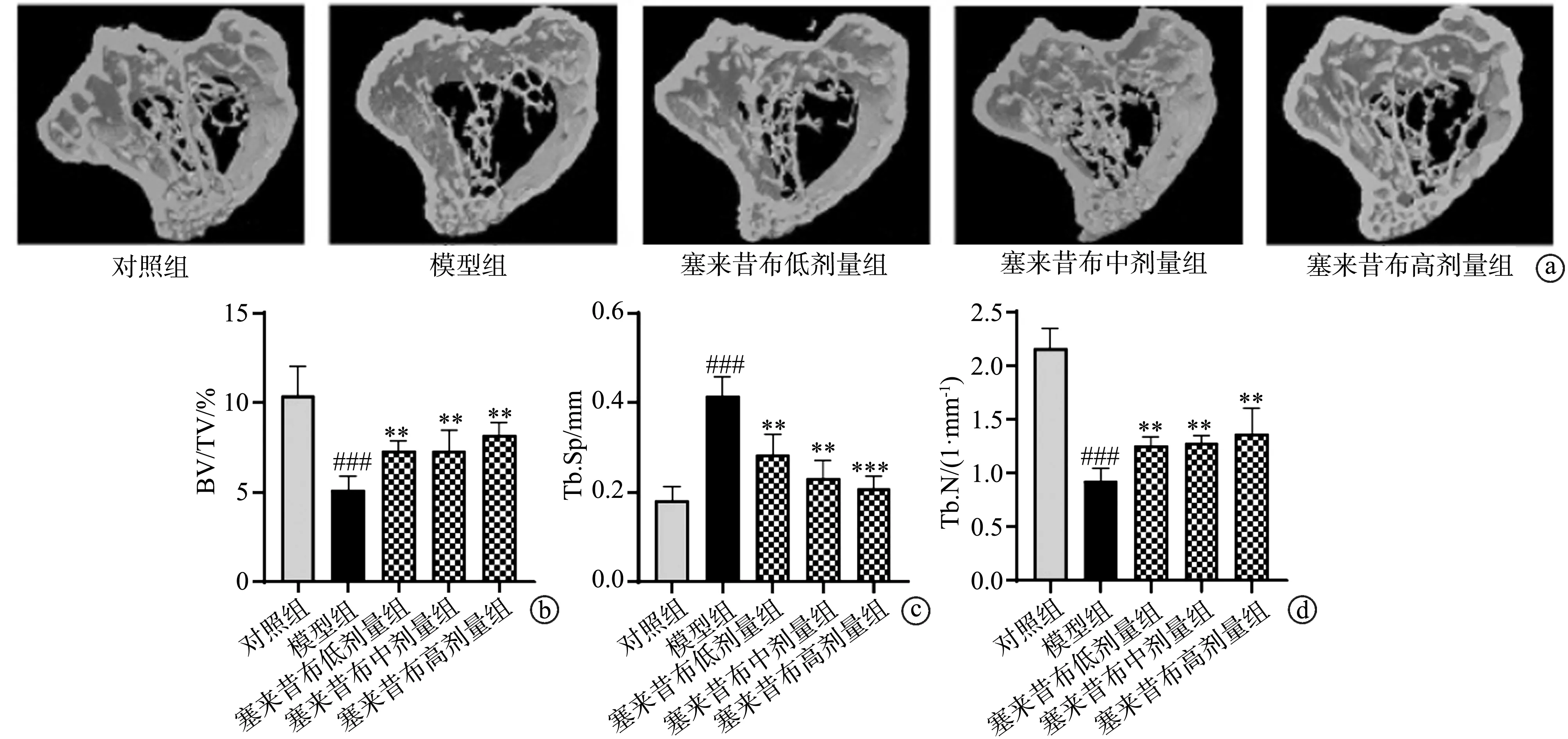
a:各组小鼠miro-CT图片;b:BV/TV;c:Tb.Sp;d:Tb.N ###:与对照组比较,P<0.001;**:与模型组比较,P<0.01;***:与模型组比较,P<0.001图5 塞来昔布对去卵巢小鼠骨丢失的影响
3 讨论
骨质疏松症主要与成骨细胞介导的骨形成与破骨细胞介导的骨吸收间的稳态有关,通常是由破骨细胞的骨吸收超过成骨细胞的骨形成而引起[11]。破骨细胞的过度骨吸收是由较高的RANKL水平和相关下游基因的表达增强引起的,该途径已成为治疗溶骨性疾病的主要靶标[12]。二膦酸盐通过抑制破骨细胞的功能来保护骨骼,但具有下颌骨坏死和肾功能衰竭等风险。有研究发现,多种中草药活性成分可抑制破骨细胞的分化并缓解骨质疏松症,但其成药性比较缓慢[13]。塞来昔布是一种选择性COX-2抑制剂,已被批准用于临床治疗骨关节炎和类风湿性关节炎,有研究发现塞来昔布可以调节骨代谢稳态[9]。本研究结果显示,塞来昔布可以抑制破骨细胞形成,并能够促进成骨细胞增殖,对去卵巢骨质疏松症具有潜在的治疗作用。
为了研究塞来昔布对破骨细胞分化的作用和机制,本研究首先提取了小鼠BMDM细胞,结果显示,塞来昔布可抑制BMDM向破骨细胞分化,但不影响BMDM细胞活力。RANKL属于肿瘤坏死因子,是破骨细胞形成的关键细胞因子[14]。RANKL与受体RANK结合后可以激活NF-κB、TRAF和NFATc1等信号通路,并调节破骨细胞的分化[15]。NF-κB信号通路是RANKL诱导破骨细胞分化的重要途径,RANKL与RANK结合后可促进IKKα和IKKβ磷酸化,从而诱导IκB降解并引起NF-κB活化[16]。本研究结果显示,塞来昔布通过抑制NF-κB磷酸化来抑制NF-κB的转录活性,表明塞来昔布可以抑制经典的NF-κB通路。NFATc1是破骨细胞分化的关键转录因子,NF-κB激活后可诱导NFATc1活化,NFATc1也可调节和控制破骨细胞分化标记基因(如CTSK、TRACP和CTR等)的表达[17]。本研究结果显示,塞来昔布可以抑制NFATc1的蛋白表达和转录活性。目前尚不能确定塞来昔布是否可直接抑制NFATc1的活性或间接抑制NF-κB的活性。但本研究发现,塞来昔布可以显著降低破骨细胞相关蛋白NFATc1、CTSK、TRACP和CTR mRNA的表达。上述结果表明塞来昔布可通过阻断NF-κB和NFATc1介导的信号通路抑制破骨细胞的分化。
不同浓度的塞来昔布可促进小鼠成骨细胞MC3T3-E1增殖,具有促进骨形成作用。Runx2是RUNXX家族的成员之一,作为成骨细胞特异的转录因子,对成骨细胞的分化和成熟具有重要作用[18]。Runx2基因敲除在小鼠生长过程中可以诱导体内骨骼完全丧失。Runx2与成骨细胞的主要细胞外基质基因的表达密切相关,如碱性磷酸酶、骨钙素、Ⅰ型胶原、骨唾液蛋白和骨桥蛋白[19]。另外,有研究发现,BMP和Runx2信号通路可调节成骨细胞的增殖和分化,并在骨形成中起关键作用,且成骨细胞还可通过调节骨保护素表达调节骨吸收,以维持骨稳态[20]。本研究结果显示,不同浓度的塞来昔布可以诱导成骨细胞BMP-2、Runx2和ALP表达,说明塞来昔布可通过调节成骨细胞分化和成熟分子的表达促进成骨细胞增殖,其可能具有潜在的抗骨质疏松症活性。因此,本研究采用卵巢切除术构建去卵巢骨质疏松症小鼠模型,探讨塞来昔布抗骨质疏松症的体内活性。
卵巢切除术动物是一种常见的绝经后骨质疏松症体内研究模型,广泛应用于绝经后骨质疏松症的病理和药物干预研究[21]。骨稳态失调可以触发骨矿物质密度的丢失,从而导致骨质疏松症。去卵巢诱导的小鼠表现出明显降低的骨矿物质密度和异常的骨小梁结构特性[22]。因此,本研究构建去卵巢小鼠模型探究塞来昔布抗骨质疏松症的体内活性,结果显示,与对照组比较,模型组小鼠BV/TV和Tb.N显著减小,Tb.Sp显著增加,说明本研究成功建立了骨质疏松症小鼠模型;进一步研究发现,塞来昔布明显改善了去卵巢小鼠的骨微结构。这些结果说明塞来昔布具有抗骨质疏松症的体内活性,其作用机制可能与调节骨吸收和骨形成间的代谢平衡有关。
综上所述,本研究发现COX-2抑制剂塞来昔布具有潜在的抗骨质疏松症活性,并与调节骨代谢有关。但塞来昔布治疗骨质疏松症的具体靶点或直接的信号通路尚不清楚,仍需进一步探讨。
