玫瑰花色苷水提液颜色稳定性的研究
2021-03-23余佳熹于雅静吕远平
余佳熹,于雅静,吕远平,2*
(1.四川大学 轻工科学与工程学院,成都 610065;2.四川大学健康食品科学评价体系研究中心,成都 610065)
玫瑰(RosarugosaThunb.),是蔷薇科蔷薇属多年生常绿或落叶灌木,原产于中国华北、朝鲜及日本等地区,现今在保加利亚、土耳其、法国等国家和地区被广泛种植,是一种重要的香料植物[1-2]。玫瑰中富含维生素C、维生素B和胡萝卜素等多种维生素[3-5],目前对玫瑰的应用主要在提取玫瑰精油方面,玫瑰中还含有花青素和黄酮类物质,值得进一步研究[6-8]。
花色苷是类黄酮酚类化合物[9],是由花青素配基与糖基通过糖苷键结合形成的配糖体[10-11],其广泛存在于植物的花、叶中,具有典型的C6-C3-C6骨架结构[12]。花色苷中含有大量的双键,而这些双键容易被可见光激发,从而呈现出不同的颜色,因此,花色苷中电子的相对流动性对鲜花呈色至关重要[13]。花色苷是天然的水溶性色素[14],无毒无害,广泛作为食品添加剂应用于食品行业中,其分子中含有大量化学性质活泼的酚羟基和甲氧基等取代基,在加工过程中稳定
性较差,其颜色和活性容易受到pH、温度、光照、金属离子等影响[15]。因此,本试验以饮料加工环境为背景,采用CIELAB色空间中的L*、a*、b*及色差值△E*为评价指标,探究水质、光照、温度、pH值以及常用食品添加剂(柠檬酸、抗坏血酸、吐温、山梨酸钾、苯甲酸钠、EDTA-2Na、阿斯巴甜、木糖醇)对玫瑰花色苷水提液稳定性的影响,为玫瑰花色苷作为天然色素应用于食品加工中提供了理论依据。
1 材料与方法
1.1 材料与试剂
中华1号玫瑰花瓣:四川千领农业科技有限公司提供;试验中所使用的试剂均为分析纯。
1.2 仪器与设备
CM-5分光测色计 柯尼卡美能达株式会社;UV-2000紫外可见分光光度计 尤尼柯(上海)仪器有限公司;ESJ210-4A电子天平 沈阳龙腾电子有限公司;ST2100实验室pH计 奥豪斯仪器有限公司;XK96-A快速混匀器 江苏新康医疗有限公司;Milli-Q Direct水纯化系统 默克密理博公司;HWS-26电热恒温水浴锅 上海齐欣科学仪器有限公司。
1.3 方法
1.3.1 玫瑰花色苷提取方法
称取4.0 g玫瑰花瓣粉末,加入200 mL pH值为3.0的超纯水,在55 ℃水浴锅中加盖浸提4 h,经抽滤后得到玫瑰花色苷超纯水提液。
1.3.2 CIELAB测定方法[16]
将玫瑰花色苷超纯水提液转移至厚度为2 mm的石英比色皿中,选择CM-5分光测色计的液体测量模式,使用标准光源D65,以超纯水为空白校准,在25 ℃恒温下测定L*、a*、b*值的动态变化,并通过计算获得△E*值,每个样品平行测定3次。规定△E*>3.5时,肉眼能观察到色泽的变化。
1.3.3 环境因素对玫瑰花色苷稳定性的影响
1.3.3.1 水质对玫瑰花色苷稳定性的影响
将1.3.1方法中使用的超纯水以自来水代替,获取玫瑰花色苷自来水提液。调整两种水提液的pH至3.0,置于避光条件下保存。以0 h时两种水提液的初始L*、a*、b*值为标准值,测定两种水提液在0~150 h内L*、a*、b*值的变化,计算△E*值。
在518 nm下测定初始花色苷水提液的吸光度A0及存放150 h后水提液的吸光度A1,按照下式计算色素保存率。
色素保存率(%)=A1/A0×100%。
1.3.3.2 光照对玫瑰花色苷稳定性的影响
玫瑰花色苷超纯水提液分别置于散射光和避光条件下保存。测定水提液△E*值和色素保存率。
1.3.3.3 温度对玫瑰花色苷稳定性的影响
玫瑰花色苷超纯水提液分别于4,25,37,70 ℃下避光保存。测定水提液△E*值和色素保存率。
1.3.4 pH值对玫瑰花色苷稳定性的影响
调整玫瑰花色苷超纯水提液pH值分别为1.0,2.0,3.0,4.0,5.0,7.0,9.0,避光保存。测定不同pH条件下水提液的△E*值和色素保存率。
1.3.5 食品添加剂对玫瑰花色苷稳定性的影响
根据GB 2760-2014《食品添加剂使用标准》,参考饮料加工过程中常见食品添加剂及其用量,选定加入到玫瑰花色苷超纯水提液的添加剂及其添加量分别为:柠檬酸(0.5%)、抗坏血酸(0.25%)、吐温80(0.6%)、山梨酸钾(0.2%)、苯甲酸钠(0.2%)、EDTA-2Na(0.0075%)、阿斯巴甜(0.06%)、木糖醇(0.5%)。水提液中加入不同食品添加剂后置于避光条件下保存,测定不同pH条件下水提液的△E*值和色素保存率。
2 结果与分析
2.1 环境因素对玫瑰花色苷稳定性的影响
水质、光照和温度对玫瑰花色苷水提液颜色稳定性的影响见图1~图3和表1。
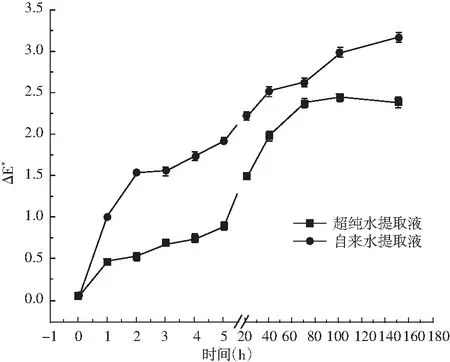
图1 水质对玫瑰花色苷水提液颜色稳定性的影响

图2 光照对玫瑰花色苷水提液颜色稳定性的影响

图3 温度对玫瑰花色苷水提液颜色稳定性的影响Fig.3 Effect of temperature on color stability of rose anthocyanin aqueous extract solution

因素超纯水/散射光超纯水/避光自来水温度(℃)4253770A00.64910.64910.58720.59780.59780.59780.5978A10.47230.48550.40910.41130.39780.37230.2783保存率(%)72.7674.8069.6768.8066.5462.2846.55
由图1和表1可知,用自来水及超纯水提取的玫瑰花色苷在150 h内,其△E*值都处于上升趋势,自来水提取液和超纯水提取液的△E*值都未超过3.5,说明肉眼都不能观察到变化。在避光条件下,自来水提取液和超纯水提取液放置150 h后,玫瑰花色苷保存率分别为69.67%和74.80%。两种水质造成的差别可能是由于自来水中的金属离子及杂质,这些物质与花色苷发生反应,导致自来水提取液的颜色变化以及花色苷保存率大于超纯水提取液。但从两种提取液的颜色变化和花色苷保存率来看,水质对玫瑰花色苷水提液颜色稳定性的影响较小。
由图2和表1可知,玫瑰花色苷水提液在散射光或避光条件下保存时,在0~150 h内,△E*值都随时间的增加而逐渐增大,但都未超过3.5,说明肉眼都不能观察到变化。从玫瑰花色苷保存率来看,避光条件下保存的玫瑰花色苷水提液中的花色苷保存率略高于散射光条件下保存的玫瑰花色苷水提液,二者的花色苷保存率分别为74.80%和72.76%。花色苷的降解受光照影响,基态的花色苷吸收光能后转变为激发态,激发态花色苷的C4位发生水解,生成中间产物C4加合物,随后该C4加合物的C2位水解开环形成另一中间产物,生成查尔酮,该中间产物继续降解生成酚酸和醛类[17]。该结果说明玫瑰花色苷水提液应保存在避光条件下。
由图3和表1可知,温度会影响玫瑰花色苷水提液颜色稳定性。4,25,37 ℃下保存的玫瑰花色苷水提液在5 h内的△E*值变化不大,且都小于3.5,即肉眼无法观察到颜色的变化,此后37 ℃下玫瑰花色苷水提液颜色变化较大。70 ℃下保存的玫瑰花色苷水提液的色差变化较大,1 h时就迅速增加到7左右,且随时间的增加颜色变化更加明显,在150 h后△E*值达到了19左右,而色素保存率仅有46.55%。花色苷的热降解过程遵循一级反应动力学,红色黄烊盐阳离子(AH+)的失电子与水化反应带来熵增大,使花色苷降解为不稳定的查尔酮或α-二酮,然后降解为苯甲酸和2,4,6-三羟基苯甲醛等物质[18]。该结果说明玫瑰花色苷水提液应用于饮料加工时应采用低温杀菌的方式,并在较低温度下储存。
2.2 pH值对玫瑰花色苷稳定性的影响
温度对玫瑰花色苷水提液△E*值和花色苷保存率的影响见图4和表2。

图4 pH值对玫瑰花色苷水提液颜色稳定性的影响Fig.4 Effect of pH value on color stability of rose anthocyanin aqueous extract solution

pH值1234579Λmax(nm)513515518524无特征吸收峰588A00.78320.72820.52310.5016——0.3908A10.61230.51740.3710.2973——0.1298保存率(%)78.1871.0570.9259.27——33.21
试验过程中观测到pH值为1~3时,玫瑰花色苷水提液初始颜色为深红色,玫瑰花色苷保存率均高于70%,pH值为1时玫瑰花色苷保存率最高达到了78.18%。pH值为4~5时,玫瑰花色苷水提液初始颜色为浅红色,0~150 h色差随时间的增加而增大,玫瑰花色苷保存率低于60%。pH值为7~9时,玫瑰花色苷水提液初始颜色为墨绿色,室温条件下避光保存1 h后色差迅速增大,达到肉眼可观察到的程度,150 h时△E*值最大,达到48.78,而玫瑰花色苷保存率仅有33.21%。pH值对玫瑰花色苷水提液颜色稳定性的影响较大,这是因为花色苷分子中除了有酸性的酚羟基外,其吡喃环上还有一个具有碱性的四价氧原子,溶液的pH值不同,花色苷存在于溶液中的结构不同[19]。从试验结果看,玫瑰花色苷在酸性条件下的稳定性高于碱性条件,说明玫瑰花色苷适用于酸性饮料的加工。
2.3 食品添加剂对玫瑰花色苷稳定性的影响
为探究饮料加工中食品添加剂对玫瑰花色苷的影响,根据常用于饮料中的食品添加剂以及GB 2760-2014《食品添加剂使用标准》,选取8种常用食品添加剂:酸度调节剂(柠檬酸)、抗氧化剂(抗坏血酸)、稳定剂(吐温80、EDTA-2Na)、防腐剂(山梨酸钾、苯甲酸钠)、甜味剂(阿斯巴甜、木糖醇)。
2.3.1 柠檬酸、抗坏血酸对玫瑰花色苷稳定性的影响
在玫瑰花色苷水提液中分别加入不同质量分数的柠檬酸(酸度调节剂)、抗坏血酸(抗氧化剂),避光放置150 h后色素保存率见表3。柠檬酸对玫瑰花色苷水提液颜色稳定性的影响见图5,抗坏血酸对玫瑰花色苷水提液颜色稳定性的影响见图6。

表3 柠檬酸和抗坏血酸对玫瑰花色苷保存率的影响Table 3 Effect of citric acid and ascorbic acid on the retention rates of rose anthocyanins

图5 柠檬酸对玫瑰花色苷水提液颜色稳定性的影响

图6 抗坏血酸对玫瑰花色苷水提液颜色稳定性的影响
由图5可知,柠檬酸的添加量≤5%时,玫瑰花色苷水提液的色差随时间的延长而增大。而且在试验过程中发现,相比于未添加任何食品添加剂的空白对照组,柠檬酸的添加使水提液颜色向深红变化,且溶液中柠檬酸浓度越大,其颜色变化越明显,与色差值的增大规律一致。由表3可知,在避光放置150 h后,不同浓度的柠檬酸均使玫瑰花色苷水提液的色素保存率增大,浓度越高,保存率越大,且出现花色苷保存率高于100%,达163.32%。在酸性条件下,花色苷主要以红色的黄烊盐阳离子(AH+)形式存在,使水提液颜色加深。柠檬酸的添加,使pH值下降,这也是保存率大于100%的原因;且在溶液pH值较低时,花色苷稳定性较强,则溶液中柠檬酸在一定范围内越多,玫瑰花色苷水提液色素保存率越大,这说明在玫瑰类饮料加工中根据需求适量添加柠檬酸,可以提高其颜色稳定性。
在试验过程中发现,向玫瑰花色苷水提液中加入浓度在0.25%以内的抗坏血酸时,有玫瑰花色苷水提液红色褪去的现象,且抗坏血酸浓度越高,褪色现象越明显,图6中的曲线也反映出色差值增大的变化趋势。由表3可知,抗坏血酸的添加会降低玫瑰花色苷水提液的色素保存率,且随抗坏血酸浓度升高,花色苷保存率降低。当水提液中抗坏血酸浓度为0.25%时,常温避光放置150 h后色素保存率低至21.27%。具有还原性的抗坏血酸在有氧条件下被氧化为H2O2,H2O2使花色苷分子生成无色的查尔酮等物质,查尔酮进一步降解为沉淀物,这说明在玫瑰类饮料加工中,应尽量避免使用抗坏血酸等还原剂。
2.3.2 稳定剂对玫瑰花色苷稳定性的影响
稳定剂对玫瑰花色苷水提液颜色稳定性的影响见表4和图7。

表4 稳定剂对玫瑰花色苷保存率的影响Table 4 Effect of stabilizers on the retention rates of rose anthocyanins

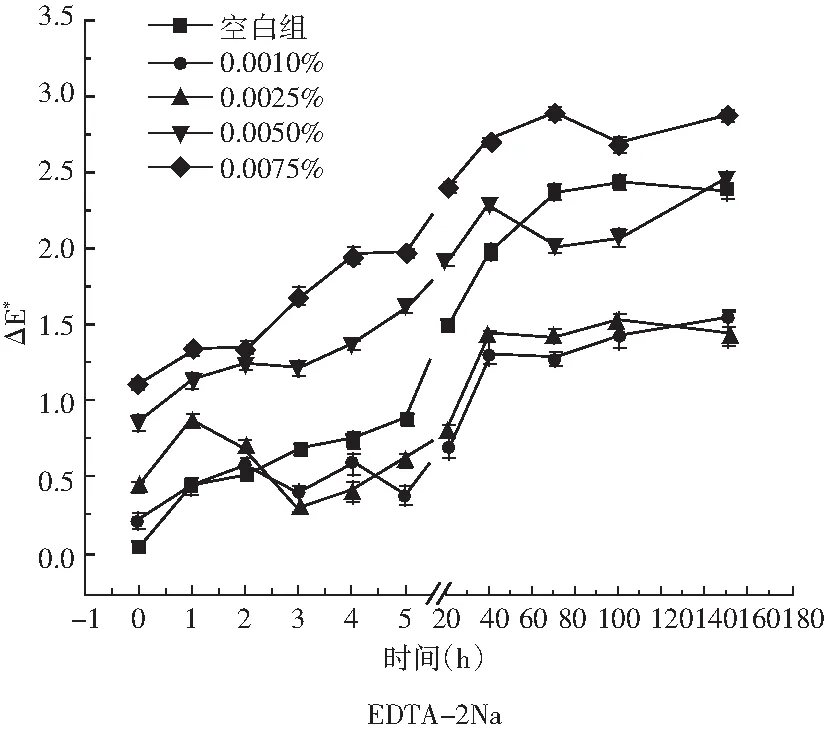
图7 稳定剂对玫瑰花色苷水提液颜色稳定性的影响
由表4和图7可知,EDTA-2Na对玫瑰花色苷水提液的色素保存率和颜色稳定性影响都较小。随着玫瑰花色苷水提液中EDTA-2Na添加量和放置时间的增加,其△E*值逐渐增大,但均未超过3.5,即肉眼无法观察到颜色的变化。EDTA-2Na(乙二胺四乙酸二钠)可与金属离子螯合形成络合物,在玫瑰花色苷水提液中,EDTA-2Na与其中的金属离子结合,从而减少了金属离子对玫瑰花色苷水提液的色素保存率和颜色稳定性的影响。EDTA-2Na水溶液呈酸性,酸性条件也有利于玫瑰花色苷的稳定性。由此可见,EDTA-2Na是适用于玫瑰类饮料加工中的稳定剂。
吐温80(聚氧乙烯山梨醇酐单油酸酯)的加入会对玫瑰花色苷水提液的色素保存率和颜色稳定性造成影响,由表4和图7可知,随着吐温80浓度的增大,玫瑰花色苷保存率下降,颜色变化增大。吐温80容易与抗氧化剂、显色剂等结合形成沉淀,从而使玫瑰花色苷水提液变浑浊,因此,在玫瑰类饮料加工中,应尽量避免使用吐温80。
2.3.3 防腐剂对玫瑰花色苷稳定性的影响
山梨酸钾和苯甲酸钠对玫瑰花色苷水提液颜色稳定性的影响见图8、图9和表5。

图8 山梨酸钾对玫瑰花色苷水提液颜色稳定性的影响

图9 苯甲酸钠对玫瑰花色苷水提液颜色稳定性的影响Fig.9 Effect of sodium benzoate on color stability of rose anthocyanin aqueous extract solution
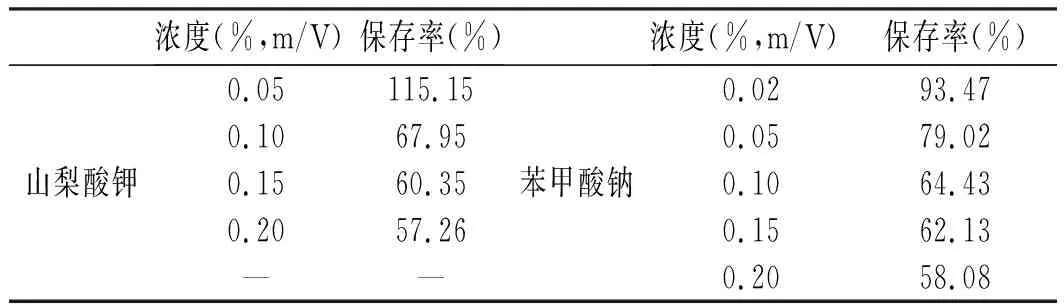
浓度(%,m/V)保存率(%)浓度(%,m/V)保存率(%)山梨酸钾0.05115.150.1067.950.1560.350.2057.26——苯甲酸钠0.0293.470.0579.020.1064.430.1562.130.2058.08
由图8和图9可知,山梨酸钾和苯甲酸钠对玫瑰花色苷水提液颜色稳定性的影响都较大,且随二者添加量的增加,玫瑰花色苷保存率减小,玫瑰花色苷水提液色差增加。加入山梨酸钾和苯甲酸钠后玫瑰花色苷水提液的颜色迅速发生了变化,水提液红色褪去、颜色变暗,山梨酸钾造成的颜色改变更大。由表5可知,当山梨酸钾的浓度为0.05%时,玫瑰花色苷保存率达到了115.15%,高于空白对照组(74.80%),但随着添加量增加,玫瑰花色苷保存率骤减至70%以下,甚至在山梨酸钾的浓度为0.20%时,玫瑰花色苷保存率仅有57.26%。当苯甲酸钠的浓度为0.05%以内时,玫瑰花色苷保存率也优于空白对照组。山梨酸钾和苯甲酸钠的水溶液呈弱碱性,碱性条件不利于花色苷的稳定。因此,在将玫瑰花色苷应用到饮料加工中时,应尽量降低防腐剂的用量。
2.3.4 甜味剂对玫瑰花色苷稳定性的影响
甜味剂对玫瑰花色苷水提液颜色稳定性的影响见表6和图10。
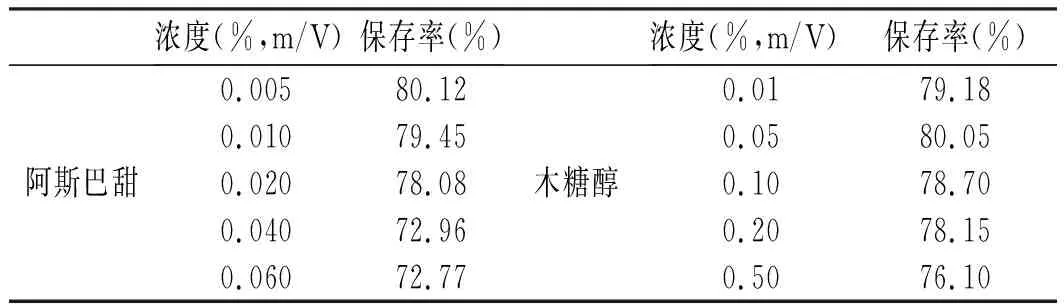
表6 甜味剂对玫瑰花色苷保存率的影响Table 6 Effect of sweeteners on the retention rates of rose anthocyanins
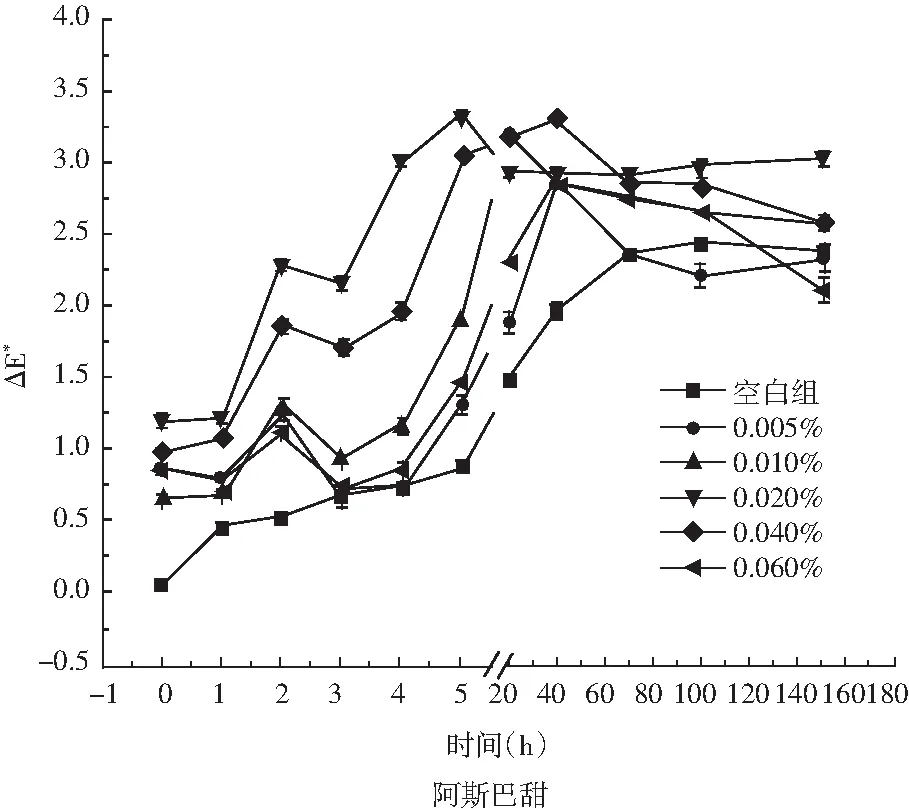

图10 甜味剂对玫瑰花色苷水提液颜色稳定性的影响
由图10可知,向玫瑰花色苷水提液中添加不同质量分数的阿斯巴甜和木糖醇,避光放置150 h内,水提液中色差△E*增加,但肉眼无法观察到颜色的变化(△E*<3.5)。随着阿斯巴甜和木糖醇添加量的增加,玫瑰花色苷保存率和空白对照组接近,阿斯巴甜和木糖醇对玫瑰花色苷稳定性的影响较小。阿斯巴甜是一种非碳水人造甜味剂,木糖醇是一种天然甜味剂,二者水溶液呈弱酸性,酸性条件有利于花色苷的稳定。
3 结论
本研究以玫瑰花色苷作为天然色素应用于饮料加工为背景,探究了水质、光照、温度、pH值、常见食品添加剂对玫瑰花色苷保存率、玫瑰花色苷水提液颜色稳定性的影响。结果表明,自来水提取液和超纯水提取液的颜色变化和花色苷保存率相近,水质对玫瑰花色苷水提液颜色稳定性的影响较小。避光条件更有利于玫瑰花色苷水提液中花色苷的稳定。温度对玫瑰花色苷水提液颜色稳定性的影响较大,高于37 ℃时玫瑰花色苷水提液颜色变化较大。玫瑰花色苷在酸性条件下稳定性高于碱性条件。柠檬酸添加量的提高,有利于花色苷水提液色素保存率增大。抗坏血酸的添加会降低玫瑰花色苷水提液的色素保存率,且抗坏血酸质量分数越高,保存率越低;吐温80、山梨酸钾和苯甲酸钠对玫瑰花色苷水提液颜色稳定性的影响都较大。EDTA-2Na、阿斯巴甜和木糖醇对玫瑰花色苷的影响较小。
因此,当玫瑰花色苷作为天然色素应用到饮料加工中时,可使用一般水质,加工过程中注意避光且控制温度在37 ℃以下。在使用食品添加剂方面,可使用柠檬酸作为酸度调节剂,以EDTA-2Na作为稳定剂,以低质量分数的山梨酸钾和苯甲酸钠作为防腐剂,以阿斯巴甜和木糖醇作为甜味剂,慎用抗坏血酸等还原剂。
