基于ARMS-TaqMan的EGFR基因E21突变检测
2021-03-23金秀妍宋岩岩于源华
金秀妍,宋岩岩,于源华
(长春理工大学 生命科学技术学院,吉林 长春 130022)
0 引 言
EGFR基因的主要作用是将细胞外的信号传入细胞内部,调节细胞增殖和分化过程。EGFR 基因突变可能导致 EGFR 蛋白的活化,促进肿瘤细胞的增殖、迁移、分化和血管新生,还能抑制肿瘤细胞的凋亡[1]。EGFR 基因突变主要发生在外显子 18、 19、 20 和 21 上[2]。非小细胞肺癌(NSCLC)中有多种EGFR 基因突变。针对常用靶向药物阿法替尼和达克替尼而言[3],可将EGFR基因突变分为两大部分,即敏感性增强突变和耐药突变。其中敏感性增强突变有19号外显子的缺失突变和21号外显子的L858R点突变,而20号外显子上的T790M突变为耐药突变[4]。采用个性化靶向药物治疗非小细胞肺癌时,仅对EGFR基因敏感性增强的突变患者效果明显,而其它耐药突变患者完全无效。因此对患者基因突变情况进行了解,特别是确定是否存在EGFR基因敏感性增强的突变,能否采用上述靶向药物是进行治疗的关键[5-6]。
常用的EGFR基因突变检测方法有DNA测序法、突变体富集PCR法(mutant-enriched PCR)、TaqMan探针法和DNA等温扩增技术[7-11]。上述方法都能对EGFR的基因突变做出检测,但各有优缺点。如DNA 测序法有检测精度高的优点,但也存在对样本要求高和测序周期长等缺点,限制了在临床上的应用[12]。
近年来,也有EGFR基因突变检测试剂盒问世,如Scorpions ARMS EGFR基因突变检测试剂盒等。但这类试剂盒由其检测方法决定检测费用相对昂贵。TaqMan 探针法因其具有优异的特异性和灵敏度,与其它方法结合可以有效、快速地检测基因突变,引起广泛关注。研究拟采用突变扩增系统(Andmplification Refractory Mutation System, ARMS) 技术和TaqMan荧光探针技术相结合,检测EGFR基因外显子 21点突变,为开发新型廉价EGFR基因的检测方法提供理论基础。
1 材料与方法
1.1 技术原理
TaqMan荧光探针是一种寡核苷酸探针。荧光基团连接在探针的5′末端,淬灭剂连在3′末端。当探针完整时,报告基团发射的荧光信号被淬灭基团吸收,不能发出荧光。PCR扩增时,Taq酶的5′-3′外切酶活性将探针酶切降解,报告荧光基团和淬灭荧光基团分离,可观察到荧光。ARMS引物的3′末端设计在突变位点,最后一个碱基与突变的碱基配对,只有引物3′末端完全配对时,才能正常扩增。当引物3′末端发生错配时,不能有效地扩增。ARMS引物特异性扩增突变位点,TaqMan探针与扩增产物结合,两个技术相结合达到诊断的目的。
传统TaqMan探针法需要针对每一个突变位点设计一对特异性探针,与通用引物共同进行检测。而该原理检测位置相近的突变位点仅需要一条探针,通过引物的改变检测不同位点,可以大大降低检测成本。
1.2 样品与标本
方法构建实验所用109例非小细胞肺癌患者组织切片和组织蜡块,以及与市售试剂盒对比实验用36例非小细胞肺癌患者组织切片和组织蜡块均由上海源奇生物医药科技有限公司提供。HepG2人体肝癌细胞、LoVo人结肠癌细胞、胎盘细胞和大肠杆菌为研究组实验室原有保存。
1.3 试剂与仪器
DP304血液/组织/细胞基因组提取试剂盒(北京天根),DP209普通琼脂糖凝胶 DNA 回收试剂盒(北京天根)。 KT201 2×Taq PCR Master Mix酶(北京天根),AceTaq○RDNA Polymerase(南京Vazyme);dNTPs(南京Vazyme),5X buffer(南京Vazyme),探针由上海生工合成,引物由长春库美合成,5810R型冷冻离心机(Eppendorf); 凝胶成像系统(GeneSys);MX3000P实时荧光定量 PCR 仪(Agilent) 。
1.4 EGFR 21号外显子突变体构建与验证
采用细胞基因组提取试剂盒对肝癌细胞进行基因组DNA的提取,根据EGFR基因序列信息设计相应引物。PCR 反应体系为25 μL,含 2 × Taq DNA聚合酶Mix 12.5 μL,上游引物1 μL,下游引物1 μL,模板1 μL,补ddH2O至25 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃ 30 s、59 ℃ 45 s、72 ℃ 30 s,共 35 个循环;72 ℃ 5min;4 ℃保存。将PCR产物与T载体连接,转化,获得单克隆菌株。
EGFR基因21号外显子中涉及两个点突变,即EGFR基因2 573位置碱基T突变为G(L858R)和EGFR基因2 582位置的碱基T突变为A(L861Q)。以阴性(即未发生突变)质粒为模板诱导定向突变。mR引物与mF引物互补,引物F及引物R为TA克隆扩增外显子21的引物,见表1。

表1 外显子21重叠延伸突变引物设计
首先进行第一轮PCR,将EGFR 基因21号外显子拆分成两部分,产物中有突变位点。将第一轮胶回收的两段产物作为模板,进行第二轮PCR,进行电泳鉴定无误后,将PCR产物转化过夜培养后挑取阳性克隆,提取质粒。采用电泳鉴定和DNA测序验证突变体构建效果。
1.5 实时荧光PCR检测方法建立
设置检测管与内参(Internal Control)管,对基因突变进行检测。检测管检测21号外显子的 L861Q和L858R点突变。内参管检测 EGFR 基因的 3 号外显子序列,主要评价 PCR 扩增效率,与检测管的差值ΔCT值的大小是划定阴阳性的重要指标。以检测管反应体系为例,实时荧光PCR反应体系为25 μL:上游引物-1 0.9 μL,上游引物-2 0.9 μL,下游引物0.9 μL,探针P 0.9 μL,模板DNA 5 μL,Taq酶 0.2 μL,UNG酶 0.1 μL,dNTPs(AGCT) 0.08 μL,dNTPs(AGCU)0.02 μL,补ddH2O至25 μL。实时荧光PCR扩增程序:42 ℃孵育5 min,94 ℃预变性45 s;94 ℃ 45 s、60 ℃ 80 s,共 40个循环。60 ℃时采集荧光信号。
实时荧光PCR引物及探针序列见表2。

表2 实时荧光PCR引物及探针序列
1.6 特异性、灵敏度、分辨率检测
提取实验室培养的HepG2人肝癌细胞、LoVo人结肠癌细胞、人胎盘细胞基因组,利用上述基因组及构建的阴性质粒和阳性质粒作为模板进行特异性检测。
根据提取质粒的OD值计算拷贝数,稀释为105copies/mL、104copies/mL、103copies/mL、102copies/mL、101copies/mL的样品,共设置5个梯度,分别作为模板进行灵敏度检测。
为测试其在阴性人基因组DNA背景下的分辨率,在阴性人基因组DNA 中掺入3%及1%的 E21 突变参考品(104copies/mL)进行分辨率检测。
1.7 临床样品检测
利用上述实验方法,使用109例已知突变的非小细胞肺癌患者组织切片和组织蜡块进行检测,测试方法对实际样品的检测能力。
购买能够检测E21 L858R突变的市售试剂盒与前述方法进行对比,对36例未知突变的样品进行检测和实验结果汇总,并利用kappa系数对两种方法进行比较。
2 结果与分析
2.1 基因突变体的构建
突变体构建电泳鉴定结果如图1所示。
图1(a)是第一轮 PCR产物电泳鉴定结果(M:DNAMarker D2000; 1~4:E21PCR扩增产物),其中mF与R互为上下游引物,F与mR互为上下游引物,即将EGFR 基因21号外显子拆分成两部分。21号外显子基因大小为397 bp,因此产物条带大小不应超过397 bp,电泳结果显示,片段大小正确。将第一轮胶回收的两段产物作为模板,F与R互为上下游引物进行第二轮PCR,经过第二轮PCR,带有突变位点碱基的两段DNA序列拼接到了一起,合成了带有突变碱基的线性目的序列。片段大小应为397 bp,图1(b)电泳鉴定结果(M:DNAMarker D2000 ;1~2:E21PCR扩增产物)显示,片段大小正确。将PCR产物转化过夜培养后挑取阳性克隆,提取质粒进行鉴定(见图1(c))(M:DNAMarker DL15000;1~2:E21突变质粒)。产物大小约为2 900 bp,电泳结果显示,片段大小正确。

(a) E21 PCR产物电泳鉴定结果图 (b) E21第二轮PCR产物电泳鉴定结果图 (c) E21质粒提取电泳结果
将 EGFR 基因突变阳性质粒送往长春库美生物技术公司进行测序。E21发生L858R突变构建体DNA 测序结果如图2所示。
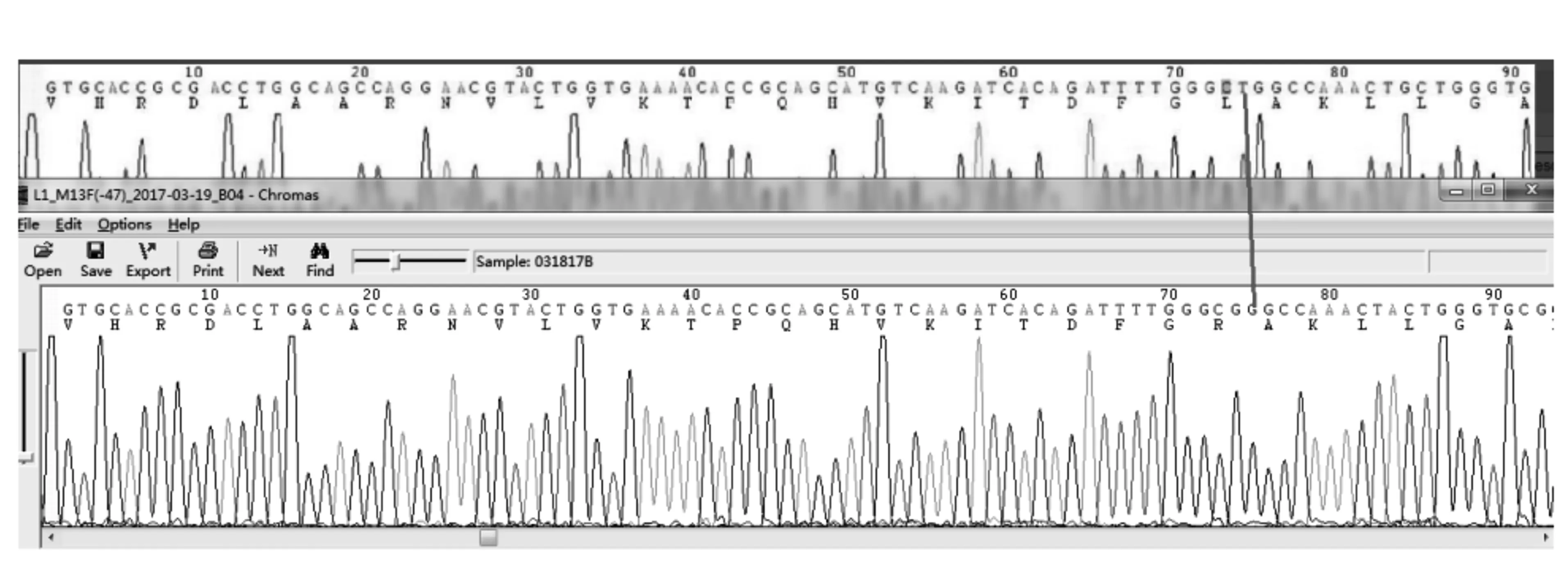
图2 E21 L858R 测序鉴定结果(T碱基突变为G碱基)
图2中上部分为阴性基因序列,下部分为L858R突变体基因序列。由图2可知,T碱基突变为G碱基,可确定L858R突变体构建成功。
E21 发生L861Q突变构建体DNA 测序结果如图3所示。

图3 E21 L861Q 测序鉴定结果(T碱基突变为A碱基)
图中阴性基因序列和L861Q突变体基因序列进行对比,发现T碱基突变为A碱基,说明L861Q突变体也构建成功。
2.2 特异性验证结果
HepG2、胎盘和LoVo三种细胞提取物特异性验证结果见表3。

表3 三种细胞提取物特异性结果
由表3可知,阴性对照组均未发生扩增,阳性对照组扩增效果良好。以三种细胞提取物基因组为模板的内参管中都发生了有效扩增,PCR 扩增效率良好,而E21扩增管虽然发生了非特异性扩增,但ΔCT值均大于10,证明ARMS引物特异性良好。
2.3 灵敏度测试结果
利用灵敏度测试模板对上述所建方法的灵敏度进行测试,结果如图4所示。

图4 E21灵敏度扩增曲线
因模板的每个浓度设置复孔3个,故每个浓度显示三条扩增曲线,三条曲线CT值接近,说明重复性良好。
根据图4将各模板浓度与对应的CT值作图得到灵敏度扩增线性图,如图5所示。
由图5可知,模板浓度在105copies/mL至101copies/mL范围内,模板浓度与对应的CT值呈线性关系。当模板浓度为101copies/mL时,模板浓度与CT值仍基本符合线性关系。综上所述,方法的最低检测限为101copies/mL。与常规TaqMan探针法的最低检测限基本一致。
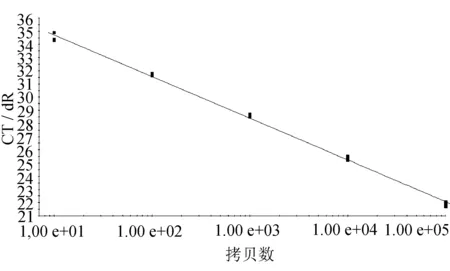
图5 E21灵敏度扩增线性图
2.4 分辨率结果
利用分辨率测试模板对所建方法进行分辨率测试,结果如图6所示。
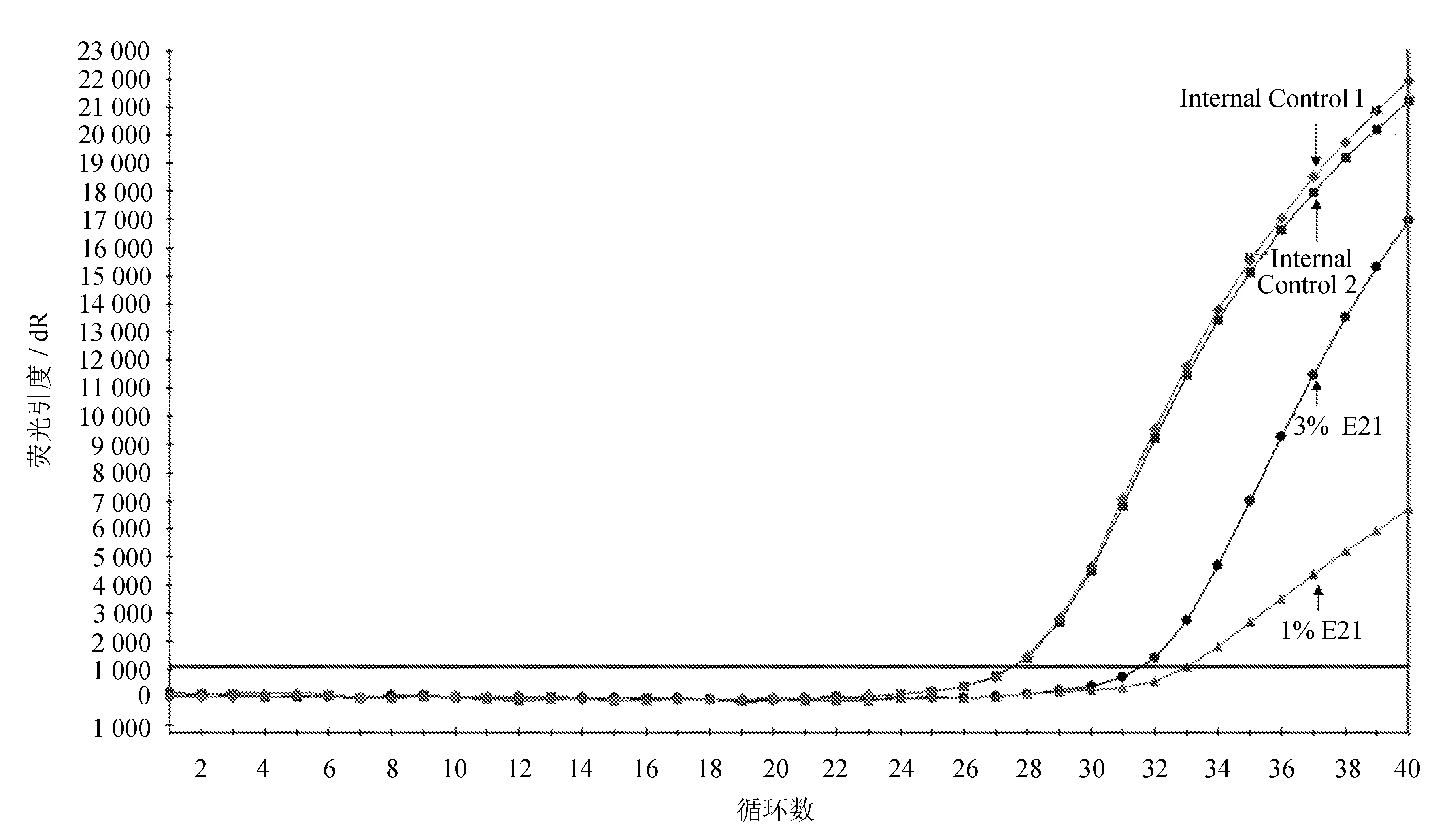
图6 L858R分辨率扩增曲线图
由图6可见,在阴性基因组DNA的背景下,内参管曲线扩增平滑,表明反应中扩增效率良好,PCR反应正常。E21检测管中利用浓度为1%和3%的分辨率测试模板进行反应,均发生扩增,CT值分别为32.96和31.78,均小于35.00。说明在阴性人基因组DNA中1%的E21突变(104copies/mL)仍能很好地检出。
2.5 临床样品检测
采用构建方法检测临床样品,内参管对109例样品的检测结果均为阳性。E21检测管对109 例临床样品进行检验,检测结果显示共22例发生E21突变,突变比例为20.10%(22/109)。与样品实际突变结果相符。反应时间约为2 h,与测序法相比,大大缩短了检测时间。
采用构建的检测方法与市场上购得的EGFR 基因突变检测试剂盒共同对36例未知突变的非小细胞肺癌患者样品进行检测,L858R突变检测结果kappa值见表4。
由表4可知,36例组织样品中,市售 EGFR 基因突变检测试剂盒法检出L858R突变4例(阳性1),未突变32例(阴性1);构建的 ARMS 方法检出L858R突变 4 例(阳性2),未突变32例(阴性2),对于L858R检测来说,两种方法的检出一致率34/36=94.4%,kappa值=0.72。说明两种方法的一致程度高。
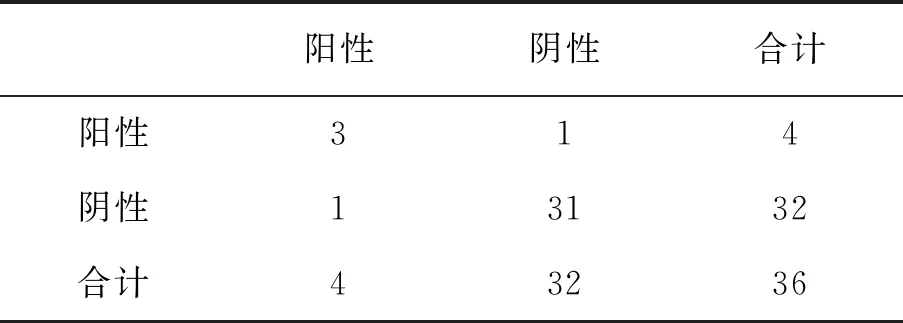
表4 L858R突变kappa值
构建方法检测为阳性而市售EGFR基因突变试剂盒检测为阴性的样品,进行测序,得到测序结果如图7所示。
由图7可见,T碱基突变为G碱基,样品发生了L858R突变,与构建方法测试结果一致。
3 结 语
构建了可检测EGFR基因E21突变的检测方法。该检测方法灵敏度高,最低检测限达到101copies/mL;在阴性人基因组背景下,对浓度为104copies/mL的突变质粒分辨率达到1%,且表现出良好特异性。该方法操作简单、检测耗时短,是一种高效的检测方法。

图7 差异样品测序结果
