地塞米松联合姜黄素对RAW264.7细胞炎症模型的作用
2021-03-23田宝成赵庆沛盛玉辉黄菁华吕青志李珂珂
张 琪 田宝成 赵庆沛 盛玉辉 黄菁华 吕青志 李珂珂
1 滨州医学院药学院 山东 烟台 264003; 2 即墨区第二人民医院 山东 青岛 266214
炎症可发生在心血管系统疾病、自身免疫性疾病、肿瘤等病理过程中,炎症在各类疾病中占据重要地位。地塞米松(dexamethasone, DEX)为糖皮质激素类药物,具有强有力的抗炎效果和免疫调节作用[1],但长期高剂量全身用药会使患者出现免疫抑制,水、电解质代谢紊乱等严重的不良反应。DEX作为P-糖蛋白(P-gp)底物,在长期使用后会出现多药耐药(multidrug resistance, MDR)现象,MDR是临床治疗肿瘤及慢性炎症性疾病失败的主要原因之一[2],逆转MDR现象是当前提高DEX疗效的重要策略[3]。姜黄素(curcumin, CUR)是从姜科植物姜黄中提取的一种黄酮类化合物,具有抗肿瘤、抗缺血、抗炎等生物活性,CUR抑制P-gp的活性也得到实验证实[4]。若DEX与CUR联合使用能够产生协同抗炎作用,则可通过减少DEX的用量,降低药物的毒副作用,同时借助于CUR逆转DEX的MDR作用,进一步提高DEX的疗效。
本研究选用脂多糖诱导的RAW264.7细胞作为炎症细胞模型,以细胞分泌一氧化氮(nitric oxide,NO)的量作为评价指标,考察DEX与CUR联合用药的抗炎作用,应用Chou-Talalay联合指数法评价药物间的相互作用,筛选出DEX与CUR协同抗炎的比例。应用流式细胞术测定细胞对P-gp特异性底物Rh-123的摄取情况,考察在协同配伍摩尔比例下CUR逆转DEX的MDR作用。采用低毒、具有优良生物降解性和生物相容性的聚乳酸-羟基乙酸共聚物(polylactic acid-glycolic acid copolymer, PLGA)作为载体材料[5],采用乳化溶剂挥发法制备DEX/CUR-NPs,考察DEX与CUR两药共载纳米粒的体外抗炎活性,为炎症疾病的治疗提供新的思路与策略。
1 材料与方法
1.1 材料
1.1.1 仪器 HERAcell 150 Heraeus CO2培养箱(美国Thermo Fisher Scientific公司);TD5G离心机(湖南凯达科学仪器有限公司);Usb 2.0倒置显微镜(青岛长基医疗器械有限公司);Spectra Max Mz酶联免疫检测仪(美国Molecular Devices公司);EPICS XL流式细胞仪(美国贝克曼库尔特公司);XHF-D高速分散器(宁波新芝生物科技有限公司);SCIENTZ-IID超声波细胞粉碎机(宁波新芝生物科技有限公司);JEM-1400透射电子显微镜(TEM)(日本电子株式会社)。
1.1.2 药品与试剂 醋酸地塞米松(国药集团试剂有限公司,批号为XW11778731,纯度为98%);姜黄素(国药集团试剂有限公司,批号为GB20150505,分析纯);维拉帕米(Verapamil, VER)(上海阿拉丁生化科技有限公司,批号为L1803208,纯度为99%);罗丹明-123(Rhodamine-123, Rh-123)(上海阿拉丁生化科技有限公司,批号为B1806031,纯度为99%);脂多糖(Lipopolysaccharide, LPS)(美国Sigma公司,批号为028M4094V,纯度≥99%);NO检测试剂盒(碧云天生物技术有限公司,批号为062119191122)。
1.1.3 细胞 小鼠RAW264.7巨噬细胞株,购自北纳创联生物技术有限公司。
1.2 实验方法
1.2.1 细胞培养 将RAW264.7细胞分散于RPMI 1640培养液(含10 %胎牛血清,100 μmol/L青霉素、链霉素)中,在细胞培养箱中进行常规培养,待细胞覆满至培养皿的70%~80%时进行传代。
1.2.2 细胞学实验
1.2.2.1 游离药物细胞活力检测 应用MTT法考察DEX与CUR游离药物单用及合用时对RAW264.7细胞的体外毒性[6]。以每孔5×103个细胞密度接种RAW264.7细胞于96孔板,常规培养24 h后,弃去旧培养基,加入药物进行处理,设置对照组,每组设5个细胞重复孔,给药1 h后用1 μg/mL LPS进行细胞诱导[7],药物与细胞共孵育24 h,通过MTT法检测细胞活力。
1.2.2.2 药物相互作用评价 用Chou-Talalay联合指数法[8]对两药相互作用进行分析,该方法适用于药物单独使用及两药按照固定比例进行混合的情况。按以下公式计算协同指数(CI)值,并判断两种药物的相互作用:CI=D1/Dx,1+D2/Dx,2,其中,D1、D2表示两药联用产生X效应时两药对应的浓度,Dx,1、Dx,2为两药单用产生X效应时对应的浓度。当CI>1时,两药为拮抗作用;当CI=1时,两药为相加作用;当CI<1时,两药为协同作用。
1.2.2.3 DEX与CUR协同抗炎配伍摩尔比例的筛选 以每孔5×104个细胞密度接种RAW264.7细胞于96孔板,常规培养24 h后,弃去旧培养基,加入药物处理,设置DEX浓度为0.005、0.01、0.05、0.1、0.5、1、5、10 μmol/L,CUR浓度为0.5、5、7.5、15、20、25、30 μmol/L,联合给药浓度见表1,设置对照组,每组设5个细胞重复孔。药物处理1 h后,加入1 μg/mL LPS进行细胞诱导。药物与细胞共孵育24 h后收集各组细胞上清液,应用Griess比色法测定各组上清液中NO的含量[9]。应用Calcusyn 2.0软件对数据进行处理,应用Chou-Talalay联合指数法对两药相互作用进行分析。

表1 DEX与CUR不同配伍比例联合用药的给药方案
1.2.2.4 CUR对LPS诱导的RAW264.7细胞Rh-123外排的影响 应用流式细胞术考察CUR对P-gp特异性底物Rh-123外排的影响[10]。实验设置Rh-123组(阴性对照组)、Rh-123+VER组(阳性对照组)、Rh-123+DEX单药(低、中、高剂量)组、Rh-123+DEX+CUR(1∶3、1∶5)组,Rh-123浓度与LPS的活化浓度均为1 μg/mL,实验设置4个复孔。
1.2.3 DEX/CUR-NPs的制备及其质量评价
1.2.3.1 DEX/CUR-NPs的制备及其药剂学性质表征 采用乳化溶剂挥发法制备纳米粒。按照DEX与CUR配伍摩尔比例为1∶5进行投药,称取0.6 mg DEX、3 mg CUR至30 mg/mL的PLGA-二氯甲烷溶液中,超声溶解得油相。在高速剪切力的作用下将油相分散于0.5%PVA的水相中(油水体积比为1∶7.5),用超声波细胞粉碎机进一步稳定后,在室温条件下,搅拌挥发除去有机溶剂,即得DEX/CUR-NPs,并考察其外观形态、粒径分布、电位及其包封率。空白纳米粒的制备除不加药物外,其他条件同上。
1.2.3.2 DEX/CUR-NPs体外释放性能考察 采用动态膜透析法考察DEX/CUR-NPs的体外释放性质[11]。释放介质为含0.5%吐温-80的0.9%氯化钠溶液,吸取2 mL DEX/CUR-NPs及等量浓度的DEX、CUR溶液加至已预处理的透析袋中,并将其置于含20 mL释放介质的离心管,于(37±0.5)℃,50 rpm条件下进行释放,于固定时间点进行取样,测定纳米粒中药物的累计释放率,考察纳米粒的体外释放行为。以时间为横坐标,累计释放率为纵坐标,绘制释放曲线。
1.2.4 DEX/CUR-NPs体外抗炎活性的研究
1.2.4.1 DEX/CUR-NPs细胞活力检测 按照“1.2.2.1”项下游离药物细胞活力的测定方法,在0.01~10 μmol/L DEX浓度范围内测定DEX-NPs、CUR-NPs、DEX/CUR-NPs的细胞存活率,以确定细胞水平上纳米粒抗炎作用研究的安全用药范围。
1.2.4.2 DEX/CUR-NPs体外抗炎作用研究 按照“1.2.2.3”项下游离药物抗炎作用的研究方法,以抑制细胞分泌NO的量为指标,考察DEX/CUR-NPs的体外抗炎活性,实验中游离DEX、DEX-NPs与DEX/CUR-NPs的DEX浓度为0.001、0.025、0.05、0.1、0.5、1 μmol/L,CUR-NPs的CUR浓度为0.005、0.01、0.05、0.1、0.5、1 μmol/L。
1.2.5 DEX/CUR-NPs逆转DEX的MDR的研究 按照“1.2.2.4”项下的方法考察DEX/CUR-NPs逆转DEX的MDR的作用。实验设置阴性对照组(Rh-123),阳性对照组(Rh-123+VER),DEX-NPs组和DEX/CUR-NPs组(低剂量为0.005 μM DEX,中剂量为0.05 μM DEX,高剂量为0.5 μM DEX)。

2 结果
2.1 细胞学实验筛选DEX与CUR的协同抗炎比例
2.1.1 游离药物的细胞毒性 应用MTT法对游离药物细胞活力进行测定,由图1可知,当DEX、CUR药物浓度均<30 μmol/L;DEX与CUR配伍摩尔比例为1∶3时,DEX浓度<10 μmol/L;DEX与CUR配伍比为1∶5时,DEX浓度<1 μmol/L,细胞存活率与对照组相比差异无统计学意义,说明上述浓度可作为细胞水平药物抗炎作用研究的安全用药浓度范围。

与阴性对照组比较,***P<0.001。
2.1.2 DEX与CUR协同抗炎作用结果 应用Chou-Talalay联合指数法筛选DEX与CUR的协同抗炎比例。由图2可知,DEX与CUR均具有抗炎作用,并分别在0.005~10 μmol/L和0.5~30 μmol/L范围内具有剂量依赖性,经计算得DEX单药的ED50为0.71 μmol/L,CUR单药的ED50为35.74 μmol/L。绘制两药联合应用在不同配伍比例下的中值效应曲线(图3)与抑制率-协同指数图(图4),当DEX与CUR配伍比为2∶1、1∶1、1∶3时,两药联合应用在低剂量时表现为拮抗作用;当DEX与CUR配伍比为1∶5时,两药联合应用在各个剂量下均表现为强协同作用,经计算得ED50为0.13 μmol/L。
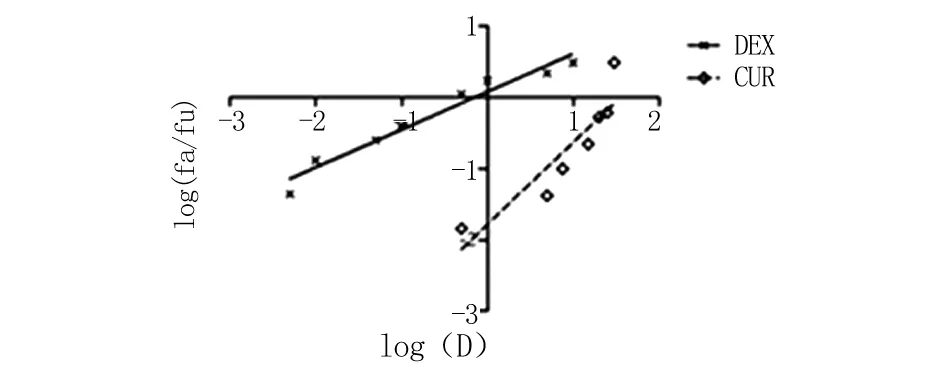
图2 DEX、CUR单药对RAW264.7细胞分泌NO的影响
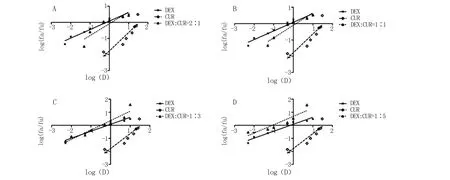
A.2∶1;B.1∶1;C.1∶3;D.1∶5

图4 DEX与CUR联合应用在不同配伍比例下的FA-CI曲线
2.1.3 CUR对Rh-123外排的影响 应用Rh-123外排实验考察CUR对DEX的MDR现象的逆转作用。由图5-A可知,随着DEX浓度的增大,胞内荧光强度逐渐减弱,这可能是由于DEX可增强细胞表面P-gp外排泵的活性,促进荧光物质Rh-123的外排所致。当DEX与CUR以配伍摩尔比例1∶3联合使用时,低浓度的CUR(0.015 μmol/L)抑制P-gp活性作用不显著(P>0.05)(图5B-1)。当两药配伍摩尔比例提高至1∶5时,各个浓度下的CUR均可显著抑制P-gp的活性(P<0.05),且对P-gp的抑制能力比两药配伍摩尔比为1∶3时增强(P<0.05)(图5B-1、B-2、B-3)。

A.DEX对胞内荧光强度的影响;B-1.低浓度;B-2.中浓度;B-3.高浓度。与阴性对照组比较,*P<0.05,**P<0.01,***P<0.001;与DEX单药相比,#P<0.05,##P<0.01,###P<0.001;与DEX∶CUR=1∶3相比,&P<0.05,&&&P<0.001。
2.2 DEX/CUR-NPs的质量评价
2.2.1 DEX/CUR-NPs的药剂学性质表征 采用乳化溶剂挥发法制备的空白纳米粒混悬液的外观呈白色乳光,DEX/CUR-NPs的外观呈淡黄色乳光(图6)。纳米粒的外貌形态通过TEM进行观察(图7),制得的纳米粒呈球形,边界清晰,大小分明。利用Nano-ZS粒度分析仪测定粒径及Zeta电位(图8),采用超滤法测定包封率[12],结果见表2。
表2 纳米粒的药剂学性质

图6 空白纳米粒混悬液(左)、DEX/CUR-NPs(右)的外观状态

A.空白纳米粒;B.DEX/CUR-NPs

A.空白纳米粒;B.DEX/CUR-NPs。
2.2.2 DEX/CUR-NPs的体外释放曲线 应用动态膜透析法考察DEX/CUR-NPs的体外释放性能。由图9可知,游离DEX与CUR分别在24 h与48 h累计释放率达90%以上;而在DEX/CUR-NPs中DEX与CUR分别在96 h与168 h实现完全释放。由此发现,DEX/CUR-NPs可延长药物的释放时间,具有一定缓释作用。

图9 DEX/CUR-NPs释放曲线
2.3 DEX/CUR-NPs体外抗炎活性
2.3.1 纳米粒的细胞毒性 应用MTT法考察各制剂在不同药物浓度下的细胞活力。由图10-A可知,空白纳米粒浓度小于100 μg/mL时,细胞存活率与对照组比较差异无统计学意义,这说明,空白纳米粒在该浓度范围内没有明显的细胞毒性,材料细胞相容性较好。由图10-B可知,当DEX-NPs与CUR-NPs药物浓度小于5 μmol/L,DEX/CUR-NPs中DEX浓度小于1 μmol/L时,没有表现出明显的细胞毒性,故上述浓度可作为细胞水平纳米粒抗炎作用研究的安全用药范围。

A.空白纳米粒;B.载药纳米粒。与对照组比较,***P<0.001。
2.3.2 DEX/CUR-NPs体外抗炎作用 游离DEX、DEX-NPs、DEX/CUR-NPs的ED50分别为0.5174、0.0056、0.0025 μmol/L。图11表明,将DEX制成纳米粒后,DEX抑制RAW264.7细胞分泌NO的能力明显增强;DEX/CUR-NPs抑制炎症细胞分泌NO的能力显著强于各单药纳米粒。这说明,DEX与CUR共负载于纳米粒后具有更好的抗炎活性[13]。

图11 各给药组抑制NO分泌的中值效应曲线
2.3.3 DEX/CUR-NPs逆转DEX的MDR的作用 应用Rh-123外排实验考察DEX/CUR-NPs逆转DEX的MDR作用。由图12可知,与阴性对照组相比,DEX-NPS的中、高浓度(0.05、0.5 μM)可显著降低细胞内的荧光强度(P<0.05)。与DEX-NPS相比,DEX/CUR-NPs在低、中、高浓度下(0.005、0.05、0.5 μM)下均可显著提高细胞内的荧光强度(P<0.05)。这说明,两药共载纳米粒在各个浓度下均可显著抑制P-gp的活性,从而逆转DEX的MDR作用。

与阴性对照组比较,*P<0.05,**P<0.01,***P<0.001;与DEX-NPs相比,#P<0.05,###P<0.001。
3 讨论
炎症在各类疾病发病机制中占据重要地位,中性粒细胞、巨噬细胞等自体免疫细胞的激活是炎症产生和启动的重要环节。当机体细胞受到LPS等外界因素刺激后,机体炎症细胞活化,诱导一氧化氮合酶(iNOs)的合成与表达,促进机体大量释放炎症介质NO。NO是免疫细胞参与机体免疫代谢反应的主要生理性介质,在炎症发生发展过程中起到关键的作用[14]。因此本研究选择细胞分泌NO的量作为药物抗炎作用评价指标,并应用Griess比色法测定NO的含量[15]。
关于药物相互作用的评价方法有很多,Chou-Talalay 联合指数法凭借科学的原理,完备的数学模型以及简便的实验操作等优点,成为使用最为广泛的方法之一[16]。本研究利用上述方法,评价DEX与CUR联合使用在抗炎方面的作用。研究结果表明,DEX与CUR均可通过抑制NO的分泌发挥抗炎作用,DEX与CUR配伍使用的抗炎作用明显强于单药,当DEX与CUR配伍摩尔比例为1∶5时,两药在各个剂量下均可产生良好的协同抗炎活性。当按该比例进行投药,制备的DEX/CUR-NPs的细胞毒明显强于DEX、CUR联合使用。DEX/CUR-NPs抑制NO分泌的ED50为0.002 5 μmol/L,DEX、CUR联合使用的ED50为0.13 μmol/L,说明DEX、CUR经纳米粒包载后可以增加炎症细胞对纳米粒的摄取,从而使DEX/CUR-NPs具有更好的抗炎活性[17]。
药物MDR现象产生的原因之一是细胞表面P-gp的过度表达,Rh-123作为P-gp的特异性底物,是研究P-gp功能活性最常用的药物,活化的巨噬细胞表面高度表达P-gp[17]。CUR除具有广泛的抗肿瘤、抗炎等生物活性外,还可通过抑制细胞表面P-gp的外排功能,发挥逆转药物MDR的作用。因此本研究选择LPS活化的RAW264.7细胞为炎症模型,采用Rh-123外排实验考察CUR对DEX的MDR的逆转作用。预实验发现,在异硫氰酸酯(Fluoresceineisothiocyanate, FITC)通路上,CUR对Rh-123的测定无干扰,因此利用流式细胞术考察CUR在不同配伍摩尔比例下对DEX的MDR逆转作用。由结果可知,CUR可以通过抑制RAW264.7细胞表面P-gp的外排活性,克服DEX的MDR现象,这也可能是DEX配伍CUR发挥协同抗炎作用的潜在机制[18]。
综上所述,DEX与CUR联合使用既能够发挥协同抗炎作用,又能克服长期使用DEX过程中出现的MDR现象。DEX与CUR作为一种抗炎候选组合药物,具有很大的应用潜力。但两药在体内是否也具有类似协同抗炎作用还有待于进一步研究。
