姜黄素促进炎症微环境下大鼠骨髓间充质干细胞骨向分化
2021-03-23董春燕卢永超刘海英徐子琪张韶君
董春燕 卢永超 刘海英 徐子琪 张韶君
1 滨州医学院口腔医学院 山东 烟台 264003;2 千佛山医院口腔科 山东 济南 250001
牙周病是口腔常见疾病,在牙周致病菌刺激下,大量炎症因子激活炎性反应的过程打破了骨改建的内稳态,从而造成机体成骨能力下降和牙周骨组织损伤[1]。目前对于该疾病的治疗和缺损骨组织的修复仍未解决。近年来,许多学者将目光投向再生医学方向,希望通过干细胞的手段进行骨缺损的再生。间充质干细胞(mesenchymal stem cells,MSCs)免疫原性低,具备再生和修复功能,是牙周组织再生良好的种子细胞[2-3]。骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMSCs)具有较强自我更新和多向分化潜能[4],并且其取材方便、来源广泛,成为骨组织工程较理想的来源细胞[5]。干细胞微环境的调控对于牙周组织的再生非常重要[6-7],但是在牙周炎患者的牙周支持组织中,炎症的持续存在会影响MSCs的成骨分化,所以很难实现丧失的骨组织重建[8]。姜黄素为中药姜黄的主要活性成分,因其安全的药理活性被应用于骨质疏松症的治疗[9]。姜黄素对于炎症环境下BMSCs骨向分化能力的影响研究较少,本研究使用肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)建立体外炎症微环境,观察姜黄素对炎症环境下大鼠细胞的增殖情况的影响,用矿化结节染色等方法进行体外细胞实验研究,揭示炎症微环境对BMSCs成骨分化的影响,以便后期进一步研究其可能的调控机制,为牙周炎的治疗和防治提供思路。
1 材料与方法
1.1 试剂与仪器 4周龄wistar雄性大鼠(山东省千佛山医院实验动物中心);磷酸盐缓冲液(phosphate buffered saline,PBS)、双抗(100 U/mL青霉素+100 μg/mL链霉素)、α-MEM培养液、0.25%胰蛋白酶(HyClone,美国);胎牛血清(fetal calf serum,FBS;Gibco,美国);姜黄素、维生素 C、β-甘油磷酸钠、地塞米松、吲哚美辛、胰岛素、IBMX、茜素红染色液、饱和油红O染液、氯化十六烷吡啶、Trizol试剂(Sigma-Aldrich,美国);碱性磷酸酶染色试剂盒(上海碧云天生物技术有限公司);Cell Counting Kit-8(CCK-8)试剂盒(Dojindo公司,日本);HiScript ®ⅢRT反转录试剂盒、SYBR Green荧光定量聚合酶链检测试剂盒(南京诺唯赞生物科技有限公司);倒置相差显微镜(Olympus,日本);全自动酶标仪(Spectro公司,德国);LightCycler480 PCR仪(Roche,瑞士)。
1.2 BMSCs的培养及多向分化能力检测 全骨髓细胞贴壁法培养获得Wistar大鼠BMSCs,第三代细胞用于后续实验。将细胞以2.0×105个/孔的密度接种于6孔板中,接种后加入完全培养液,置于37 ℃、5% CO2的培养箱中静置培养。24 h后弃去培养基,分别加入成骨诱导液(含有地塞米松10-8mol/L、β-甘油磷酸钠10 mmol/L、维生素C 50 mg/L的α-MEM完全培养基)和成脂诱导液(含1 μmol/L 地塞米松、200 μmol/L 吲哚美辛、10 mg/L胰岛素及500 μmol/L IBMX的α-MEM培养液),每3 d换液 1 次。成脂诱导2周后,进行油红O染色;成骨诱导3周后,进行茜素红染色。
1.3 细胞分组 取第三代细胞,分为正常组、炎症组和姜黄素+炎症组。根据相关文献报道及前期实验[10]选用10 ng/mL TNF-α处理BMSCs进行炎症诱导。利用CCK8分别检测1、3、5 d 姜黄素(0.01、0.1、1、10 μmol/L)对细胞活性的影响进行姜黄素浓度的选择。
1.4 CCK-8检测细胞活性 细胞以3×103个/孔接种于96孔板中,加入常规培养液放入恒温培养箱。贴壁24 h后,对细胞进行不同处理,每个样本设置5个复孔,每2天更换1次培养液,分别于培养的1、3、5 d,吸净96孔内的培养基,每孔加入10 μL CCK8溶液和90 μL无血清培养基,将孔板继续孵育1 h后,酶标仪在450 nm波长处测量吸光度值。
1.5 ALP染色及茜素红染色检测细胞骨向分化能力 将细胞以2.0×105个/孔的密度接种于6孔板中,贴壁24 h后,按实验分组方案更换成骨诱导液体外培养细胞,每3 d换液一次。于成骨诱导的第7天行碱性磷酸酶染色;在第14天进行茜素红染色,观察细胞矿化情况,并用十六烷基吡啶水溶液溶解成骨染色结节,将一定量的各组溶解液置于96孔板内,在562 nm 波长下测定吸光光度值。
1.6 RT-PCR检测成骨相关基因表达 将细胞以2.0×105个/孔的密度接种于6孔板中,贴壁24 h后按照不同分组方案继续培养细胞14 d。应用 TRIzol 试剂并参照试剂盒说明书分别提取细胞总RNA,利用HiScript ®ⅢRT反转录试剂盒合成cDNA。使用SYBR Green荧光定量聚合酶链检测试剂盒进行qRT-PCR反应,分别检测骨涎蛋白(bone sialoprotein,BSP)、Runt相关转录因子2(Runx2)的mRNA的表达,以GAPDH作为内参基因,据2-△△CT法计算基因的相对表达量。引物由铂尚生物科技有限公司设计合成。

2 结果
2.1 大鼠BMSCs培养 倒置显微镜下见,培养3 d后大部分BMSCs贴壁,呈现多角形、长梭形;约7 d后,细胞长满培养皿约80%(图1A)。到第3代细胞形态较为均一,无自发性分化现象。对第3代细胞进行成骨诱导后,茜素红染色可见钙化现象(图1B);成脂诱导后油红O染色可见脂滴形成(图1C)。

A.原代BMSCs培养7 d(×40);B.茜素红染色(×40);C.油红O染色(×100)
2.2 CCK-8检测细胞增殖情况 0.01、0.1、1 μmol/L 姜黄素对炎症状态下大鼠BMSCs的增殖无明显影响,各组之间差异无统计学意义,但是在10 μmol/L姜黄素作用下,细胞增殖能力明显下降,P<0.01,见图2。故本研究选择1 μmol/L姜黄素浓度进行实验。

与炎症组比较,**P<0.01。
2.3 ALP及茜素红染色 经过成骨诱导培养,染色结果显示三组细胞均有成骨分化特性,炎症组较正常组染色变浅、矿化结节减少;姜黄素+炎症组染色加深、矿化结节增多(图3、4)。

图3 各组大鼠骨髓间充质干细胞碱性磷酸酶染色
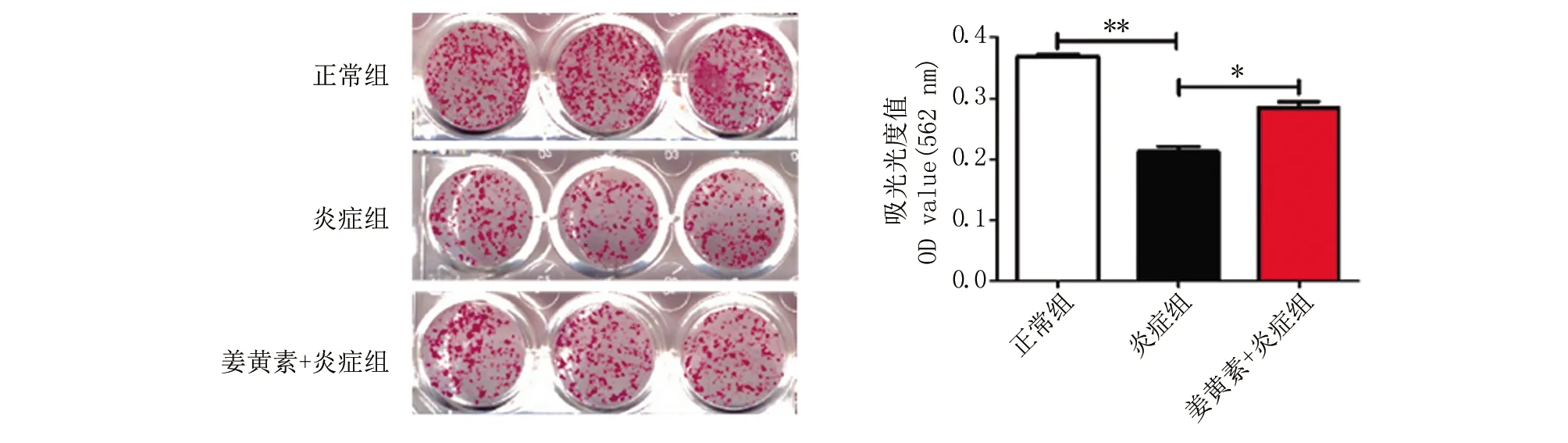
与炎症组比较,*P<0.05,**P<0.01。
2.4 qRT-PCR检测BSP、Runx2 mRNA表达情况 成骨诱导后14 d,炎症组BSP、Runx2的基因表达水平均低于正常组,P<0.01;姜黄素+炎症组可促进炎症微环境下BMSCs细胞BSP、Runx2 mRNA表达,P<0.05,见图5。

与炎症组比较,*P<0.05,**P<0.01。
3 讨论
牙周炎主要是由局部因素引起的牙周支持组织的慢性炎症性疾病,其始动因子是口腔致病微生物[10]。正常的牙周组织处于一种动态平衡状态,当细菌感染时,牙周袋内细菌分泌的毒素及代谢产物会产生大量的细胞因子,若炎症得不到及时控制,炎症可扩散到深层牙周膜、牙槽骨和牙骨质,破坏平衡状态,打破骨改建的内稳态,造成牙槽骨的吸收[11-12]。在这种炎症持续存在的情况下,骨质的重建非常困难。到目前为止,没有抑制牙周炎引起牙槽骨丧失的理想药物。为实现缺损牙槽骨的再生,需探究新的方法来提高炎症状态下的成骨分化能力。
BMSCs是一种来源于中胚层的具有多向分化潜能和自我更新能力的干细胞,可促进牙槽骨的再生、加速牙周疾病的好转乃至愈合,在组织损伤修复的治疗中有着广泛的应用前景,成为目前进行基因治疗、干细胞治疗以及骨组织工程的理想种子细胞[13]。牙周炎患者的牙周炎症微环境降低了BMSCs的骨性分化能力,影响牙周组织的再生[14]。因此,提高BMSCs的成骨分化率已成为国内外研究的热点,对牙周病的防治乃至整个骨组织工程的研究都具有重要意义。
TNF-α是牙周炎患者牙周组织中存在的一种主要促炎因子,在牙周病的发生、发展及转归进程中起着至关重要的作用[15-16],并且TNF-α 可以激活 NF-κb 通路,使炎症、增殖和凋亡相关基因的表达上调[17],所以其可以作为诱导剂诱发间充质干细胞产生炎症。本研究通过在BMSCs中加入10 ng/mL的 TNF-α,诱发BMSCs炎症反应,模拟牙周炎时骨质所处的炎症微环境,建立骨细胞凋亡模型[18]。
姜黄素是从姜科姜黄属植物姜黄、莪术等的根茎中提取的有效成分,是一种植物多酚类化合物质,具有抗炎、抗肿瘤、抗氧化、降糖等多种药理活性[19]。姜黄素在骨代谢过程中具有重要的调节作用[20],不但可以抑制破骨细胞的形成,减少骨吸收,还可以促进成骨细胞骨形成,增加骨密度,减轻骨质疏松症状[20]。Bharti等[21]研究发现,姜黄素抑制破骨细胞前体中NF-κb配体诱导的NF-κb活化的受体活化剂,并抑制破骨细胞生成。李广悦等[22]的研究显示,姜黄素可减少LPS引发的成骨细胞的凋亡,改善骨形成能力。姜黄素作用于细胞的浓度不同,对成骨及破骨的研究结果亦会产生较大的出入。为探讨姜黄素对炎症状态下大鼠BMSCs的骨向分化作用,本研究首先用不同浓度的姜黄素处理大鼠BMSCs,检测细胞活性。实验证实1 μmol/L的姜黄素干预处理,观察到其对炎症状态下大鼠BMSCs的增殖无明显影响。后续实验中,通过ALP、茜素红染色及qRT-PCR检测成骨分化水平的变化表明,炎症微环境下BMSCs的成骨分化能力降低,而姜黄素则会在一定程度上改善炎症状态下抑制的骨髓间充质干细胞成骨分化能力。
综上所述,姜黄素在一定程度上可以增强炎症微环境下BMSCs的骨向分化能力,姜黄素对细胞的炎症保护作用及促进其在炎症状态下骨向分化的具体机制还需进一步的研究。
