CD56+表达对急性单核细胞白血病儿童的临床特征、疗效及预后的影响
2021-03-22向金峰
向金峰 王 刚 张 晗 张 娴
急性单核细胞白血病(AML-M5)为急性髓系白血病(AML),临床表现主要为白细胞计数过高、髓外器官浸润等,有的还会伴急性肿瘤溶解综合征或急性呼吸衰竭、凝血功能异常等,危及患者生命安全。CD56为神经细胞粘附因子异构体(N-CAM),在AML部分患者中存在阳性表达[1-2]。CD56抗原是自然杀伤细胞表面的特异性标志,有研究报道显示AML-M5中的CD56表达与患者生物学特征及预后存在相关[3],在治疗和预后分析中具有重要的指导意义[4]。为探讨CD56+表达对AML-M5患病儿童临床特征、疗效及预后的影响,我们对84例14岁以下AML-M5患儿临床资料进行了回顾性分析,结果如下。
1 资料与方法
1.1 一般资料
选取2015年4月至2017年4月期间我院收治初诊的AML-M5 14岁以下患儿84例。纳入标准:①根据患儿临床表现、组织化学染色、细胞遗传学、骨髓细胞形态学等情况依据WHO相关诊断标准明确AML-M5诊断[5];②年龄<14岁;③意识清楚、生命体征平稳;④语言交流能力正常;⑤患儿家属知情同意研究内容并配合研究进行。排除标准:①精神或神经系统疾病患儿;②肿瘤疾病患儿;③严重肝肾功能异常患儿;④先天性心脑血管疾病患儿;⑤其他免疫系统疾病患儿。本研究内容符合医院伦理学要求。84例患儿中男性48例,女性36例,年龄最小4岁,最大14岁,平均(9.31±3.64)岁。
1.2 治疗方法
患儿均采用IA方案(去甲氧柔红霉素、阿糖胞苷)、DA方案(柔红霉素、阿糖胞苷)、MA方案(米托蒽醌、阿糖胞苷)先诱导治疗1~2个疗程,在患儿病情完全缓解时再采用大剂量的阿糖胞苷或含蒽环类药物进一步强化治疗,如患儿病情未完全缓解则采用FLAG(阿糖胞苷、氟达拉滨、粒细胞集落刺激因子)或MEA(依托泊苷、米托蒽醌、阿糖胞苷)方案治疗,每治疗1个疗程后间隔3~4周进行第2个疗程治疗,每个患儿一般治疗2个疗程。
1.3 疗效及预后观察
通过电话、复查等方式一直保持对患者的随访工作,外周血中性粒细胞计数≥1.5、骨髓中原始细胞<5%、血小板≥100×109/l,无髓外白血病,则可评定为治疗后完全缓解,持续完全缓解指从治疗后完全缓解之日起计算,期间无白血病复发达3年者[6]。
1.4 统计学方法
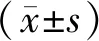
2 结果
2.1 CD56的表达及患儿临床生物学特征
84例患儿中CD56+表达共27例,阳性表达率为32.14%。CD56+患儿中男性15例、女性12例,年龄(9.26±3.80)岁,M5a 10例、M5b 17例,平均白细胞计数(73.21±12.93)×109/l,高白细胞血症14例(51.85%),髓外浸润16例(59.26%)。CD56-患儿共57例,其中男性33例、女性24例,年龄(9.35±3.45)岁,M5a 17例、M5b 40例,平均白细胞计数(54.21±10.64)×109/l,高白细胞血症9例(15.79%),髓外浸润17例(29.82%)。CD56+与CD56-患者白细胞计数、高白细胞血症及髓外浸润情况比较差异具有统计学意义(P<0.05),性别、年龄、亚型方面差异无统计学意义(P>0.05),见表1。

表1 不同CD56表达的患儿临床生物学特征
2.2 CD56的表达及患儿治疗后疗效
CD56+患儿中,10例经1个疗程、4例经2个疗程、3例经3个疗程达到完全缓解,达到完全缓解的平均疗程数为(3.10±0.85)个;CD56-患儿中,26例经1个疗程、7例经2个疗程、5例经3个疗程达到完全缓解,达到完全缓解的平均疗程数为(2.84±0.91)个,组间差异无统计学意义(t=0.999,P>0.05)。CD56+患儿完全缓解率、死亡率与CD56-患儿比较,差异亦无统计学意义(P>0.05),见表2。
2.3 CD56的表达及患儿预后
完全缓解的CD56+患儿随访期间复发率显著高于CD56-患儿,但持续完全缓解率显著低于CD56-患儿、平均生存时间显著短于CD56-患儿,差异均有统计学意义(P<0.05),见表3。

表2 不同CD56表达患儿完全缓解及死亡率比较(例,%)
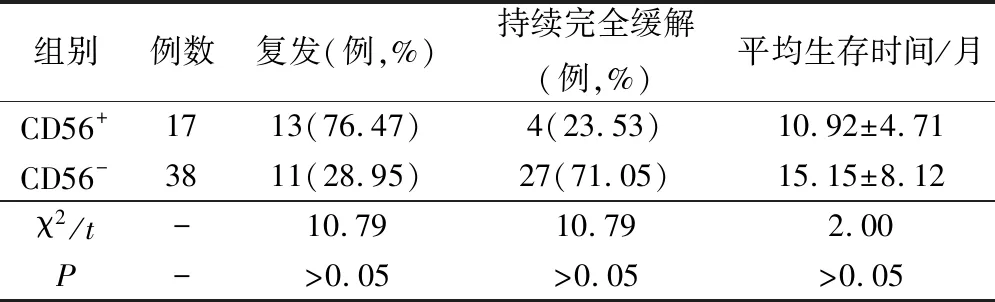
表3 不同CD56表达患儿预后分析
3 讨论
AML发病率及病死率逐年增高,在细胞遗传学和分子异常上具有高度异质性,细胞内信号传导途径、表观遗传学发生改变,发病常伴各种不良染色体核型以及多种耐药基因表达,造成患者的治疗效果及耐受性低下,因此与AML的发生、发展、预后、复发相关的研究成为热点[7-9]。AML-M5是一种特殊类型的AML,大多数患者白细胞数偏低,分类以原单和幼单核细胞增多为主,骨髓增生极度活跃或明显活跃,病程凶险,更是研究的重点和难点[10]。
CD56抗原在内分泌系统中表达较为丰富,具有介导表皮细胞进行粘附、穿膜、移居、定居等功能,因而能影响细胞的粘附功能,又被称为神经细胞粘附因子[11-12]。AML-M5部分患者存在CD56的表达,研究发现年龄、不良遗传学、白细胞计数、CD56的表达均会对AML患者的预后产生一定影响[3,6,13],其中CD56与患者的预后关系最为密切,这可能是CD56的特殊粘附功能会增加髓外浸润的发生率,因而使得患者更容易发生肿瘤细胞转移而影响预后。CD56在AML-M5儿童中是否也存在以上变化及对预后形成影响,尚不明确,本研究分析了我院收治的84例14岁以下AML-M5患儿CD56的表达及预后,结果显示CD56+表达占到患病患儿的32.14%,白细胞计数及高白细胞血症发生率、髓外浸润发生率明显高于CD56-患儿,从生物学特征分析CD56+患儿与CD56-患儿在年龄及性别、分型方面无明显差异性,表明以上因素与CD56的表达无明显相关性。
有报道认为CD56的表达对AML-M5患者的治疗疗效并无影响[14],本文研究结果发现CD56的表达对AML-M5患儿的治疗疗效也无影响,与报道是一致的,CD56+患儿化疗疗程1~3个疗程时的完全缓解率与CD56-患儿基本接近,短期内死亡率也无明显差异性。CD56的表达对患儿的预后的影响已经为临床所认识[15],认为可独立影响到AML-M5患者的预后,如存在CD56的阳性表达,则患者预后更差,其持续完全缓解时间及生存时间会明显受到影响,即使在诱导化疗期间达到完全缓解也会在短期内再次出现复发,具有不稳定性。朱嘉莳等[16]研究直接提示免疫表型CD56阳性患儿预后较差。本研究结果显示CD56+达完全缓解的患儿复发率高于CD56-患儿,持续完全缓解率低于CD56-患儿,而达到了完全缓解的CD56+患儿平均生存时间还是显著低于CD56-患儿,表明在AML-M5患儿中CD56的表达对预后的影响与上述研究相符,CD56+可影响到患儿的预后,与赵慧慧等[17]提示的CD56表达对成人AML预后的影响也是相同的。尽管CD56的表达与AML-M5的复发率、持续完全缓解率、生存时间存在一定关联,但其具体影响机制尚不明确,有报道认为其可能与PGP的过量表达有关[18],由于研究资料较少因而仍需要临床更多的实验研究结果去证实。
综上所述,CD56+表达的14岁以下AML-M5患儿较CD56-表达的患儿高白细胞血症,髓外浸润发生及复发率高,患儿平均生存时间短,这些能够为患儿的治疗及预后提供指导信息。
