上天梯沸石对重金属离子的吸附性能及其对污染土壤的修复
2021-03-22杨明慧刘意卢荣洪周凤
杨明慧,刘意,卢荣洪,周凤*
1.中国地质大学 材料与化学学院,湖北 武汉 430074;2.丽江硅材料有限公司,云南 丽江 674100
上天梯沸石矿区为珍珠岩共生矿产,该区沸石矿有两种类型:一种为熔岩型沸石矿,赋存于陈棚组杨家湾火山熔岩内,熔岩型沸石为珍珠岩脱玻化蚀变产物,主要矿物成分为斜发沸石;另一种为凝灰型沸石矿,产于陈棚组上天梯段中上部,主要矿物成分亦为斜发沸石。主要开发利用的只有斜发沸石、丝光沸石,应用于石油、化学工业、日用轻工、建筑工业、农业土壤修复、畜禽饲养、处理废水等行业[1]。重金属在水溶液和土壤中的污染愈演愈烈。由于沸石的晶体结构,发生阳离子置换后的基本结构不会改变[2],因此常常用来固定和吸附土壤中的重金属离子。
天然沸石因为内部通道大小不均匀,经过改性后可以增强吸附性和离子交换性,更好地运用于废水治理。沸石在废水治理中的各项研究结果表明了其独特的吸附性能[3-9]。在治理土壤重金属污染的过程中,沸石常用作土壤改良剂。不仅能够吸附重金属,还能促进植物对于营养元素的吸收[10]。Mahabadia等[11]研究表明,天然沸石对多种土壤中的Cd有着稳定吸附的能力。李栋[12]研究发现,在Cd污染土壤中施加沸石可以促进知母和益母草的生长,还能降低以上两种植物体内和土壤的Cd含量。刘伯元等[13]研究表明,将沸石加入化肥中配制成复合化肥,施用时可以降低土壤营养元素流失达20%以上。魏延超[14]研究表明,人造4A沸石修复Pb、Ni、Sn土壤能力比天然沸石要强,尤其是对Sn的固定效果更佳,4A沸石修复污染土壤的28 d时,与同期用天然沸石修复的Sn污染土壤,浸出浓度降低了72.93%。因此对沸石进行活化处理后的吸附性能进行研究,既有利于沸石的综合利用,也可以降低重金属在水溶液和土壤中的含量[15]。
本试验以上天梯矿区沸石为原料,研究其对水溶液中重金属(Pb、Cd、Zn)的吸附作用,对比上天梯不同矿区沸石对重金属的吸附量,选取吸附性能优良的沸石,进行活化处理后作为土壤修复材料,探究其固定土壤中Pb的可行性。
1 材料与方法
1.1 试验矿样
试验样品来自信阳上天梯不同矿区的7种沸石:AF-01、AF-02、AF-03、THF-01、THF-02、THF-03、XHF-01。通过对这些矿样进行X射线衍射分析可知,AF区沸石的主要成分为斜发沸石,其中蒙脱石含量为8%~25%,其他伴生矿物有伊利石、方石英、石英、长石等。THF区沸石的主要成分为斜发沸石,含蒙脱石19%~30%,伊利石含量一般小于7%,其他矿物有高岭石、方石英、石英、长石等。XHF区沸石的斜发沸石含量为43.91%,蒙脱石含量为48.57%,其他矿物有方石英、石英、长石等。上天梯沸石的物相分析结果详见表1。

表1 上天梯沸石物相分析结果 /%
研究矿区沸石(表2)的主要成分均为SiO2与Al2O3,SiO2+Al2O3约为 77%~82%,其中另含较多的K2O、Na2O以及MgO等,MgO及CaO含量分别为0.95%~1.04%及1.66%~2.09%,Na2O及K2O含量分别为1.20%~1.50%及2.59%~3.32%,碱金属氧化物总量约为 6%~8%,原矿的TFe含量约为1%~2%,但是AF-02的TFe含量为5.1%,主量元素化学成分可知沸石矿SiO2/Al2O3摩尔比在8.8左右。其化学成分详细结果如表2所示。

表2 上天梯沸石原矿化学多元素分析结果 /%
通过对上天梯沸石样进行表征测试,得出如图1所示的SEM图。

图1 不同矿区沸石矿SEM图像(图a、b、c分别为不同放大倍数时的电镜图)
从图1可以看出,AF沸石矿的表面较平整,孔道被某些物质填充,且放大后的表面形貌可以看出,沸石表面颗粒大小不一,相对比较杂乱不规整;THF沸石矿表面粗糙,表面上存在许多颗粒状物质,表面较均匀且分布整齐;XHF沸石矿表面形貌较致密,矿区斜发沸石呈板状,叶片状。
1.2 试验原料与试剂
本试验所用到的主要原料和试剂列于表3。
表3 试验所用原料和试剂
1.3 试验设备
本试验所用到的主要仪器和设备列于表4。

表4 试验所用仪器和设备
2 试验方法
2.1 原材料预处理
烘干并研磨上天梯七个不同矿区的沸石,过0.150 mm筛备用;配置1 000 mg/L的Cd2+、Pb2+、Zn2+溶液:将已知量的四水合硝酸镉[Cd(NO3)2· 4H2O]溶解在去离子水中配置了1 000 mg/L的Cd2+溶液。将配制的1 000 mg/L Cd2+溶液稀释用于吸附试验,稀释后的Cd2+溶液的浓度范围为2.5~250 mg/L。Pb2+、Zn2+溶液用已知量的硝酸铅[Pb(NO3)2]和六水合硝酸锌[Zn(NO3)2·6H2O]按相同方法配制。
2.2 不同沸石对水溶液中Cd、Pb、Zn的吸附性能
向7支50 mL离心管中分别加入0.2 g AF-01沸石,其中7支离心管中装有不同质量浓度的25 mL Cd2+(Pb2+)溶液,浓度分别为2.5、10、25、50、150、200、250 mg/L,pH控制在5以下,防止碱性沉淀产生。其他沸石样品同样方式处理,并将离心管放入恒温水浴振荡器(25 ℃),160 r/min条件下震荡24 h。等待达到吸附平衡后,将悬浮液置于 6 000 r/min离心机中离心10 min。收集上清液后用0.22 mm过滤器过滤之后,采用电感耦合等离子光谱仪(ICP)测量Cd2+、Pb2+质量浓度。其中沸石样品(AF-0、AF-03、THF-01、THF-02、XHF-01)按上述步骤测量Zn2+的质量浓度。
根据方程式(1)计算平衡吸附容量(qe)。
(1)
其中,qe(mg/g)是在平衡质量浓度为C0时的吸附容量;V(L)是吸附质溶液体积;C0(mg/L)是溶液中吸附质的初始质量浓度;CE(mg/L)是沸石达到吸附平衡后吸附质的剩余质量浓度;m(g)是沸石样品的质量。
为了研究沸石对Pb、Cd、Zn的吸附性能,采用了Langmuir和Freundlich的方法来拟合了吸附等温曲线,这是两种常用的吸附等温曲线。Langmuir方程用方程式(2)表示,表示了吸附质在吸附剂表面是被单层吸附的;Freundlich方程用方程式(3)表示,表明了吸附质在吸附剂表面是被多层吸附的。与Langmuir公式相比,Freundlich公式没有饱和吸附值,所适用的吸附剂表面覆盖率相对来说大一点。
(2)
(3)
式中,qe(mg/g)是平衡吸附量;CE(mg/L)为吸附平衡时吸附质在溶液中的浓度;qm(mg/g)是吸附剂对吸附质的最大吸附量;KL(L/mg)是Langmuir方程的吸附常数;KF(mg/g)和n分别是Freundlich方程式的常数。
2.3 热活化沸石对Pb的吸附试验
根据对不同沸石在水溶液中分别对Cd、Pb、Zn的吸附性能研究,选取对Pb具有最佳吸附效果的原矿沸石样品进行进一步活化处理,通过高温灼烧改性的手段,探究温度改性对沸石吸附Pb能力的影响。选取四份适量吸附性能最佳的沸石原矿,放入坩埚中。采用高温煅烧分别对沸石进行改性。四份沸石的煅烧温度分别为150 ℃、300 ℃、450 ℃和600 ℃,升温程序为2 ℃/min,煅烧2 h。
不同温度煅烧样品4个(S-150、S-300、S-450、S-600),加上未煅烧样品(S-0)共5个样品,进行改性沸石对水溶液中Pb的吸附性能试验,试验步骤同不同沸石对水溶液中Cd、Pb、Zn的吸附性能试验一样。
2.4 热活化沸石对Pb污染土壤的修复试验
本试验采用高岭土作为模拟土壤,制备了20 mg/kg的污染土壤,再用上述不同温度活化沸石对土壤进行重金属的固定。将500 g高岭土与100 mL的100 mg/L Pb2+溶液混匀,放入恒温震荡锅中恒温震荡均化30 min,保证Pb2+溶液被高岭土吸附。将该土壤放入相对湿度为85%、温度为25 ℃的培养箱中培养7 d。将培养的模拟高岭土烘干研磨,分别取50 g于5个烧杯中,将模拟污染土分别与五种不同的土壤修复剂按m(污染土)m[土壤修复剂(不同煅烧温度的沸石原矿)]m(水)=100720混匀,恒温振动均化30 min。将装有均化土壤的烧杯放入培养箱中培养7 d,期间每天取出土壤并进行搅拌混匀操作,让土壤修复剂与污染土壤充分作用。
采用2 mol/L的稀盐酸提取修复土壤中可迁移的Pb2+并测量其浓度,采用浓盐酸配置2 mol/L的稀盐酸。取2 g修复土壤与20 mL稀盐酸与离心管中混合,修复土壤与稀盐酸按质量比110比混合。将离心管置于水浴震荡锅中,25 ℃下以120 r/min震荡10 h,待静置后取上清液,通过0.22 mm过滤器过滤上清液。通过ICP测量上清液中Pb2+质量浓度。
土壤铅离子可迁移量按式(4)计算。
(4)
式中qex为可迁移量(mg/kg),cex为稀盐酸萃取的金属浓度(mg/L),Vac为稀盐酸的加入量(L),mck为被铅污染的高岭土样品质量。
3 结果与讨论
3.1 沸石对Cd的吸附试验结果
根据7种沸石对于Cd的吸附情况进行了Langmuir和Freundlich等温模型数据拟合,详细数据见表5。

表5 Langmuir和Freundlich等温模型拟合沸石吸附Cd的吸附方程理论参数
选取对Cd吸附量最大和最差沸石的Langmuir和Freundlich两种等温吸附模型,拟合后的吸附数据如图2所示。
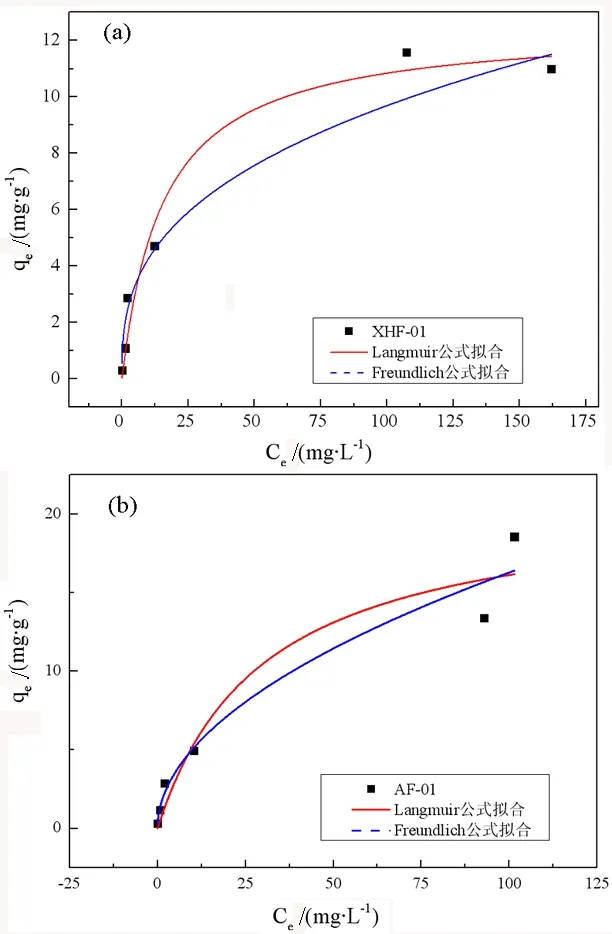
图2 沸石吸附Cd的吸附等温非线性拟合
Cd在沸石上的吸附可以用Langmuir模型来描述,说明Cd在沸石表面的吸附可以假定为单分子层间吸附。同时,根据Langmuir公式模拟计算,上天梯不同矿区产的沸石当中,AF-01样品对Cd的吸附量(qmax)最佳,达到了20.97 mg/g,而XHF-01样品对Cd的吸附量最低,仅为12.54 mg/g。此外,采用Freundlich模型进行拟合的相关系数R2较低,并不能很恰当地解释该吸附过程。
3.2 沸石对Pb的吸附
根据7种沸石对于Pb的吸附情况进行了Langmuir和Freundlich等温模型数据拟合,详细数据见表6。
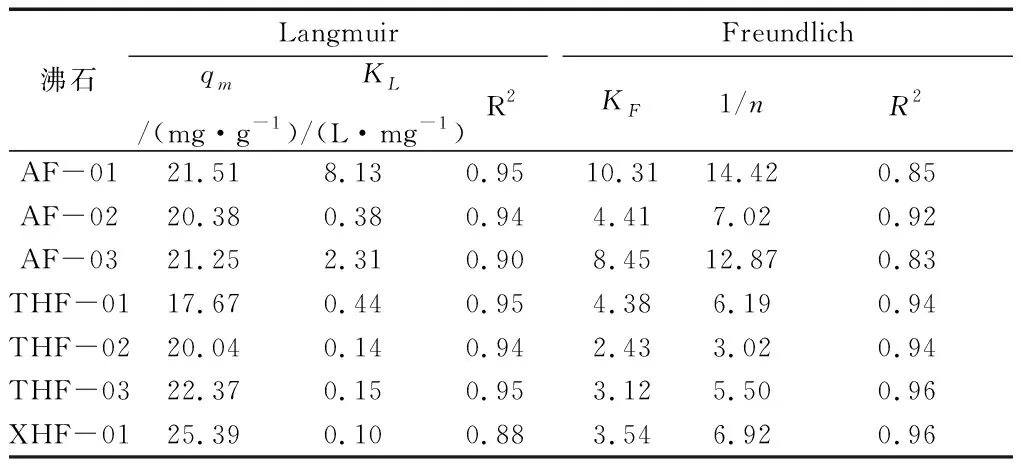
表6 Langmuir和Freundlich等温模型拟合沸石吸附Pb的吸附方程理论参数
从表6可以看出,Pb在沸石表面的吸附过程可以用Langmuir模型描述,说明Pb在沸石表面的吸附行为可以假定为单分子层的吸附。同时,采用模拟计算,不同矿区沸石中,最大Pb吸附量(qmax)最高的为XHF-01样品,达到25.39 mg/g,而对Pb吸附能力最差的为THF-01样品。
3.3 沸石对Zn的吸附
根据7种沸石对于Zn的吸附情况进行了Langmuir和Freundlich等温模型数据拟合,详细数据见表7。
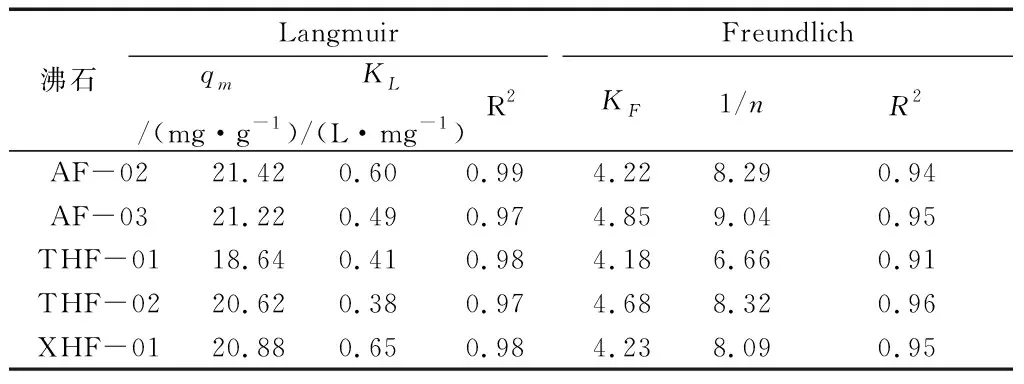
表7 Langmuir和Freundlich等温模型拟合沸石吸附Zn的吸附方程理论参数
选取了吸附效果最佳与最差的两种沸石的Langmuir和Freundlich两种等温吸附模型,拟合后的吸附数据如图3所示,拟合所得到的理论参数如表7所示。
从图3和表7可以看出,Zn在沸石表面的吸附过程可以用Langmuir模型描述,说明Zn在沸石表面的吸附行为可以假定为单分子层的吸附。同时,采用模拟计算,不同矿区沸石中,最大Zn吸附量(qmax)高的为AF-02样品,达到21.42 mg/g,而对Pb吸附能力比较差的为THF-01样品。

图3 沸石吸附Zn的吸附等温非线性拟合
对以上数据分析表明,Langmuir公式可以很好地解释沸石对三种重金属的吸附行为,说明沸石对这两种重金属的吸附属于单层吸附。沸石对这三种重金属的吸附能力有差异,对Pb的吸附效果相对而言比对Cd、Zn吸附效果好,而对Cd的吸附能力最差,这可能与离子半径和离子水合能有关。沸石XHF-01对Pb的吸附能力最强,最大吸附量qmax达到了25.39 mg/g;对水溶液中的Cd2+吸附效果最好的是沸石AF-01,最大吸附量qmax为20.97 mg/g,沸石AF-02对Zn的吸附能力最强,最大吸附量为21.42 mg/g。
因为沸石是一种具有硅酸盐骨架的晶体,硅氧四面体中的硅离子很容易被铝离子或别的金属阳离子替换,导致沸石带负电。虽然三种重金属离子核电荷数相同,但是它们并不属于同一周期,离子半径并不相同,Cd2+、Pb2+、Zn2+的半径分别为95 pm、119 pm、74 pm。 Pb2+离子半径最大,与带负电的硅氧骨架接触范围最大,很容易被吸附。同时,Pb2+离子水合能为226 kJ/mol,比Cd2+(285 kJ/mol)、Zn2+(358 kJ/mol)都小得多,可见,Pb2+与水的结合状态不稳定,所以Pb2+更容易被沸石所固定。
本次试验得出,上天梯矿区沸石对水溶液中Zn的吸附能力比Cd的强,这与潘嘉芬[14]、吕瑞阳[17]所得结果不同,猜测原因可能是因为试验所用天然沸石的Na2O含量不同。二人所用样品中,Na2O的含量分别为0.41%和0.72%,而本试验采用的7种天然沸石中,XHF-01的Na2O含量最低,为1.20%。因为吸附质离子的半径越小,更容易与沸石骨架内的Na+离子发生交换[18]。因本次试验所用沸石的Na2O含量高得多,所以对Zn2+的吸附能力比Cd2+强。这与赵启文[19]试验结果相符,未改性天然沸石对Zn2+的吸附能力比对Cd2+差,但经过NaCl改性后的沸石对Zn2+的吸附性强于Cd2+,说明吸附质离子半径越小越容易和沸石骨架上的Na+置换。
3.4 热活化沸石对Pb的吸附
根据5种热活化后的沸石对于Pb的吸附情况进行了Langmuir和Freundlich等温模型数据拟合,详细数据见表8。
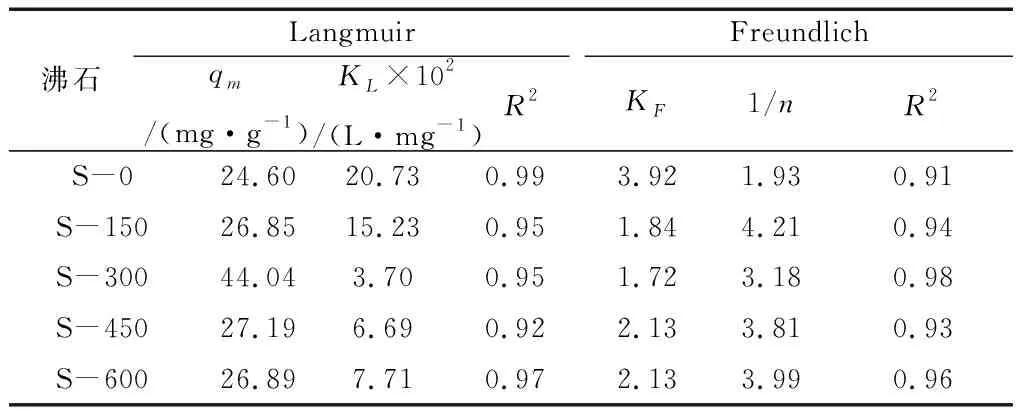
表8 Langmuir和Freundlich等温模型拟合改性沸石吸附Pb的吸附方程理论参数
5种沸石样品的Langmuir和Freundlich两种等温吸附模型拟合后的曲线如图4所示。

图4 改性沸石吸附Pb的吸附等温非线性拟合
图4和表8数据分析结果表明,在一定范围内,随着灼烧温度的上升,XHF-01沸石对水溶液中的Pb的吸附能力上升,在300 ℃温度灼烧改性下吸附能力达到峰值后,提高热活化温度改性会降低沸石对Pb的吸附能力。
3.5 热活化沸石对Pb污染土壤修复
图5显示了未处理的土壤和不同沸石样品改良土壤中的可迁移的铅浓度。未处理的土壤未处理土壤中含有最高的可迁移Pb浓度(15.8 mg/kg,在20 mg/kg的Pb水平下)。如图5所示,随着沸石热活化温度的升高,用稀盐酸可萃取的Pb含量分别为11.87、7.3、4.9、6.0、6.3 mg/kg。结果表明S-300对铅污染土壤的修复效果优于其他样品,可以使土壤中可迁移Pb量减少69.2%,因此,过高的活化温度对固化效果并没有明显的促进作用。S-300在对铅污染土壤进行修复时,吸附容量最大,吸附能力最强。

图5 不同处理土壤中稀盐酸可提取Pb含量
从图5可知,热活化处理后沸石对Pb污染土壤均有更好的钝化效果,尤其是S-300样品,显著降低了土壤中可淋洗的Pb浓度。
污染土壤中加入沸石改变重金属的形态,在土壤中掺入沸石减少水溶态和离子交换态的重金属的浓度,使重金属不会流失于地下水中,降低其在环境中的流动性和转移到植物以及食物链的风险,起到了良好了土壤修复效果。对比图6土壤修复数据和图5重金属水溶液的吸附数据可进一步发现,对于吸附性能强的沸石矿,其对污染土壤具有更好的修复能力,可推断沸石土壤修复的作用机理和吸附机理相同主要为离子交换机理,金属污染物被固定在沸石骨架中,或者随着土壤pH增加而沉淀形成了金属碳酸盐或氧化物。热活化处理提高了沸石的吸附性能,从而更好地应用在土壤修复中。
X射线粉末衍射仪(XRD)是测定晶体结构的重要手段,通过XRD测得的图谱与PCDF卡片进行对照,可以对物相进行定性,而对比衍射峰的强度可以定量。用XRD测定了热活化沸石XHF-01产品的晶相,如图6。
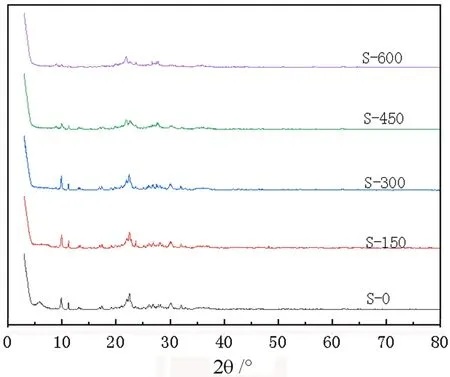
图6 热活化沸石产物XRD图
不同活化温度的热活化沸石产物的XRD图谱如图6所示,对于未改性峰沸石S-0,在2θ值为9.9°、21.045°、30.15°、37.126°分别对应沸石的衍射峰(220)、(442)、(660)和(666)。高温加热可以除掉沸石结构中原本存在的水和杂质,同时,沸石具有热稳定性,在适宜的温度范围内高温改性并不会影响其本身结构。S-300的样品峰值强度没有发生明显的变化,说明活化温度低于300 ℃时,沸石的矿物结构基本保持不变。但随着活化程度的逐渐升高,沸石的主反射强度逐渐减弱,表明沸石的结晶度在降低,沸石结构在逐渐崩塌。S-600除了沸石特征峰强度的降低,还有着其他反射峰的出现,说明沸石的结构在逐渐被破坏,新的结构逐渐在形成。说明较高的活化温度会破坏沸石的晶体结构,从而影响其固载金属的能力。
利用复合BET(multi-Brunauer-Emmett-Teller)法测定不同温度活化沸石的比表面积,结果如图7所示。

图7 不同温度活化沸石的比表面积
如图7所示,随着改性温度升高到300 ℃,沸石比表面积增加到最大值38.8635 m2/g,随着温度的进一步升高,沸石的比表面积开始下降。300 ℃以下加热沸石,会使沸石空洞和孔道中的水大量溢出,但不会引起内部晶体结构的变化,所以一开始活化沸石的比表面积会增大。随着温度进一步上升,沸石的晶体结构逐渐开始坍塌,孔道缩小,导致比表面积降低。热活化沸石的比表面积变化与其对水溶液中Pb2+的吸附量变化一致,说明沸石的吸附性能与其比表面积有关,比表面积越大,沸石的吸附能力和钝化重金属的能力越强。
4 结论
(1)试验用沸石的主要成分为SiO2和Al2O3,占比约77%~82%,还含有较多的K2O、Na2O、MgO、CaO。同时,AF-02因为TFe含量比较高,呈现了绿色。通过扫描电镜分析,各矿区沸石呈现板状、叶片状,其中AF沸石的表面比较平整,而THF沸石表面较为粗糙。
(2)通过吸附-平衡法试验,矿区沸石对三种重金属的吸附都可以假定为单分子层吸附,沸石对三种重金属的吸附能力为Pb>Zn>Cd,其中沸石XHF-01对Pb的吸附能力最强,达到了25.39 mg/g,对Cd在水溶液中吸附能力最好的是AF-01,吸附量为20.97 mg/g,沸石AF-02对Zn的吸附能力最强,最大吸附量为21.42 mg/g。沸石对不同重金属在水溶液中的吸附能力不同,可能和重金属离子本身的半径、水合能以及沸石的化学组成有关。
(3)不同温度热活化沸石XHF-01在溶液中和在土壤中对Pb的吸附能力变化一致,随着热活化温度的逐渐升高,XHF-01在水溶液和土壤中对Pb2+吸附能力升高,热活化温度达到300 ℃后,吸附、钝化能力逐渐下降。根据XRD图像分析,热活化温度在300 ℃以上会导致沸石结构的逐渐破坏和新结构的形成,影响了其的吸附、钝化能力。用300 ℃热活化沸石XHF-01修复Pb污染土壤的能力最好,可使土壤中可迁移Pb量降低69.2%左右。在适宜的温度下,热活化沸石是一种提高沸石修复重金属污染土壤能力的有效办法。
